24. éves glaukómajelentés
A glaukómáról szóló éves frissítés további cikkeinek elolvasásához kövesse az alábbi linkeket:
Glaukómaellátás lézeres precizitással
MIGS őrület: An Atlas of Options
Comanaging Invasive Glaucoma Surgeries
Glaucoma: (Keressen 2 CE kreditet)
A szakértők még nem jutottak konszenzusra a glaukóma általánosan elfogadott etiológiájáról. Abban azonban egyetértenek: a szemnyomás (IOP) csökkentése az egyetlen módosítható kockázati tényező, amely lassítja a betegség előrehaladását. A topikális farmakoterápia a hagyományos első vonalbeli megközelítés, és a lehetőségek bőségesebbek, mint valaha.
Ez a cikk, a Take Charge of Glaucoma sorozatunk harmadik része, feltárja a számos gyógyszert, amelyet az OD-k alkalmazhatnak, és tanácsokat ad arra vonatkozóan, hogy mikor melyik terápiát melyik betegnél érdemes alkalmazni.
Egy korai autonómia
A vegetatív idegrendszerre ható gyógyszerek (pl., kolinergikumok és adrenergikumok) az 1800-as évek óta a glaukóma terápiájának alapját képezik.1,2 A kolinergikumok miózist idéznek elő, ami megnyújtja és stimulálja a trabecularis hálót (TM), hogy növelje a vizes kiáramlást ott és a Schlemm-csatornába.3 Ebbe az osztályba tartozik a pilokarpin, a karbachol, a fizosztigmin, a neosztigmin és az ecothiophate. Ezek közül csak a pilokarpon van még rutinszerű használatban. A kezelés dózisfüggő választ mutat, az IOP körülbelül 20%-kal csökken, ha QID-t írnak fel.4
Take Charge of Glaucoma
A négyrészes glaukóma-sorozatunk további cikkeinek elolvasásához kövesse az alábbi linkeket:
Első rész: Glaukóma: Második rész: A diagnosztikai eszköztár előkészítése
Negyedik rész: Play a Part in Postoperative Glaucoma Care
Bár hatékony, a kolinerg szerek alkalmazását korlátozzák a szemészeti és szisztémás mellékhatások. Ezek közé tartozik a ciliáris izomgörcs (társuló fejfájással és indukált rövidlátással), miózis, szaruhártya-toxicitás, bőrpír, uveitis, lehetséges szürkehályogképződés, légzésdepresszió és gyomor-bélrendszeri zavarok. Továbbá az újabb gyógyszerek nagyobb IOP-csökkentő hatékonysággal rendelkeznek, így a kolinerg szerek csak olyan speciális esetekre maradnak fenntartva, ahol a miotikus hatásnak további előnye lehet, például akut szögzáródás esetén.
Az adrenerg agonisták másrészt az alfa- vagy béta-adrenerg receptorokra hatnak (vagy mindkettőre, ha nem szelektívek). Az adrenalin, az elsődleges nem szelektív szer, csökkenti az IOP-t azáltal, hogy először csökkenti a víztermelést, majd növeli a TM-en keresztül történő kiáramlást.5 Sajnos, a jelentős szisztémás mellékhatások miatt korlátozottan alkalmazható. Az epinefrin 1970-es években kifejlesztett prodrugja, a dipivefrin lehetővé teszi az alapvegyület sokkal alacsonyabb koncentrációjának alkalmazását, kevesebb szisztémás hatás mellett.6 A nem szelektív adrenergikumokat ma minimálisan alkalmazzák, kivéve azokat az eseteket, amikor más gyógyszerek ellenjavalltak.
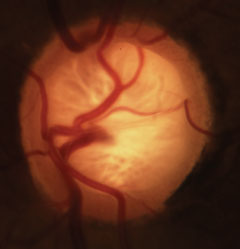
Glaukómás cupping a neuroretinalis perem, a lamina és az érrendszer jellegzetes elvesztésével. Kattintson a képre a nagyításhoz.
Béta-blokkolók
Az adrenerg antagonisták vagy béta (β)-blokkolók gátolják a víztermelést, és az új gyógyszerek összehasonlításának mércéjét jelentik. Konkrétan a β-blokkolók csökkentik az ultraszűrést, ami korlátozza a hátsó kamrába történő továbbításra rendelkezésre álló víztartalmú szubsztrát elérhetőségét.1,7,8 Ezek a gyógyszerek lehetnek nem szelektívek, vagyis gátolják a β-adrenerg receptorok mindkét izoformáját (β1 és β2), vagy kardioszelektívek, amelyek sokkal nagyobb affinitással rendelkeznek a β1 receptorhoz. A β2 a szem uralkodó adreno-receptora, ezért a nem szelektív szerek nagyobb hatással lesznek az IOP szabályozására.9,10
A topikus β-blokkolók közé tartozik a timolol, a levobunolol, a metipranolol, a carteolol és a betaxolol. Csak a betaxolol kardioszelektív – ami bizonyos ellenjavallatok esetén hasznos, de kevésbé hatékony lehet az IOP csökkentésében.11 A β-blokkolók 20-30%-kal csökkentik az IOP-t, és naponta kétszer adagolhatók. Naponta egyszer is adagolhatók, különösen gélképző oldatok használata esetén, a megnövekedett szemkontaktus ideje miatt.12,13 Az adrenerg antagonistáknak kisebb lehet a hatásuk alvás közben, ezért óvatosnak kell lenni, ha a β-blokkolókat lefekvéshez közel adagolják, különösen, ha napi egyszeri kezelésként írják fel őket.14,15 Ha a betegek szisztémás β-blokkolókat szednek, a lokális β-blokkolók szemészeti vérnyomáscsökkentő hatása csökken, és a lokális gyógyszerek más osztályai is szóba jöhetnek.16
Bár ezt a gyógyszercsoportot többnyire kerülni kell tüdő- vagy szívbetegségben, kiválasztott esetekben indokolt lehet a béta-blokkoló kezelés megfontolása. Ezt azonban a megfelelő szakorvos (kardiológus vagy tüdőgyógyász) beleegyezésével kell végezni.
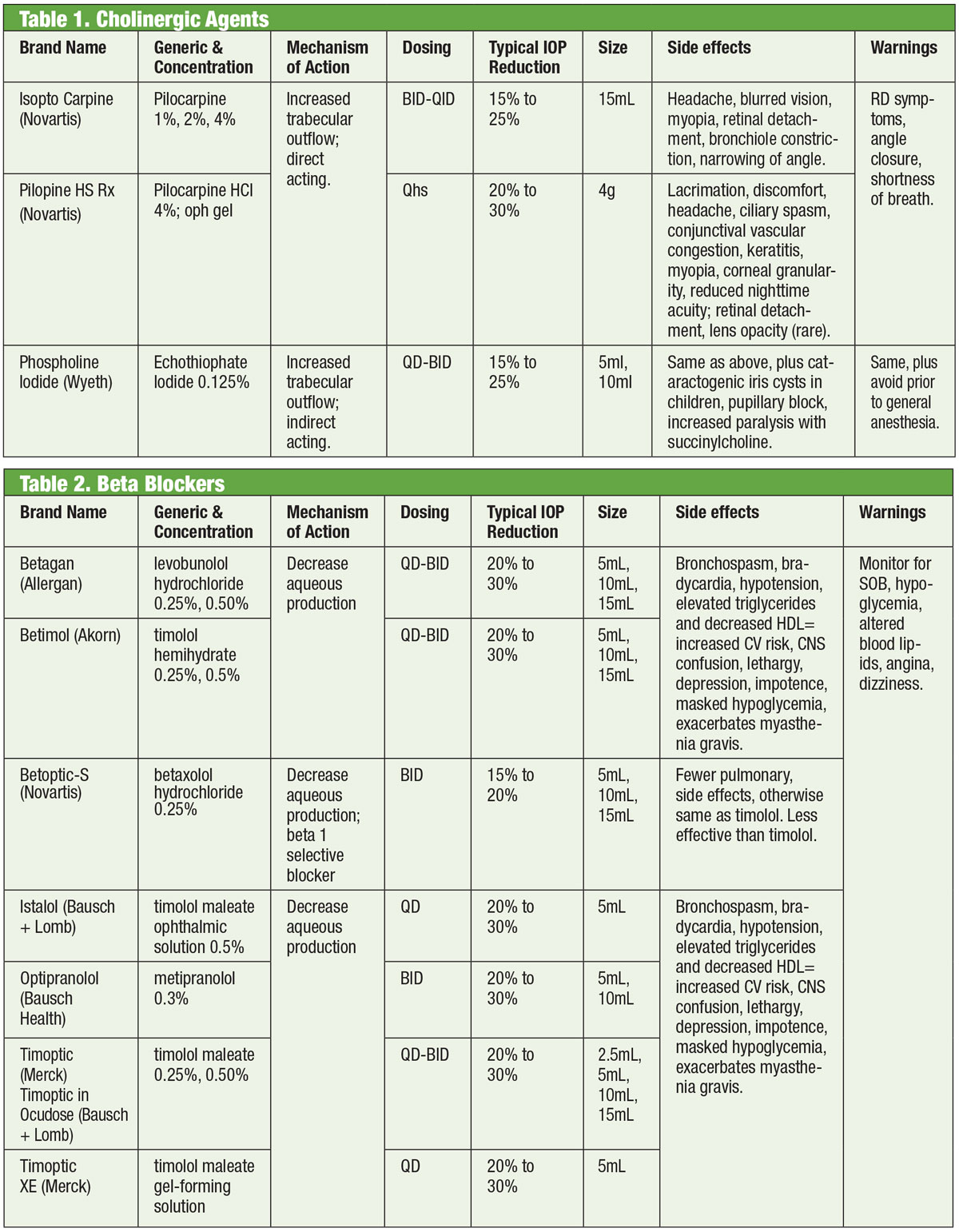
Táblázatok: Bruce Onofrey, OD, RPh. A nagyításhoz kattintson a képre.
Általában azonban a β-blokkolók alkalmazása kerülendő atrioventrikuláris blokkban, sinusbradycardiában és obstruktív tüdőbetegségben szenvedőknél.17
Karbonanhidráz-gátlók
A kutatók már az 1950-es évek óta elismerik az orális szénhidráz-gátlók (CAI) IOP-csökkentő képességét.18 Ezt a víztermelés elfojtásával érik el.18 A szisztémás mellékhatások (például fáradtság, gyomor-bélrendszeri zavarok és paresztézia) azonban korlátozzák krónikus alkalmazásukat glaukómában.18 Az orális CAI-kat még mindig alkalmazzák olyan esetekben, amikor a lokális CAI-k túlérzékenységet okoznak, vagy amikor a cseppek használata kizárt, valamint akut zugzáródás esetén.18 A lokális változat megfogalmazására tett kísérletek az 1990-es évek közepén a dorzolamid, majd nem sokkal később a brinzolamid bevezetésével sikerrel jártak.19
A karbonsav anhidráznak (CA) legalább hét különböző izoenzimje van, a CA-II a ciliaris folyamatokban dominánsan részt vesz a víztermelésben.18 A dorzolamid és a brinzolamid egyaránt hatékony gátlója ennek az izoenzimnek, de számos klinikailag releváns különbséggel rendelkeznek. Például a dorzolamid pH-ja 5,6, míg a brinzolamidé 7,5 pH-val rendelkezik. Ezenkívül a brinzolamid szuszpenzió formájában kapható. Ez csak néhány azon tulajdonságok közül, amelyek magyarázatot adhatnak a termékek egyedi mellékhatásaira, amelyek közé a dorzolamid esetében a szúrás, a brinzolamid esetében pedig a homályos látás tartozhat.19
Noha a gyógyszereket az FDA TID adagolásra címkézi, néhány gyakorló orvos a BID adagolás mellett dönt. A brinzolamid esetében a III. fázisú vizsgálatok klinikailag egyenértékű IOP-csökkenésről számolnak be akár BID, akár TID adagolással.20 Mások a dorzolamid esetében nem számolnak be statisztikailag szignifikáns különbségekről a BID vagy TID adagolás között.18 Mások viszont monoterápia esetén a TID adagolást, kiegészítő terápiaként történő alkalmazás esetén pedig a BID adagolást javasolják.21
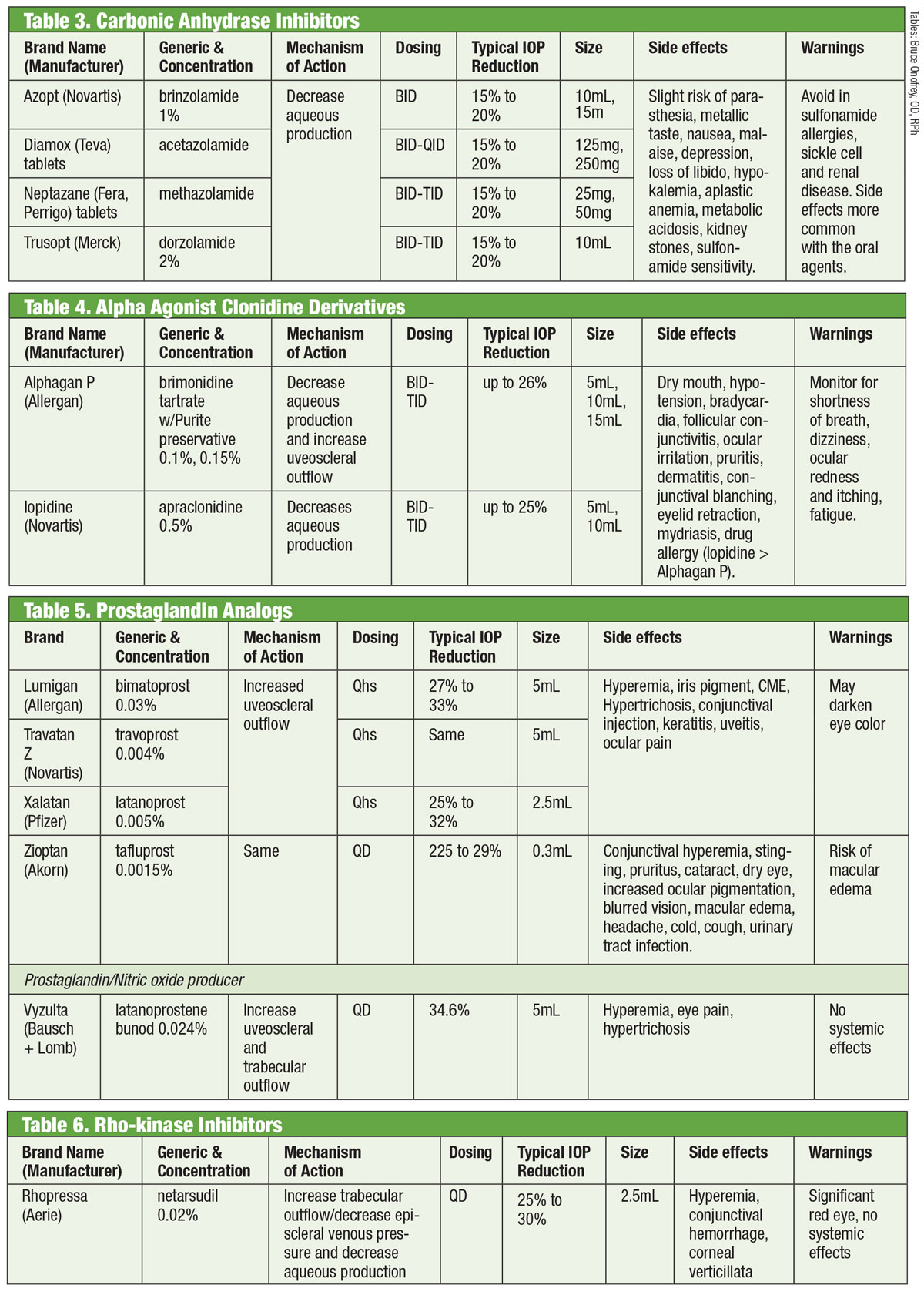
Táblázatok: Bruce Onofrey, OD, RPh. Kattintson a képre a nagyításhoz.
Alfa-agonisták
A klonidin képviselte a legkorábbi alfa-agonistát (AA), amely hatékonyan csökkentette az IOP-t. Azonban még helyileg alkalmazva is mélyreható szisztémás mellékhatásokat, bradikardiát, szedációt és hipotenziót okozott.22 Az apraclonidin amidcsoport-helyettesítésével csökkent a vér-agy gát penetrációja, és így a mellékhatások is. Sajnos az idővel csökkenő hatékonysága és a szemallergia megnövekedett előfordulása miatt rövid távú használatra korlátozódik.
A 1997-ben bevezetett brimonidin egy erős AA, amely 32-szer nagyobb szelektivitással rendelkezik a β2 adrenoreceptorok iránt, mint az apraclonidin.22 Kettős mechanizmuson keresztül csökkenti az IOP-t: csökkenti a víztermelést és növeli az uveoscleralis kiáramlást.23 Elődjéhez hasonlóan figyelemre méltó az allergia aránya (akár 20%), amely akár nyolc hónappal a terápia megkezdése után is jelentkezhet.22 Három formulát fejlesztettek ki, mindegyik hasonló hatékonysággal: 0,2%-os benzalkónium-kloriddal (BAK); valamint 0,15%-os és 0,1%-os Purite tartósítószerrel.24 Az Allergan azóta megszüntette a BAK-konzervált formulát.
The Straight Dope
Az orvosi marihuána az utóbbi időben nagy hírverést kapott, köszönhetően az Egyesült Államokban bekövetkezett számos törvényi változásnak. Bár már az 1970-es évek óta kutatják az IOP csökkentésének módszereként, a kutatók csak rövid ideig találták alkalmasnak az IOP csökkentésére. Ez, párosulva a meglehetősen súlyos mellékhatás-profiljával, kevéssé alkalmassá teszi a kezelésre. A kutatások szerint azonban szerepet játszhat “olyan végstádiumú glaukómás betegeknél, akiknél a maximális gyógyszeres kezelés és a műtét kudarcot vallott, vagy akik rossz műtéti jelöltek.”
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Noha a mellékhatások többnyire a prosztaglandinok használatával korrelálnak, a szakirodalom a brimonidin által kiváltott elülső uveitisről számol be.25 Az időtartam hét naptól öt évig terjedt, átlagosan közel 20 hónapig.
Prosztaglandin-analógok
Ezek biztosítják az összes csepp közül a legerőteljesebb IOP-csökkentést az uveoscleralis vizes kiáramlás fokozásával. A prosztaglandin analógok (PGA-k) a ciliáris testben lévő receptorokhoz kötődve simaizom relaxációt idéznek elő, és megváltoztatják az extracelluláris mátrixot a ciliáris izomzatban, hogy növeljék a vizes kiáramlást az uveoscleralis útvonalakon keresztül.26 Naponta egyszer, általában lefekvéskor adagolva a PGA-k 30%-35%-os IOP-csökkenést eredményeznek; a lehetőségek közé tartozik a latanoprost, a bimatoprost, a travoprost és a tafluprost (egyadagos, tartósítószermentes változatban).26 A PGA-k leggyakoribb mellékhatása a kötőhártya hiperémia, gyakran a terápia megkezdése utáni első néhány hétben.26 Szemirritáció, a meglévő gyulladásos állapotok súlyosbodása (makulaödéma, iritis), a periorbitalis zsírpárna sorvadása, a periocularis bőr, a szempillák és az írisz pigmentációja, valamint hypertrichosis is előfordulhat.26
A prosztaglandin analógok kategóriájában új változat a latanoprosztén bunod 0,024%. Ennek a vegyületnek kettős mechanizmusa van: növeli az uveoscleralis kiáramlást és fokozza a trabecularis meshwork kiáramlását a nitrogén-oxid hatására.27 A szem kétszeresen bontja le a latanoprostene bunodot, hogy a latanoprosztonsavat és a nitrogén-oxidot aktív komponensekké alakítsa28. Az utóbbi hatással van egy jelátviteli útvonalra, amely ellazítja a TM kontraktilis komponenseit, ami növeli a kiáramlást.28 A további hatás csökkenti az IOP >1mm Hg-t a csak latanoprosttal szemben több időpontban, az IOP teljes csökkenése 7,5mm Hg és 9,1mm Hg között változik. A latanoprosztán bunod mellékhatásai hasonlóak voltak, mint a latanoproszt önmagában, a vizsgálók szerint esetleg kevesebb periocularis pigmentációval és hipertrichózissal.28,29
ROCK-gátlók
A normális szemben a vizes nedv fő elvezető útvonala a TM. A glaukómás betegeknél a vizes nedvnek ezen a struktúrán keresztül történő ellenállása megnő, ami növeli az IOP-t.30 Egészen a közelmúltig a glaukómagyógyszerek nem ezt a struktúrát célozták meg. Ez 2017-ben megváltozott a Rhopressa (netarsudil 0,02%, Aerie), egy rho-kináz (ROCK) gátló bevezetésével.
táblázat: Bruce Onofrey, OD, RPh. Kattintson a képre a nagyításhoz.
A rho-kináz számos szövetben, köztük a TM-ben is széles körben expresszálódik, ahol elősegíti az aktin stresszrostok összeszerelődését és szabályozza a sejtek összehúzódását.31 A ROCK-gátlók növelik a vizes kiáramlást azáltal, hogy csökkentik az aktin és miozin által vezérelt sejtkontrakciót és csökkentik az extracelluláris mátrix fehérje termelését.32 A Rhopressa a noradrenalin transzporterrel (NET) szemben is gátló hatású, így ROCK/NET-gátló. A NET mechanizmus a noradrenalin által kiváltott vazokonstrikció révén a ciliáris test csökkent véráramlásának eredménye lehet, ami csökkent víztermelést eredményez.33 Emellett a netarsudil csökkenti az episzklerális vénás nyomást (EVP) is, így több utat biztosít az IOP csökkentésére.32 A leggyakoribb szemészeti mellékhatás az okuláris hiperémia (a kezelt betegek mintegy felénél), amely a legtöbb esetben enyhe, átmeneti és magától megszűnik.32
Megjegyzendő, hogy maga a rho fontos szerepet játszik az axonok növekedésében és irányításában, valamint a neuronok túlélésének és halálának szabályozásában.34 A kutatók megállapították, hogy a látóideg sérülését követően a netarsudil helyi alkalmazása csökkenti a retinális ganglionsejtek halálát és elősegíti az axonok regenerálódását.34
A keverékbe kerülés
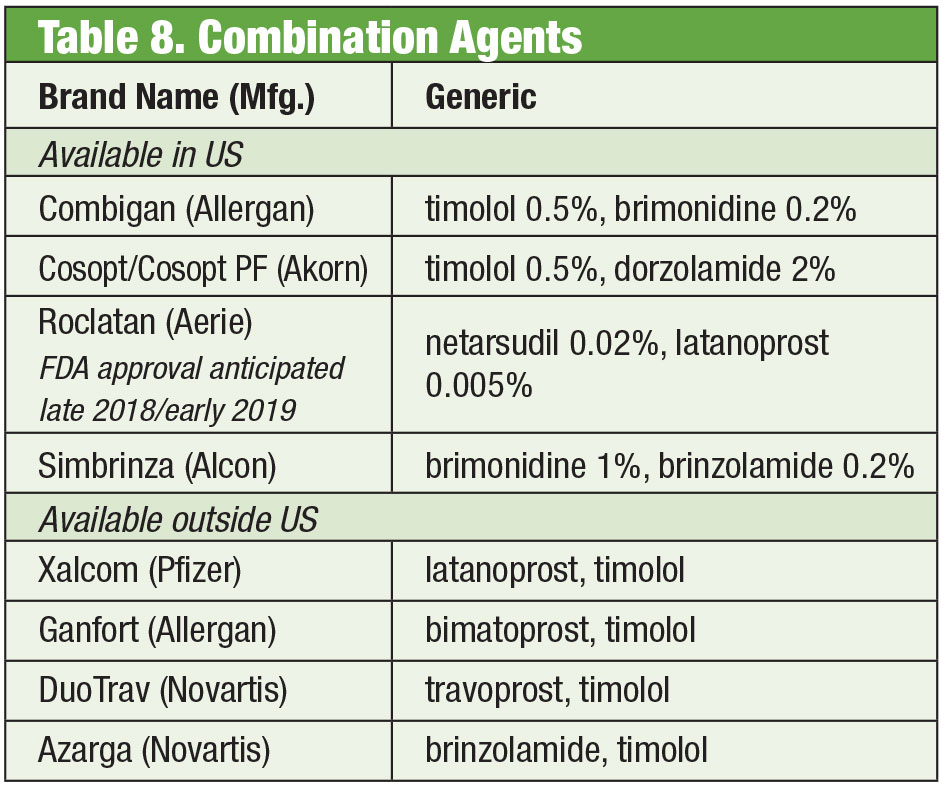
Néha a betegeknek többre van szükségük, mint amit a készen kapható termékek nyújtanak. A betegek érzékenysége vagy a tartósítószerek krónikus használatából eredő szemfelszíni toxicitás alternatívák kereséséhez vezethet. Egyes összetett gyógyszerek tartósítószermentesen is kaphatók. Ha a compliance problémát jelent, ezek a keverékek akár négy gyógyszert is tartalmazhatnak egyetlen üvegben. Továbbá számos fix kombinációt az Egyesült Államokon kívül is hatékonyan alkalmaznak, de az FDA jelenleg nem hagyta jóvá őket; a keverékkeverés lehetővé teszi az amerikai orvosok számára, hogy hozzáférjenek ezekhez a készítményekhez. Ha a költség korlátozza a gyógyszerkeverés további előnyt jelenthet. Bár az összetett készítményt gyakran nem fedezi a beteg biztosítási csomagja, egy vagy két kombinált készítmény ára költséghatékonyabb lehet, mint a több, egy gyógyszerből álló, akár generikus készítmények ára. Két összetett gyógyszertár több előre beállított variációt kínál: Az Imprimis Pharmaceuticals Simple Drops és az Ocular Science Omni termékcsaládja. Mindegyiknél további testreszabás is lehetséges.
Bár az egyes szerek FDA által engedélyezettek, bizonyos kombinációk nem biztos, hogy azok. A gyakorló orvoson múlik, hogy mérlegelje a megfelelés kockázatait és előnyeit.
Komponált glaukómás termékek:
Simple cseppek (Imprimis Pharmaceuticals)
Mindegyik tartósítószermentes.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidin/dorzolamid)
– Tim-Brim-Dor PF (timolol/brimonidin/dorzolamid)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-…Brim-Dor-Lat PF (timolol/brinzolamid/dorzolamid/latanoprost)
– Dor-Tim (dorzolamid/timololol)
– Dorzolamid PF
– Latanoprost PF
Omni csepp (Ocular Science)
Benzalkónium-kloridot tartalmaz, de alacsonyabb koncentrációban (0.001%), mint az általános generikus készítmények (0,002%).
– Timolol/latanoprost
– Timolol/brimonidin/dorzolamid (AM formula)*
– Timolol/brimonidin/dorzolamid/latanoprost (PM formula)*
* Együttes alkalmazásra szánták, az AM változatból hiányzik a prosztaglandin, amelyet általában csak naponta egyszer adagolnak.
Fixált kombinált készítmények
Az egyes készítmények hatékonysága ellenére gyakori, hogy sok glaukómás betegnek többféle terápiára van szüksége állapotának ellenőrzéséhez.35 Ha kettős terápiára van szükség, a legjobb lehet, ha ugyanazt az adagolót kínálják, ami elősegíti a nagyobb compliance-t és csökkenti a toxicitás szemfelszínre gyakorolt hatását.36 A timolol brimonidinnel (Combigan, Allergan) és dorzolamiddal (Cosopt, Akorn) párosul, mindkettőt naponta kétszer adagolva, a timolol-dorzolamid termékhez tartósítószermentes változat is rendelkezésre áll. Egy másik, naponta kétszer alkalmazott kombináció – a Simbrinza – a brimonidint és a dorzolamidot párosítja. A fix kombinációk jó hatékonyságot mutatnak mind elsődleges terápiaként, mind a PGA-k kiegészítéseként. A mellékhatások az egyes komponensekhez hasonlóak.
Adherencia/betegfelfogás
Bár a kezelés ajánlására vonatkozó döntés összetett lehet és sok tényezőtől függ, amint az orvos és a beteg megegyezik a terápia megkezdésében, bizonyos háttértényeket tudomásul kell venni és alapvető tantételeket kell alkalmazni.
A nagyításhoz kattintson a képre.
A látómező progressziója és a betegség súlyossága összefügg a rossz adherenciával.37 A krónikus betegségben szenvedő betegek átlagosan az előírt gyógyszeradagok 30-70%-át használják fel, és egy tanulmány szerint 50%-uk a terápia első néhány hónapjában abbahagyja a gyógyszerszedést.38 A glaukóma gyógyszereinek adherenciája hasonlóan rossz, mint más krónikus betegségek esetében.38 Ennek megfelelően létezhet egy hatékonysági-hatásossági szakadék, ahol, bár a nagy klinikai vizsgálatokban bebizonyosodott, hogy a helyi gyógyszerek hatékonyak, a gyakorlatban a betegek be nem tartása miatt hatástalanok lehetnek.39
A glaukómában a rossz adherenciához hozzájáruló főbb tényezők többek között a következők: a gyógyszerek mellékhatásprofilja, a terápia költsége, a betegoktatás és az orvos-beteg kapcsolat.40 Emellett a betegség egészen késői stádiumáig tünetmentes lehet, és a látótércsökkenés nem tudatosul.41
És most valami egészen másról
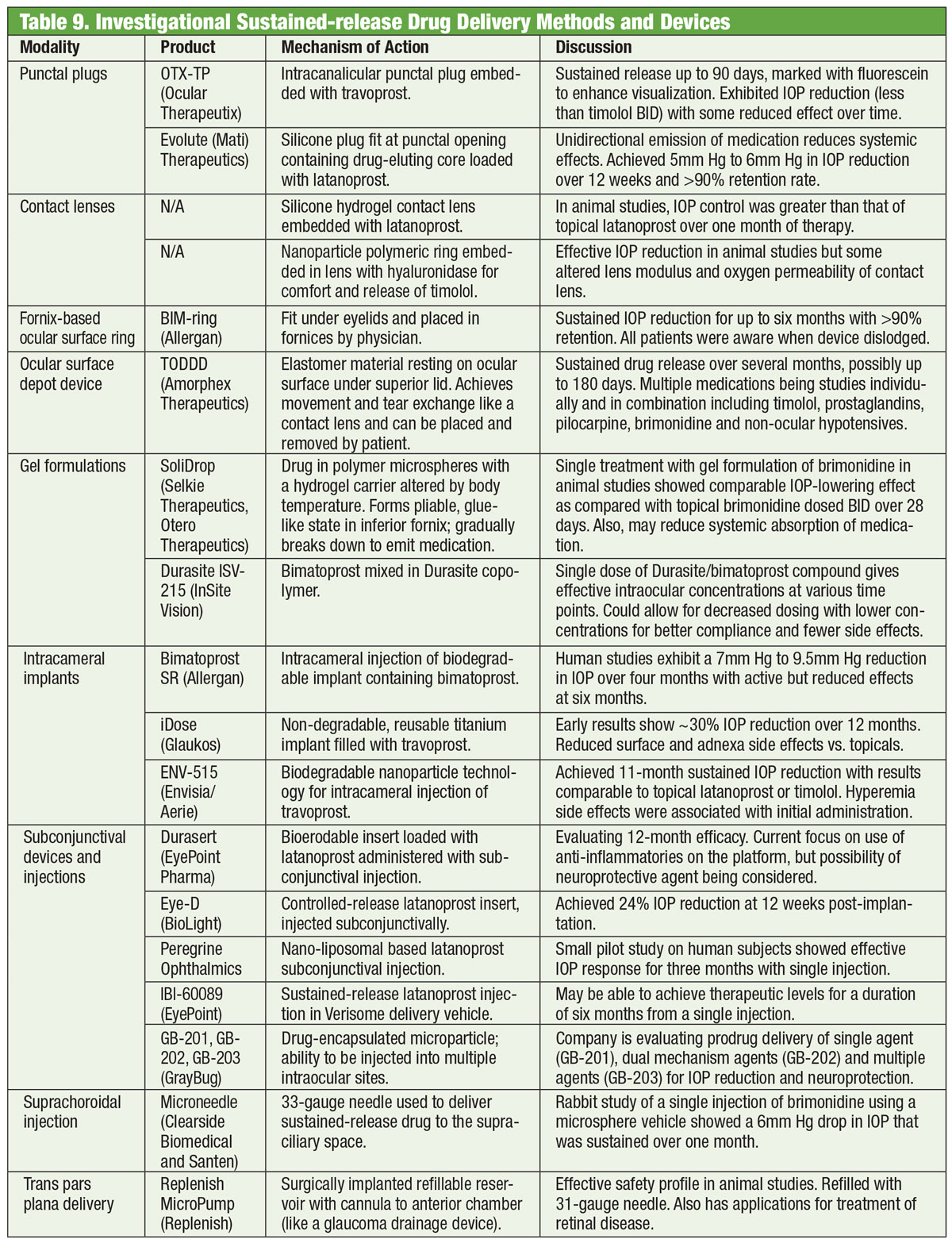
A glaukóma kezelésének gerincét jóval több mint egy évszázada a gyógyszerek adják, és az új gyógyszerek fejlesztése töretlenül folytatódik. Néhány kutató azonban a palackon túli alternatívákat keres. Az elektromágneses tekercsbe ágyazott szemüvegek, egy nyomokban aranyat tartalmazó kontaktlencsével párosítva, egy napon talán segíthetnek az IOP csökkentésében. A Bionode nevű cég által kifejlesztett kombinációt úgy tervezték, hogy elektromos áramot generáljon, amely a csillóizmokon keresztül áramlik, hogy serkentse a természetes vízelvezető utat és csökkentse az IOP-t.
American Academy of Ophthalmology. A szemüveg egy nap a glaukóma kezelésére szolgálhat. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Hozzáférés: 2018. július 3.
Az adherencia további akadálya a cseppek instillációjával és az adagolási ütemezéssel kapcsolatos nehézségek.42 Valójában a betegek akár 80%-a szennyezi a cseppeket azzal, hogy megérinti az arcát, akár 61%-uk nem pontosan egy cseppet instillál, és ami a legkritikusabb, akár 37%-uk kihagyja a szemét a cseppel.43 A kezelőorvos soha nem feltételezheti, hogy a beteg jártas a cseppek instillációjában. A cseppterápia megkezdése előtt tanítsa meg a páciensnek, hogyan kell megfelelően cseppet beadni, és a rendelőből való távozás előtt sikeresen mutassa be a cseppek beadását. Ez hatékonyan delegálható egy optometriai technikusra, és megerősíthető a technikáról szóló oktatási tájékoztatóval (nyomtatható PDF a www.glaucoma.org/treatment/eyedrop-tips.php oldalon), valamint olyan videók használatával, mint például a Glaukóma Kutatási Alapítvány (www.glaucoma.org/treatment/putting-in-eye-drops.php) által készített videó.
Ha a betegnek jelentős nehézséget okoz a szemcseppek befecskendezése, egy mechanikus adagolási segédeszköz javíthatja a siker valószínűségét. A helyes adagolási rend betartása javul az automatizált távközlési alapú emlékeztetők, okostelefon és tablet alapú emlékeztető alkalmazások használatával.44,45 A rendelőben történő oktatás, a célmeghatározás, az egyszerűsített cseppkezelési rend és a technológia kombinációját kell alkalmazni az adherencia javítása érdekében.46 A gyógyszeradherencia ismert akadályainak kezelése szükséges első lépés a siker felé.
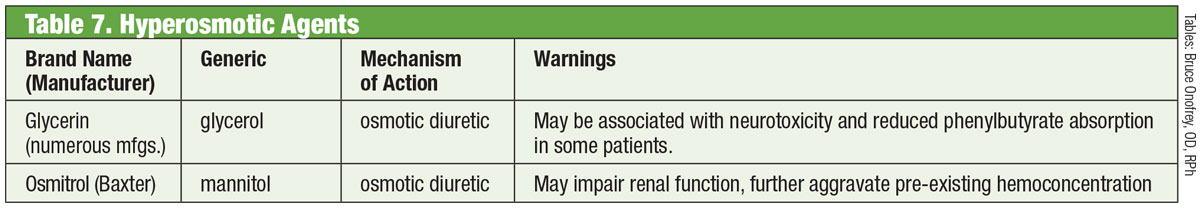
Dropping the Pressure
Az IOP az egyetlen ismert módosítható glaukómás kockázati tényező, és csökkentése tagadhatatlanul bizonyítottan csökkenti a betegség progressziójának kockázatát.47,48 Az IOP hatékony csökkentése így a cél a glaukómás betegek kezelése során. A betegség pontos besorolását követően általában terápiás célt határoznak meg. Az Egyesült Államokban alkalmazott preferált gyakorlatok egy olyan IOP céltartományt javasolnak, amelyről a klinikus úgy véli, hogy prospektíve csökkenti a betegek élethosszig tartó vakságának kockázatát, miközben egyidejűleg minimalizálja a kezeléssel kapcsolatos terheket.49-52
Noha többféle módszer is segíthet a kezdeti IOP célérték meghatározásában (küszöb IOP, számított, egy méret illik mindenre), a legegyszerűbb és leginkább bizonyítékokon alapuló módszer az IOP egy százalékkal való csökkentése a kiindulási napi csúcs IOP-hez képest, amelynél a látóideg károsodása bekövetkezik. Az IOP dinamikus, és rövid és hosszú távú ingadozásokat mutat, ami miatt a jelenleg rendelkezésre álló tonometria nem tökéletesen reprodukálható. Ezért ajánlott, hogy a klinikus a kezelés megkezdése előtt a nap különböző időpontjaiban több IOP-értéket mérjen le, hogy megpróbálja meghatározni a napi IOP-csúcsot, amelyből kiindulva a céltartományt meg lehet határozni.53-55 Azonban több 24 órás IOP-görbe felvételének hiányában nem valószínű, hogy valaha is meg lehet határozni a valódi csúcsot. A klinikusnak végső soron a sikeres kezelést a strukturális és funkcionális tesztek progressziójának csökkentése alapján kell megítélnie.48,56,57
Az IOP százalékos csökkentésének ajánlott célértéke az állapottól függően 20% és 50% között mozog (pl, glaukóma gyanúja, okuláris hipertónia, normál feszültségű glaukóma, magas feszültségű glaukóma, szögzáródásos glaukóma), a betegség alapszintű súlyosságától és a várható élettartamtól függően.58-61
Táblázat: Bruce Onofrey, OD, RPh. Kattintson a képre a nagyításhoz.
A kezdés
A PGA-kat az Egyesült Államokban első vonalbeli kezelésre engedélyezték, és hatékonyabbak az IOP csökkentésében, viszonylag korlátozott mellékhatásprofiljuk van, és ritkábban (naponta egyszer) adagolják őket, mint más gyógyszercsoportokat.62,63
Mihelyt kiválasztottak egy adott szert, a beteget legfeljebb négy hét múlva újra meg kell nézni, hogy felmérjék a csepp hatékonyságát, megelőzzék az esetlegesen fellépő nemkívánatos eseményeket, biztosítsák a beteg adherenciáját és megerősítsék a kezelés értékét.
Végeredményben a megfelelő oktatás és a strukturális és funkcionális vizsgálatokkal történő éber nyomon követés segít a látásvesztés minimalizálásában.
Dr. Dorkowski az SCO-nál az idősotthonok/segített életvitel program klinikai koordinátora.
Dr. Williamson a Memphis VA Medical Center rezidensfelügyelője.
Dr. Rixon a Memphis VA kezelőorvosa és az Optometriai Glaukóma Társaság tagja.
Dr. Onofrey a The Ocular Therapeutics Handbook szerzője.
1. Zimmerman TJ, William P. BogerIII. A béta-adrenerg blokkoló szerek és a glaukóma kezelése. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A glaukóma farmakológiájának története. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Muszkarin szerek közvetlen hatásai az emberi szem kiáramlási útvonalaira. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Az adrenerg gyógyszerek hatásmechanizmusa glaukómában. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalil epinefrin: új pro-drog a glaukóma kezelésében. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Kísérleti vizsgálatok a timolol hatásmechanizmusáról. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. A timolol szemnyomáscsökkentő mechanizmusa: A normál szemben. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Béta adrenerg receptorok a pigmentált ciliaris folyamatokban. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. A béta-adrenerg receptorok eloszlása és tulajdonságai az emberi írisz-ciliaris testben. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. A betaxolol vs timolol kettős maszkolású összehasonlítása a nyitott zugú glaukóma kezelésében. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Szemészeti béta-blokkolók a timolol óta. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. A timolol értékelése krónikus nyitott zugú glaukómában: Naponta egyszer vs. naponta kétszer. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. A timolol, az adrenalin és az acetazolamid hatása a vízeláramlásra alvás közben. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. A cirkadián intraokuláris nyomás változása béta-blokkolókkal. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. A szisztémás béta-blokkoló kezelés hatása a helyi brimonidin és timolol hatékonyságára és biztonságosságára. Brimonidin 1. és 2. vizsgálati csoportja. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukóma és szisztémás betegségek. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. A lokális karbonátanhidráz-gátlók farmakológiai és szemhipotenzív tulajdonságai. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Helyi gyógyszerbevitel a szembe: dorzolamid. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamid szemészeti szuszpenzió: farmakológiai áttekintés és alkalmazása a nyitott zugú glaukóma és az okuláris hipertónia kezelésében. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. A latanoprost és a dorzolamid additív szemnyomáscsökkentő hatásának összehasonlítása timololhoz adva nyílt zugú glaukómás vagy okuláris hipertóniás betegeknél: randomizált, nyílt, multicentrikus vizsgálat Görögországban. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. A brimonidin allergia előfordulása korábban apraclonidinre allergiás betegeknél. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. A brimonidin hatékonysága és biztonságossága kiegészítő terápiaként emelkedett intraokuláris nyomású betegeknél egy nagy, nyílt közösségi vizsgálatban. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidin-purit 0,1% versus brimonidin-purit 0,15% naponta kétszer glaukómában vagy okuláris hipertóniában: 12 hónapos randomizált vizsgálat. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidin indukálta elülső uveitis. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Frissítés a helyileg alkalmazott prosztaglandinok hatásmechanizmusáról az intraokuláris nyomás csökkentésére. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. A latanoprostene bunod 0,024% hatékonysága a timolol 0,5%-kal összehasonlítva az intraokuláris nyomás csökkentésében 24 órán keresztül. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprosten bunod 0,024%-os szemészeti oldat IOP-csökkentésre glaukómában és okuláris hipertóniában. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. A latanoprostene bunod 0,024% és a timolol-maleát 0,5% összehasonlítása nyitott zugú glaukómában vagy okuláris hipertóniában: A LUNAR tanulmány. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. A trabecularis hálómunka: A forma és a funkció alapvető áttekintése. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-283838-02-0017. Hozzáférés 2018. június 29.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. A ROCK-gátló netarsudil felfedezése a nyitott zugú glaukóma kezelésére. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Két 3. fázisú klinikai vizsgálat a netarsudil és a timolol biztonságosságának és hatékonyságának összehasonlítása emelkedett szemnyomású betegeknél: Rho kinase elevated iop treatment trial 1 és 2 (ROCKET-1 és ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. A netarsudil, egy új szemészeti vérnyomáscsökkentő szer felfedezése és preklinikai fejlesztése a glaukóma kezelésére. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Egy rock/net gátló topikális adagolása elősegíti a retinális ganglionsejtek túlélését és az axonok regenerációját látóideg-sérülést követően. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Adjuváns terápiás minták glaukómás betegeknél prosztaglandin analógok alkalmazásával. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Fix kombinációk. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Korrelálnak-e az adherencia arányok és a glaukómás látótérprogresszió? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Gyógyszertári igénylési adatok felhasználása a glaukómás gyógyszerek adherenciájának vizsgálatára: a Glaucoma Adherence and Persistency Study (GAPS) módszertana és eredményei. Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Az intraokuláris nyomást csökkentő gyógyszerek hatékonyságának meghatározása kimosással. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Kilátás a glaukómára – Tisztán látunk? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence: Egy keresztmetszeti felmérés. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Cseppbeillesztés és glaukóma. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automatizált távközlési alapú emlékeztetők és a napi egyszeri glaukóma gyógyszeradagoláshoz való ragaszkodás: Az automatizált adagolási emlékeztető tanulmány. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: A betegek és gondozóik érdeklődése egy okostelefon- és tabletalapú glaukóma-alkalmazás iránt. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. A glaukóma gyógyszeres terápiájához való ragaszkodással kapcsolatos jellemzők és annak hatása a glaukóma kimenetelére: Egy bizonyítékokon alapuló áttekintés és az adherencia javításának lehetséges stratégiái. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. A célzott intraokuláris nyomás új perspektívái. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Az intraokuláris nyomás személyre szabása: Cél intraokuláris nyomás a 24 órás intraokuláris nyomás monitorozásának környezetében. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Célnyomás a glaukóma terápiájában. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. A nyílt zugú glaukómás beteg ellátása. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Korai agresszív szemnyomáscsökkentés, célszemnyomás és a glaukóma ellátásának új koncepciója. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. A napszakos intraokuláris nyomásminták rövid távon nem ismételhetők egészséges egyéneknél. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. A diurnalis intraokuláris nyomásminták hosszú távú reprodukálhatósága glaukómás betegeknél. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Az intraokuláris nyomás napról-napra történő változékonysága glaukómában és okuláris hipertóniában. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Az intraokuláris nyomás monitorozásának klinikai haszna a szokásos rendelési időn kívül glaukómás betegeknél. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: A randomizált vizsgálat megállapítja, hogy a helyi szemészeti hipotenzív gyógyszeres kezelés késlelteti vagy megelőzi a primer nyílt zugú glaukóma kialakulását. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Intraocular Pressure Reduction of Intraocular Pressure and Glaucoma Progression: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Az előrehaladott glaukóma intervenciós tanulmány (AGIS): Az intraokuláris nyomás kontrollja és a látótérromlás közötti kapcsolat. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study. A kezelés és egyéb kiindulási tényezők hatása. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost a glaukóma kezelésében. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. A generikus latanoprost bevezetésének hatása a glaukóma gyógyszeres adherenciájára. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A latanoprostene bunod és a latanoprost 0,005% randomizált, kontrollált összehasonlítása az okuláris hipertónia és a nyílt zugú glaukóma kezelésében: A VOYAGER tanulmány. Br J Ophthalmol. 2015;99(6):738-45.