Tanulási célok
- A gázok jellemzőinek leírása.
Az anyag három közös fázisa (vagy állapota) a gázok, a folyadékok és a szilárd anyagok. A három közül a gázok rendelkeznek a legkisebb sűrűséggel, nagymértékben összenyomhatók, és teljesen kitöltenek minden edényt, amelybe kerülnek. A gázok azért viselkednek így, mert a molekulák közötti erők viszonylag gyengék, így molekuláik a többi jelenlévő molekulától függetlenül folyamatosan mozognak. A szilárd anyagok ezzel szemben viszonylag sűrűek, merevek és összenyomhatatlanok, mivel a molekulák közötti erők olyan erősek, hogy a molekulák lényegében a helyükön vannak rögzítve. A folyadékok a szilárd anyagokhoz hasonlóan viszonylag sűrűek és összenyomhatatlanok, de a gázokhoz hasonlóan könnyen áramlanak, hogy alkalmazkodjanak a tartályuk alakjához. Ebből arra következtethetünk, hogy a folyadékok molekulaközi erőinek összege a gázok és a szilárd testek erői között van. A 10.1.1. ábra összehasonlítja a három halmazállapotot, és szemlélteti a molekuláris szintű különbségeket.
10.1.1. ábra Egy kétatomos anyag (O2) szilárd, folyékony és gáz halmazállapotban
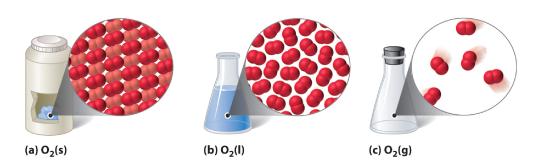
(a) A szilárd O2 térfogata és alakja kötött, és a molekulák szorosan egymáshoz vannak csomagolva. (b) A folyékony O2 megfelel edénye alakjának, de térfogata állandó; viszonylag sűrűn tömörített molekulákat tartalmaz. (c) A gáznemű O2 teljesen kitölti a tartályát – függetlenül a tartály méretétől vagy alakjától -, és egymástól távol eső molekulákból áll.
Az adott anyag állapota erősen függ a körülményektől. Például a H2O általában mindhárom állapotban megtalálható: szilárd jég, folyékony víz és vízgőz (a gáz halmazállapota). A legtöbb körülmények között a vízzel az élethez nélkülözhetetlen folyadékként találkozunk; iszunk belőle, főzünk vele, és fürödünk benne. Ha a hőmérséklet elég hideg ahhoz, hogy a folyadék jéggé alakuljon, akkor síelhetünk vagy korcsolyázhatunk rajta, hógolyót vagy hókúpot készíthetünk belőle, és még lakásokat is építhetünk belőle. VízgőzA gáz és a gőz közötti különbségtétel finom: a gőz kifejezés egy olyan anyag gáznemű formájára utal, amely normál körülmények között (25 °C, 1,0 atm) folyadék vagy szilárd anyag. A nitrogént (N2) és az oxigént (O2) tehát gáznak nevezzük, a légkörben lévő gáznemű vizet viszont vízgőznek. a belélegzett levegő egyik összetevője, és akkor keletkezik, amikor az ételek főzéséhez, kávé vagy tea készítéséhez vizet melegítünk. A 100 °C-nál magasabb hőmérsékleten keletkező vízgőzt gőznek nevezzük. A gőzt nagy gépek meghajtására használják, beleértve a villamosenergiát termelő turbinákat is. A víz három állapotának tulajdonságait a 10.1.1. táblázat foglalja össze
Az atomok, ionok és molekulák geometriai szerkezete, valamint fizikai és kémiai tulajdonságai általában nem függnek fizikai állapotuktól; a jég, a folyékony víz és a gőz egyes vízmolekulái például mind azonosak. Ezzel szemben egy anyag makroszkopikus tulajdonságai erősen függnek fizikai állapotától, amelyet a molekulák közötti erők és az olyan körülmények, mint a hőmérséklet és a nyomás határoznak meg.
A 10.1.2. ábra a periódusos rendszerben azoknak az elemeknek a helyét mutatja, amelyek általában gáznemű, folyékony és szilárd állapotban fordulnak elő. A hidrogén kivételével a természetben gázként előforduló elemek a periódusos rendszer jobb oldalán találhatók. Ezek közül az összes nemesgáz (18. csoport) egyatomos gáz, míg a többi gáznemű elem kétatomos molekula (H2, N2, O2, F2 és Cl2). Az oxigén egy második allotropot is alkothat, a rendkívül reaktív háromatomos ózonmolekulát (O3), amely szintén gáz. Ezzel szemben a bróm (mint Br2) és a higany (Hg) normál körülmények között (25°C és 1,0 atm, általában “szobahőmérséklet és -nyomás”) folyadékok. A gallium (Ga), amely csak 29,76°C-on olvad, egyszerűen folyadékká alakítható, ha egy edényt tartunk a kezünkben, vagy ha egy forró nyári napon egy nem légkondicionált helyiségben tartjuk. A többi elem normál körülmények között mind szilárd halmazállapotú.
10.1.2. ábra A természetben 25 °C-on és 1 atm-on gázként, folyadékként és szilárdként előforduló elemek
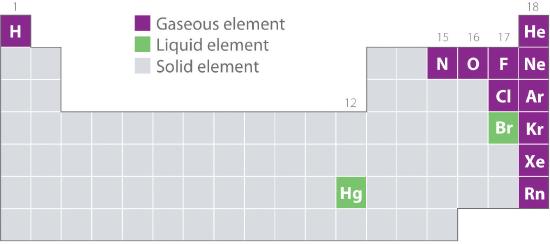
A nemesgázok és a higany egyatomos fajként fordulnak elő, míg az összes többi gáz és a bróm kétatomos molekula.
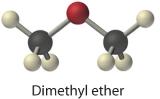
Az eddig megismert elemek és vegyületek közül sokan jellemzően gázként fordulnak elő; a leggyakoribbak közül néhányat a 10.1.2. táblázat tartalmaz. A gáznemű anyagok közé tartozik számos bináris hidrid, például a hidrogénhalogenidek (HX); a kalcogének hidridjei; a 15. csoportba tartozó N, P és As elemek hidridjei; a 14. csoportba tartozó C, Si és Ge elemek hidridjei; és a diborán (B2H6). Ezenkívül a nemfémek számos egyszerű kovalens oxidja gáz, mint például a CO, CO2, NO, NO2, SO2, SO3 és ClO2. Sok kis molekulatömegű szerves vegyület is gáz, beleértve az összes négy vagy kevesebb szénatomos szénhidrogént és olyan egyszerű molekulákat, mint a dimetil-éter , a metil-klorid (CH3Cl), a formaldehid (CH2O) és az acetaldehid (CH3CHO). Végül a hűtőközegek, mint például a fluorozott-klórozott szénhidrogének (CFC-k) és a hidroklórfluorozott szénhidrogének (HCFC-k) olyan gázok, amelyek sűrítéssel könnyen cseppfolyósíthatók, a folyadékok pedig a folyadékok nyomásának csökkentésével gázokká alakíthatók. A hűtőszekrény belsejében lévő csövekben a folyadékból gázzá történő fázisátalakulás hűti, míg a hűtőszekrény alján vagy hátulján lévő tekercsekben történő kompresszió felmelegíti a helyiséget. Az ammónia és a SO2 más összenyomható gázok, amelyeket hűtőközegként használtak, de mérgező jellegük miatt nem használhatók házakban. Az ammóniát még mindig használják hűtőközegként a nagy kereskedelmi létesítményekben hatékonysága és alacsony költsége miatt.
A korábban említett összes gáznemű anyag (az egyatomos nemesgázok kivételével) kovalens vagy poláris kovalens kötéseket tartalmaz, és nem poláris vagy poláris molekulák. Ezzel szemben az ionos vegyületek, mint például a NaBr (forráspont = 1390°C) vagy a LiF (forráspont = 1673°C) erős elektrosztatikus vonzása miatt szobahőmérsékleten és nyomáson nem léteznek gázként. Ezenkívül bármely vegyületcsalád legkönnyebb tagjai valószínűleg gázok, és a poláris vegyületek forráspontja általában magasabb, mint a hasonló molekulatömegű nem poláris vegyületeké. Ezért egy adott vegyületsorozatban a legkönnyebb és legkevésbé poláris tagok azok, amelyek a legnagyobb valószínűséggel gázok. Viszonylag kevés kivételtől eltekintve azonban a 2. periódusból vagy alatta lévő körülbelül ötnél több atomot tartalmazó vegyületek túl nehezek ahhoz, hogy normál körülmények között gázként létezzenek.
Jegyezzük meg a mintát
A gáznemű anyagok gyakran tartalmaznak kovalens vagy poláris kovalens kötéseket, nem poláris vagy enyhén poláris molekulaként léteznek, viszonylag kis molekulatömegűek, és öt vagy kevesebb atomot tartalmaznak az 1. vagy 2. periódusból.
Míg a gázok felhasználási területei széles skálán mozognak, a gáznemű anyagok különösen zord felhasználásáról úgy tartják, hogy a perzsák a Kr. u. III. században a kelet-szíriai Dura római városán alkalmazták. A perzsák alagutat ástak a városfal alatt, hogy behatoljanak a városba és elfoglalják azt. A régészeti bizonyítékok arra utalnak, hogy amikor a rómaiak ellenalagutakkal válaszoltak az ostrom megállítására, a perzsák bitument és kénkristályokat gyújtottak meg, hogy sűrű, mérgező gázt állítsanak elő. Valószínű, hogy fújtatók vagy kémények terjesztették a mérgező gőzöket. A városfal tövében, egy kevesebb mint 2 m magas és 11 m hosszú alagút bejáratánál mintegy 20 római katona maradványait fedezték fel. Mivel nagyon valószínűtlen, hogy a perzsák ennyi rómait lemészárolhattak volna egy ilyen szűk hely bejáratánál, a régészek azt feltételezik, hogy az ókori perzsák vegyi hadviselést alkalmaztak a város sikeres meghódításához.
Példa 10.1.1
Mely vegyületekről mondanád, hogy szobahőmérsékleten és nyomáson gázok?
- ciklohexén
- lítium-karbonát
- ciklobután
- vanádium(III)-oxid
- benzoesav (C6H5CO2H)
Adva: Vegyületek
Kérdés: fizikai állapot
Stratégia:
A Döntsd el, hogy az egyes vegyületek ionos vagy kovalens vegyületek-e. Az ionos vegyület szobahőmérsékleten és nyomáson valószínűleg szilárd anyag, míg a kovalens vegyület lehet szilárd, folyékony vagy gáz.
B A kovalens vegyületek közül azok, amelyek viszonylag nem polárisak és kis molekulatömegűek, szobahőmérsékleten és nyomáson valószínűleg gázok.
Solution:
A A lítium-karbonát a Li2CO3, amely Li+ és CO32- ionokat tartalmaz, a vanádium(III)-oxid pedig a V2O3, amely V3+ és O2- ionokat tartalmaz. Mindkettő elsősorban ionos vegyület, amelyek várhatóan szilárd halmazállapotúak. A fennmaradó három vegyület mind kovalens.
B A benzoesavnak több mint négy szénatomja van, és poláros, ezért valószínűleg nem gáz. Mind a ciklohexén, mind a ciklobután lényegében nem poláris molekulák, de a ciklobután (C4H8) molekulatömege lényegesen kisebb, mint a ciklohexéné (C6H10), amelynek szintén több mint négy szénatomja van. Ezért azt jósoljuk, hogy a ciklobután szobahőmérsékleten és nyomáson valószínűleg gáz, míg a ciklohexén folyadék. Valójában, mivel a ciklohexén forráspontja mindössze 12 °C, szemben a ciklohexén 83 °C-jával, a ciklo-bután szobahőmérsékleten és nyomáson valóban gáz.
GYakorlat
Mely vegyületekről mondanád meg, hogy szobahőmérsékleten és nyomáson gázok?
- n-butanol
- ammónium-fluorid (NH4F)
- ClF
-
etilén-oxid
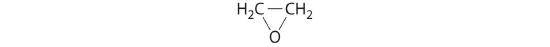
- HClO4
Válasz:
Válasz: A válaszok a következők:
Összefoglaló
Az ömlesztett anyagok háromféle állapotban létezhetnek: gáz, folyadék és szilárd. A három közül a gázok sűrűsége a legkisebb, erősen összenyomhatók, és teljesen kitöltik tartályaikat. A szobahőmérsékleten és nyomáson gázként létező elemek a periódusos rendszer jobb oldalán csoportosulnak; ezek vagy egyatomos gázok (a nemesgázok), vagy kétatomos molekulák (egyes halogének, N2, O2) formájában fordulnak elő. Sok olyan szervetlen és szerves vegyület, amelynek négy vagy kevesebb nem vízatomja van, szintén gázok szobahőmérsékleten és nyomáson. Minden gáznemű anyagot az alkotó molekulák vagy atomok közötti gyenge kölcsönhatások jellemeznek.
Főbb tanulságok
- A gáznemű anyagok molekulái gyakran kovalens vagy poláris kovalens kötéseket tartalmaznak, nem vagy enyhén poláris molekulák, és viszonylag kis molekulatömegűek.
Fogalmi problémák
-
Magyarázza az anyag mikroszkopikus és makroszkopikus tulajdonságai közötti különbségeket. Egy vegyület forráspontja mikroszkopikus vagy makroszkopikus tulajdonság-e? molekulatömeg? Miért?
-
Mondja meg, hogy az olvadáspont, a dipólusmomentum és az elektromos vezetőképesség az anyag makroszkopikus vagy mikroszkopikus tulajdonságai, és indokolja meg érvelését.
-
Hogyan befolyásolják az anyag mikroszkopikus tulajdonságai a makroszkopikus tulajdonságokat? Össze tudja kapcsolni a molekulatömeget a forrásponttal? Miért vagy miért nem? Összefüggésbe hozható-e a polaritás a forrásponttal?
-
Egy olyan anyag esetében, amelynek gáz-, folyadék- és szilárd fázisai vannak, rendezze ezeket a fázisokat a növekvő
- sűrűség sorrendjébe.
- a molekulák közötti kölcsönhatások erőssége.
- összenyomhatóság.
- molekuláris mozgás.
- rend a molekulák vagy atomok elrendeződésében.
-
Magyarázza meg, mi a baj ezzel az állítással: “Az anyag állapota nagymértékben meghatározza az anyag molekuláris tulajdonságait.”
-
Írd le azokat a legfontosabb tényezőket, amelyek egy adott vegyület állapotát meghatározzák. Milyen külső körülmények befolyásolják, hogy egy anyag a három halmazállapot valamelyikében létezik-e?
-
A periódusos rendszer mely elemei léteznek gázként szobahőmérsékleten és nyomáson? Ezek közül melyek a kétatomos és melyek az egyatomos molekulák? Mely elemek szobahőmérsékleten és nyomáson folyadékok? A periódusos rendszer melyik része tartalmazza azokat az elemeket, amelyek bináris hidridjei szobahőmérsékleten valószínűleg gázok?
-
Az alábbi megfigyelés helyes? “Szinte minden nem fém bináris hidrid szobahőmérsékleten gáz, de a fémhidridek mind szilárd halmazállapotúak.” Fejtse ki érvelését.
-
Helyes-e a következő megfigyelés? “A kalcogének összes hidridje szobahőmérsékleten és nyomáson gáz, kivéve az oxigén bináris hidridjét, amely folyadék.” Magyarázza meg az érvelését! Azt várnád, hogy az 1-klórpropán gáz legyen? jodopropán? Miért?
-
Magyarázza meg, miért nem gázok az ionos vegyületek normál körülmények között.
Válaszok
-
-
-
-
-
-
-
Az anyag molekuláris tulajdonságai szabályozzák anyagállapotát adott körülmények között, nem pedig fordítva. Az erős molekulaközi erők jelenléte a sűrített halmazállapotnak (folyékony vagy szilárd), míg a nagyon gyenge molekulaközi kölcsönhatás a gáz halmazállapotnak kedvez. Ezenkívül a molekulák alakja diktálja, hogy egy kondenzált fázis folyékony vagy szilárd halmazállapotú legyen.
-
-
A gázként létező elemek főként a periódusos rendszer jobb felső sarkában és jobb oldalán találhatók. A következő elemek léteznek gázként: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe és Rn. Így a halogének fele, az összes nemesgáz, valamint a legkönnyebb kalcogének és piknogének gázok. Ezek közül a nemesgázok kivételével mindegyik kétatomos molekulaként létezik. Csak két elem létezik folyadékként 20°C-25°C-os normál szobahőmérsékleten: a higany és a bróm. A periódusos rendszer jobb felső része tartalmazza a legtöbb olyan elemet is, amelyek bináris hidridjei gázok. Ezen kívül a 14-16. csoportba tartozó elemek bináris hidridjei is gázok.
-
-
-