A sejtek sok vizet tartalmaznak. A víz egyik szerepe a különböző anyagok oldása. A sejtekben például sokféle ionos vegyület (só) található. Az ionok a sejtpotenciálok fenntartására szolgálnak, és fontosak a sejtek jelátvitelében és az izomösszehúzódásban.
Hogyan lehet megmondani, hogy egy vegyület ionos vagy kovalens?
Ezekre a kérdésre nincs egyszerű válasz. Sok kötés valahol a kettő között van. Egy poláros kovalens kötésben két atom között egy elektronpár oszlik meg a nyolcadok betöltése érdekében, de az elektronok közelebb helyezkednek el a kötés egyik végéhez, mint a másikhoz. A kötés egyik vége felé több negatív töltés van, és ez több pozitív töltést hagy a kötés másik végén.
A különböző atomok elektronegativitási értékeinek megnézése segít eldönteni, hogy egy kötésben az elektronpár mennyire egyenletesen oszlik meg. Az elektronegativitás a periódusos rendszer jobb felső sarka felé haladva növekszik a magtöltés és az árnyékolási tényezők kombinációja miatt. A periódusos rendszer jobb felső sarkában lévő atomok nagyobb vonzást gyakorolnak a megosztott kötéselektronokra, míg a bal alsó sarokban lévő atomok gyengébb vonzást gyakorolnak a kovalens kötések elektronjaira.
A szén-oxigén kötésben több elektron vonzódik az oxigénhez, mivel az a periódusos rendszerben a szénnel szemben jobbra van a sorban. Az olyan vegyületek, mint a , dimetil-éter, CH3OCH3, kissé polárisak. A formaldehid, CH2O, még polárisabb. A pi-kötések elektronjait a kvantummechanikai okok miatt lazábban tartják, mint a szigma-kötések elektronjait. Ez lehetővé teszi, hogy az oxigén könnyebben magához húzza az elektronokat egy többszörös kötésben, mint egy szigma kötésben.

Nem minden polaritást könnyű meghatározni a periódusos rendszerre pillantva. Egy bór-hidrogén kötésben a dipólus irányát nehéz lenne megjósolni az elektronegativitási értékek megnézése nélkül, mivel a bór tovább jobbra, a hidrogén viszont feljebb helyezkedik el. Mint kiderült, a hidrogén enyhén negatív.
Egy kötés akkor ionos, ha az atomok közötti elektronegativitáskülönbség elég nagy ahhoz, hogy az egyik atom teljesen el tudjon vonni egy elektront a másiktól. Ez a helyzet gyakori az olyan vegyületekben, amelyek a periódusos rendszer bal szélén lévő elemeket (nátrium, kálium, kalcium stb.) a periódusos rendszer jobb szélső, felső, szélsőséges sarkában lévő elemekkel (leggyakrabban oxigén, fluor, klór) kombinálják. A nátrium-klorid ionos vegyület.
Sok kötés lehet kovalens az egyik helyzetben, és ionos a másikban. Például a hidrogén-klorid, HCl, olyan gáz, amelyben a hidrogén és a klór kovalens kötésben van, de ha a HCl-t vízbe buborékosítjuk, akkor teljesen ionizálódik, és a sósavoldat H+ és Cl- oldatát adja. A töltés még a gáz halmazállapotú HCl-ben sem egyenletesen oszlik el. A klór részben negatív, a hidrogén pedig részben pozitív.
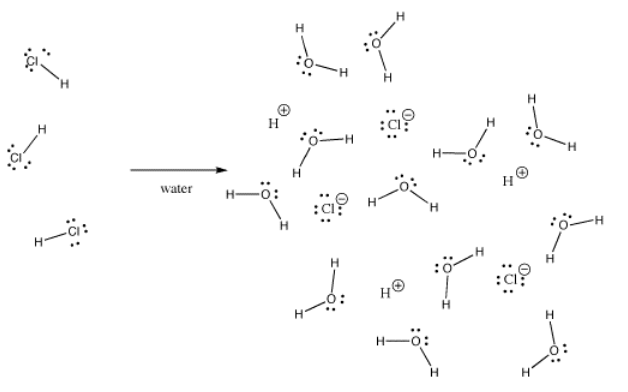
A kálium-hidroxid, a KOH egy kovalens (O-H) és egy ionos (K-O) kötést tartalmaz. A hidrogén azért trükkös, mert a periódusos rendszer tetején, valamint a bal oldalán található. Éppen eléggé elektro-pozitív ahhoz, hogy bizonyos esetekben ionos kötéseket képezzen. Más esetekben éppen elég elektronegatív ahhoz, hogy kovalens kötéseket képezzen.
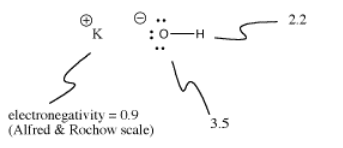
A KOH-ban a K-O kötés ionos, mert a kálium és az oxigén elektronegativitása közötti különbség nagy. Az oxigén és a hidrogén közötti elektronegativitáskülönbség nem kicsi. Az O-H kötés néha ionizálódhat, de nem minden esetben.
Az ionizáció néha attól függ, hogy mi más történik a molekulán belül. Mivel a kálium-hidroxidban a K-O kötés ionos, az O-H kötés nem valószínű, hogy ionizálódik. Az oxigénen már van negatív töltés. A töltésszétválasztás energiába kerül, ezért nehezebb egy második negatív töltést is az oxigénre helyezni az O-H kötés ionizálásával. Gyakran az első ionizáció a molekulákban sokkal könnyebb, mint a második ionizáció.
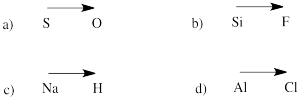
gyakorlat \(\PageIndex{1}\)
Jósold meg a polaritás irányát a következő párokban lévő atomok közötti kötésben:
a) kén-oxigén b) szilícium-fluor
c) hidrogén-nátrium d) klór-alumínium
Válasz
Mert olyan gyakori, hogy a periódusos rendszer bal szélső sorában lévő elem kationként van jelen, és hogy a szélsőjobboldali elemek negatív töltést hordoznak, gyakran feltételezhetjük, hogy egy olyan vegyület, amely mindegyikből tartalmaz egy-egy példát, legalább egy ionos kötéssel rendelkezik.
gyakorlat \(\PageIndex{2}\)
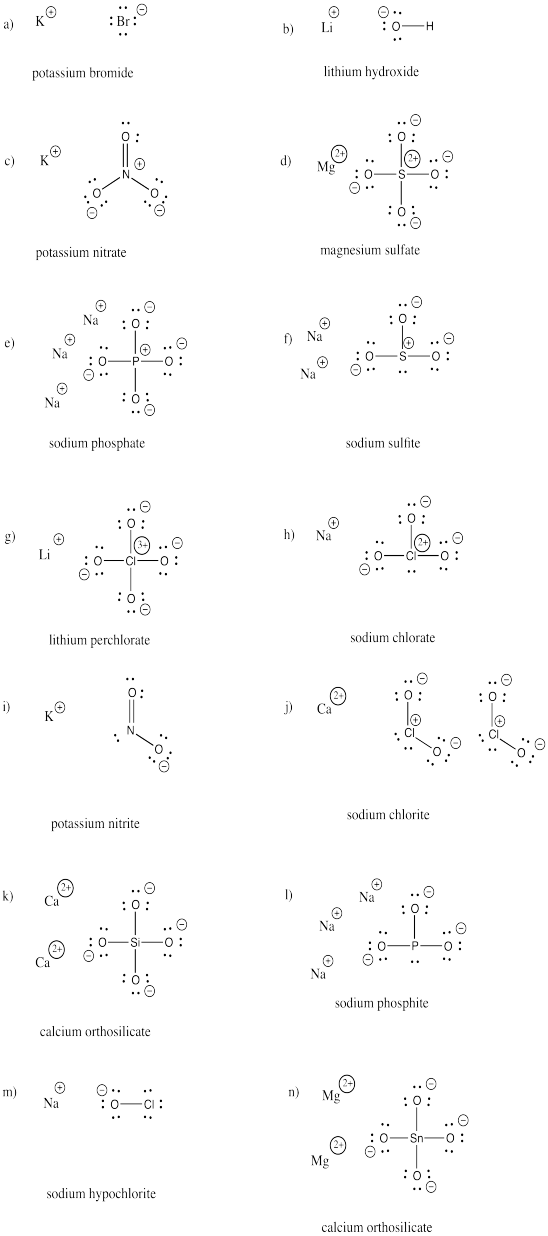
Rajzolja meg a következő vegyületek szerkezetét. Mindegyik tartalmaz legalább egy aniont és egy kationt.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Válasz
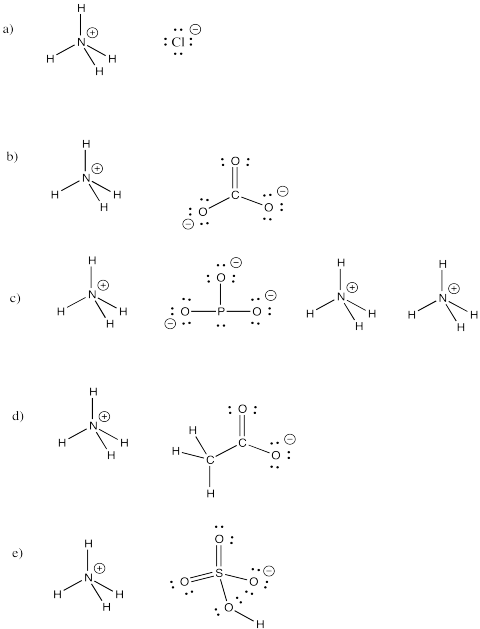
gyakorlat \(\PageIndex{3}\)
Ammóniumion, NH4+, egy gyakori molekuláris ion. Rajzolja meg az alábbi vegyületek szerkezetét, amelyek tartalmazzák ezt az iont.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Válasz
GYakorlat \(\PageIndex{4}\)
Sok anionnak van olyan neve, amely elárul valamit a szerkezetéről.
| prefix- vagy -suffix |
közönséges jelentés |
példa név | példa képlet |
| -.ide | atom anion | klorid | Cl – |
| -ate | atom oxianionként van jelen; általában gyakori forma | klorát | ClO3- |
| -it | atom van jelen oxianionként, de kevesebb oxigénnel (vagy alacsonyabb “oxidációs állapottal”), mint egy másik gyakori forma | klorit | ClO2- |
| per- | atom van jelen oxianionként, de még több oxigénnel, mint az “-ate” forma | perklorát | ClO4- |
| hypo- | atom van jelen oxianionként, de még kevesebb oxigénnel, mint az “-it” formában | hipoklorit | ClO- |
A táblázatot segítségül hívva tegyünk javaslatot a következő anionok nevére:
a) Br- b) O2- c) F- d) CO32- (gyakori oxianion) e) NO3- (gyakori oxianion) f) NO2-
g) S2- h) SO42- (gyakori oxanin) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (gyakori oxianion) o) PO33- p) I- q) IO3- (gyakori oxianion) r) IO4-
Válasz a)
bromid
Válasz b)
oxid
Válasz c)
fluorid
Válasz d)
karbonát
Válasz e)
nitrát
Válasz f)
nitrit
Válasz g)
szulfid
Válasz h)
szulfát
Válasz i)
szulfit
Válasz j)
perszulfát
Válasz k)
karbid
Válasz l)
nitrid
Válasz m)
arzenid
Válasz n)
foszfát
Válasz o)
foszfát
.
foszfit
Válasz p)
jodid
Válasz q)
jodát
Válasz r)
perjodát
Attribution
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)