Atomi emissziós spektrumok
Az atomban az elektronok igyekeznek úgy elhelyezkedni, hogy az atom energiája a lehető legkisebb legyen. Az atom alapállapota az atom legalacsonyabb energiájú állapota. Amikor ezeknek az atomoknak energiát adunk, az elektronok elnyelik az energiát, és magasabb energiaszintre kerülnek. Az atomok elektronjainak ezek az energiaszintjei kvantáltak, ami ismét azt jelenti, hogy az elektronnak nem folyamatosan, hanem diszkrét lépésekben kell egyik energiaszintről a másikra lépnie. Egy atom gerjesztett állapota olyan állapot, amelyben a potenciális energiája magasabb, mint az alapállapoté. A gerjesztett állapotban lévő atom nem stabil. Amikor visszatér az alapállapotba, a korábban nyert energiát elektromágneses sugárzás formájában szabadítja fel.
Hogyan nyernek tehát az atomok energiát? Az egyik módszer, ha alacsony nyomáson elektromos áramot vezetünk át egy gáz zárt mintáján. Mivel az elektronok energiaszintjei minden elem esetében egyediek, minden gázkisülési cső a gáz azonosságától függően jellegzetes színben fog világítani (lásd alább).


A “Neon” jelek a gázkisülési csövek ismert példái. Azonban csak azok a táblák, amelyek az ábrán látható vörös-narancs színben világítanak, valóban neonnal vannak töltve. A más színű táblák különböző gázokat vagy gázkeverékeket tartalmaznak.
A tudósok a hidrogéngáz által létrehozott gázkisülés jellegzetes rózsaszínű színét tanulmányozták. Amikor ennek a fénynek egy keskeny sugarát egy prizmán keresztül nézték, a fényt négy, nagyon sajátos hullámhosszúságú (és frekvenciájú, mivel \(\lambda\) és \(\nu\) fordítottan arányos) vonalra bontották. Az atomi emissziós spektrum a vonalak mintázata, amely akkor keletkezik, amikor a fény egy prizmán áthaladva a benne lévő fény különböző frekvenciáira válik szét. Az alábbi ábra a hidrogén atomi emissziós spektrumát mutatja.
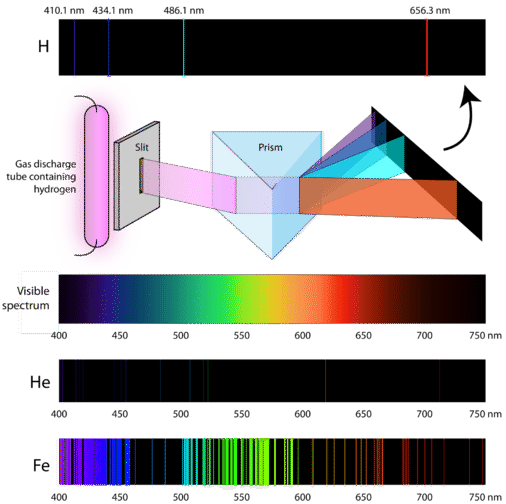
A klasszikus elmélet nem tudta megmagyarázni az atomemissziós spektrumok, más néven vonalemissziós spektrumok létezését. A klasszikus fizika szerint egy alapállapotú atom bármilyen mennyiségű energiát képes lenne elnyelni, nem pedig csak diszkrét mennyiségű energiát. Hasonlóképpen, amikor az atomok visszaalakulnak egy alacsonyabb energiaállapotba, tetszőleges mennyiségű energia szabadulhat fel. Ez az úgynevezett folytonos spektrumot eredményezné, ahol minden hullámhossz és frekvencia jelen van. A prizmán keresztül nézett fehér fény és a szivárvány a folytonos spektrum példái. Az atomok emissziós spektrumai jobban bizonyították a fény kvantált jellegét, és az atom új, kvantumelméleten alapuló modelljéhez vezettek.