Az atommag létezésének megállapítása után most a Rutherford-kísérletből kiindulva megvizsgálhatjuk az atommag méretére vonatkozó kísérleti bizonyítékokat.
Lekció összefoglalása
- Egyeztetés és kidolgozott példa: Az atommag mérete (15 perc)
- Megbeszélés: (10 perc)
- Tanulói kérdések: (30 perc)
- Egyeztetés: Erők és a legközelebbi megközelítés (30 perc)
- Egyeztetés: (5 perc)
- Discussion: Atomszám és az atommag töltése (5 perc)
- Discussion: (30 perc)
- Diszkusszió: Az atommag méretének felső határa (30 perc)
- Diszkusszió: (5 perc)
Megbeszélés és kidolgozott példa: Az atommag mérete
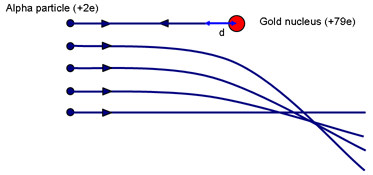
A Rutherford kísérletére gondolva képet kaphatunk az atommag lehetséges méretéről. Kérdezzétek meg! Melyik ütközési paraméter eredményezi azt, hogy egy részecske kerül a legközelebb az atommaghoz? (Frontális ütközés, p = 0.)
Az energia megmaradásának elve alapján kiszámítható a legközelebbi megközelítés távolsága, mint az atommag méretének mértékegysége. A következő számítás megértése attól függ, hogy a tanulók foglalkoztak-e az elektromos potenciállal és a mezőkkel. Alternatívaként jó ismétlésként is szolgálhat.
Epizód 522-1: Alfa-részecskék szóródása – a legközelebbi megközelítés távolsága (Word, 29 KB)
Epizód 522-2: A legközelebbi megközelítés távolsága (Word, 107 KB)
Amikor az α egy pillanatra nyugalomba kerül (miután felmászott az elektrosztatikus hegyre, amennyire csak tudott), az atommag taszító erejével szemben munkát végzett. Az α mozgási energiája az atommag körüli mezőben tárolódik. Ha a sebesség nulla, akkor már az összes energiát a mező tárolja.
Ha az α pillanatnyilag megáll, amikor a Ze töltésű atommagtól (középpontjától) d távolságra van, akkor a mezőben lévő energia:
Eα = 14πε0 2e Zed
Ez megegyezik az α részecske kezdeti mozgási energiájával. Rutherford egy α-forrást használt, amelyet Madame Curie adott neki. Az α energiája ~ 7,7 MeV volt.
Az arany esetében Z = 79. Ha megoldjuk, akkor d ~ 3 × 10-14 m. Hasonlítsuk ezt össze az aranyatomok átmérőjével ~ 3 × 10-10 m. Tehát egy atommag legalább 10 000-szer kisebb, mint egy atom. Fontos hangsúlyozni, hogy ez a számítás egy felső határt ad az aranymag méretére; nem mondhatjuk, hogy az alfa-részecske megérinti az atommagot; egy energikusabb α még közelebb juthat.
Egy atom többnyire üres (ezért a legtöbb mint egyenesen átment – bármilyen elektron aligha akadályozná a viszonylag masszív, nagy sebességű α-t).
Diszkusszió: Atom- és atommagméret
Kérd meg a diákokat, hogy javasoljanak egy méretarányos modellt az atommagról. Például: ha egy atommag 1 mm átmérőjű lenne, akkor egy atom 10 000-szer nagyobb vagy 10 m átmérőjű lenne. Válasszon egy megfelelő helyet egy 1 mm-es atommagnak (egy kis golyóscsapágy vagy Blu-tac golyó). Menjünk 5 m-t (öt nagy lépést) az atom széléig, ahol az elektronok vannak. Megjegyzés: A tankönyvi ábrák az atommaggal rendelkező atomról nem méretarányosan vannak megrajzolva.
A pontos képet úgy erősítsük meg, hogy egy tanuló álljon fel atommagként, becsülje meg a kerületét (40 cm?), és kérdezzük meg, hogy egy másik tanulónak hova kellene állnia, hogy az atom szélén legyen. 104 × 40 cm = 4000 m}, tehát ennek az atomnak a sugara 2 km! Ellenőrizd egy helyi térképpel, hogy találsz-e olyan megnevezett helyet, amelyet a tanulók felismernek, és amely 2 km távolságra van.
További megerősítés: egy szilárd testben, ahol az atomok szorosan egymás mellett helyezkednek el, a szomszédos atommagok közötti távolság ~ egy atom mérete, azaz egyenértékű azzal, hogy két tanuló 4 km távolságra áll egymástól!
Ez tehát egészen elképesztő, hogy egyáltalán eltalálták az atommagot. Mindkettő hasonló méretű. Egy atommag által bemutatott keresztmetszeti terület ~sugár2, tehát ~1 × 10-28 m2}.
Kérdés: Hogyan várható, hogy a visszavert minták száma függ a célmagokat tartalmazó fémfólia vastagságától? (Képzeljük el az aranyatomokat rétegekben, a visszaverődés esélye a vastagsággal nő, de az egyre vastagabb fólián befelé vagy visszafelé történő elnyelés végül megakadályozza a visszavert és észlelt szám további növekedését.
Nagy segítség, ha a diákok fel tudják idézni a következő nagyságrendeket:
Az atommag sugara ~ 10 -14m
Az atom sugara ~ 10 -10m
Tanulói kérdések: Erők és a legközelebbi közeledés
Epizód 522-3: Rutherford-szórás: (Word, 82 KB)
Epizód 522-4: Rutherford-szórás: (Word, 83 KB)
Diszkusszió: Atomszám és az atommag töltése
Rutherford az adatai alapján meghatározta az arany célmag töltését. További kísérletek a Cu, Ag és Pt fóliák töltésének meghatározására adták:
| Atomszám | A szórási kísérlet | ||
| Cu | 29 | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e | |
| PT | 78 | 77.4 × e |
Az atommag elektromos töltését tehát az atomszám × e, azaz Z e. Egy kivétellel (hidrogén, H-1) Z mindig kisebb, mint az atomtömegszám. Mi okozza tehát a különbséget? Az atomnak elektromosan semlegesnek kell lennie. Rutherford javasolta a neutront.
Diszkusszió: Az atommag méretének felső határa
Memlékezzünk arra, hogy Rutherford elemzése felső határt ad az atommag méretére (d ~ 1 α részecskenergia). A mért méret a használt α-részecske energiájától függ. Tehát más megközelítésre van szükségünk az arany atommag méretének meghatározásához. Tudsz jobb részecskét kitalálni az atommag méretének vizsgálatára? (A neutron – mivel töltés nélküli, közelebb kerül.)
Egy másik technika az elektronok mély rugalmatlan szórása. Utaljon vissza, ha már foglalkozott a részecskék hullámtermészetével (de Broglie-hullámok λ = hp), vagy ezt a témát ide is beillesztheti, ha szeretné. Az elektron diffrakciós készülék alapvető hasonlóságot mutat a részecskeszórással. Az elektronokat egy vékony rétegre – jelen esetben grafitra – lövik ki.
Rutherfordnak szerencséje volt, hogy az α részecskék (számára ismeretlen) de Broglie-hullámhossza elég kicsi volt, és a coulombtaszítás megáll, amint túl közel kerül – különben a diffrakciós hatások összezavarták volna az adatokat! (Próbálja ki a számítást, ha már foglalkozott a λ = hp-val.)
Epizód 506-2: Az elektronok diffrakciós mintázatának értelmezése (Word, 30 KB)
Epizód 522-5: Mély inelasztikus szórás (Word, 56 KB)
Epizód 522-6: Az elektronok mérik az atommagok méretét (Word, 42 KB)
Előadás: Rutherford modelljével van egy alapvető probléma. Kérdezd meg az osztályodat! Hogyan lehet egy központi maggal rendelkező atom stabil – miért nem omlik össze? A klasszikus elektrodinamika szerint az elektronoknak keringés közben sugárzást kellene kibocsátaniuk, és spirálisan befelé fordulniuk.
(Jó, ha az osztály egy rejtvénnyel távozik egy következő órára.)