Periodikus trendek
Először az egyes atomokra koncentrálunk, és az elemnek a periódusos rendszerben elfoglalt helyével kapcsolatos trendekre gondolunk. Első modellként az egyszerű szerves vegyületeket, az etánt, a metilamint és az etanolt használjuk, de a fogalmak ugyanúgy alkalmazhatók az összetettebb, azonos funkcionalitású biomolekulákra, például az alanin (alkán), a lizin (amin) és a szerin (alkohol) aminosavak oldalláncaira.
Horizontális periodikus trend a savasságban és bázicitásban:
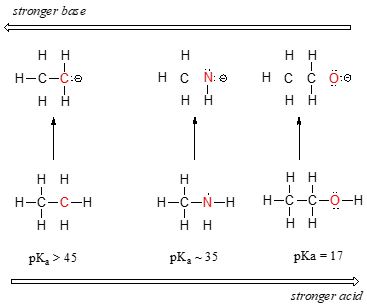
A periódusos rendszer második sorában balról jobbra haladva a széntől a nitrogénen át az oxigénig egyértelmű tendenciát láthatunk a savasságban. E tendencia megértésének kulcsa, ha minden esetben figyelembe vesszük a hipotetikus konjugált bázist: minél stabilabb (gyengébb) a konjugált bázis, annál erősebb a sav. Nézzük meg, hol végződik a negatív töltés az egyes konjugált bázisokban. Az etán konjugált bázisában a negatív töltést egy szénatom viseli, míg a metilamin és az etanol konjugált bázisában a negatív töltés egy nitrogén-, illetve egy oxigénatomon található. Emlékezzünk a 2.4A szakaszból, hogy az elektronegativitás is növekszik, ahogy balról jobbra haladunk a periódusos rendszer egy sorában, ami azt jelenti, hogy a három atom közül az oxigén a legelektronegatívabb, a szén pedig a legkevésbé.
Megjegyzés
Minél elektronegatívabb egy atom, annál jobban képes negatív töltést hordozni. A gyengébb bázisok az elektronegatívabb atomokon hordoznak negatív töltést, az erősebb bázisok a kevésbé elektronegatív atomokon hordoznak negatív töltést.
A három konjugált bázis közül tehát a metoxid-anion a legstabilabb (legkisebb energiájú, legkevésbé bázikus), az etil-karbanion anion pedig a legkevésbé stabil (legnagyobb energiájú, leginkább bázikus). Ezzel szemben az etanol a legerősebb sav, az etán pedig a leggyengébb sav.
A periódusos rendszer egy adott oszlopán belül függőlegesen haladva ismét egyértelmű periódusos tendenciát figyelhetünk meg a savasság tekintetében. Ez a legjobban a halogénsavak és a halogenidek esetében szemléltethető: a bázicitás, akárcsak az elektronegativitás, az oszlopban felfelé haladva növekszik.
A savasság és bázicitás függőleges periodikus trendje:

A haloacidok savassága ezzel szemben az oszlopban lefelé haladva növekszik.
Azért, hogy ennek a trendnek értelmet adjunk, ismét a konjugált bázisok stabilitását vizsgáljuk meg. Mivel a fluor a legelektronegatívabb halogénelem, azt várhatnánk, hogy a fluorid egyben a legkevésbé bázikus halogénion is. Valójában azonban ez a legkevésbé stabil és a legbázikusabb! Kiderült, hogy a periódusos rendszerben függőlegesen haladva az atom mérete az elektronegativitást felülmúlja a bázicitás tekintetében. A jód atomsugara körülbelül kétszerese a fluorénak, így a jodidionban a negatív töltés lényegesen nagyobb térfogatra oszlik el:

Ez a szerves kémia egy alapvető fogalmát szemlélteti:
Az elektrosztatikus töltések, akár pozitívak, akár negatívak, stabilabbak, ha nagyobb területre “oszlanak el”.
A szerves reakcióképesség tanulmányozása során újra és újra látni fogjuk ezt a gondolatot kifejezve, sokféle összefüggésben. Egyelőre csak az atomsugárnak a báziserősségre gyakorolt hatására alkalmazzuk a koncepciót. Mivel a fluorid a legkevésbé stabil (legbázikusabb) a halogénkonjugált bázisok közül, a HF a legkevésbé savas a halogénsavak közül, csak kissé erősebb, mint egy karbonsav. A HI, amelynek \(pK_a\) értéke körülbelül -9, majdnem olyan erős, mint a kénsav.
A biológiai szerves kémia tanulmányozása szempontjából ez a tendencia azt mutatja, hogy a tiolok savasabbak, mint az alkoholok. A cisztein oldalláncán lévő tiolcsoport \(pK_a\) értéke például körülbelül 8,3, míg a szerin oldalláncán lévő alkoholcsoport \(pK_a\) értéke 17-es nagyságrendű.
Emlékszünk még a 6.2. szakaszban bevezetett “hajtóerő” fogalmára? Emlékezzünk vissza, hogy egy reakció hajtóereje általában két tényezőn alapul: a relatív töltésstabilitáson és a relatív teljes kötési energián. Nézzük meg, hogyan alkalmazható ez egy egyszerű sav-bázis reakcióra a sósav és a fluoridion között:
\
Tudjuk, hogy a HCl (\(pK_a\) -7) erősebb sav, mint a HF (\(pK_a\) 3.2), így a reakció egyensúlya a termékoldalon van: a reakció exergonikus, és egy “hajtóerő” a reakcióst a termék felé tolja.
Mivel magyarázható ez a hajtóerő? Vegyük először a töltéstényezőt: ahogy az imént tanultuk, a kloridion (a termékoldalon) stabilabb, mint a fluoridion (a reaktánsoldalon). Ez részben megmagyarázza a reakcióban a reaktánsból a termékbe lépő hajtóerőt: a kevésbé stabil ionból egy stabilabb ionba lépünk át.
Mi a helyzet a teljes kötési energiával, a hajtóerő másik tényezőjével? Ha megnézzük a kötési energiák táblázatát, láthatjuk, hogy a H-F kötés a termékoldalon energikusabb (erősebb), mint a H-Cl kötés a reaktánsoldalon: 570 kJ/mol vs 432 kJ/mol, illetve). Ez is hozzájárul a hajtóerőhöz: egy gyengébb (kevésbé stabil) kötésből egy erősebb (stabilabb) kötésbe lépünk át.