
A bázis minden olyan molekula, amely protonokat vesz fel, míg a sav minden olyan molekula, amely protonokat ad le. Emiatt az ammóniát bázikusnak tekintjük, mert a nitrogénatomja olyan elektronpárral rendelkezik, amely szívesen fogad el egy protont. Az ammónia azonban gyenge bázisnak minősül, ami olyan kémiai vegyület, amely vizes oldatban nem bomlik szét teljesen ionokra. Amikor a molekulák ionokra bomlanak, a folyamatot disszociációnak nevezzük. Ezáltal más kémiai szerkezetűvé válik, és vagy gyenge bázissá, vagy erős savvá válik, és fordítva.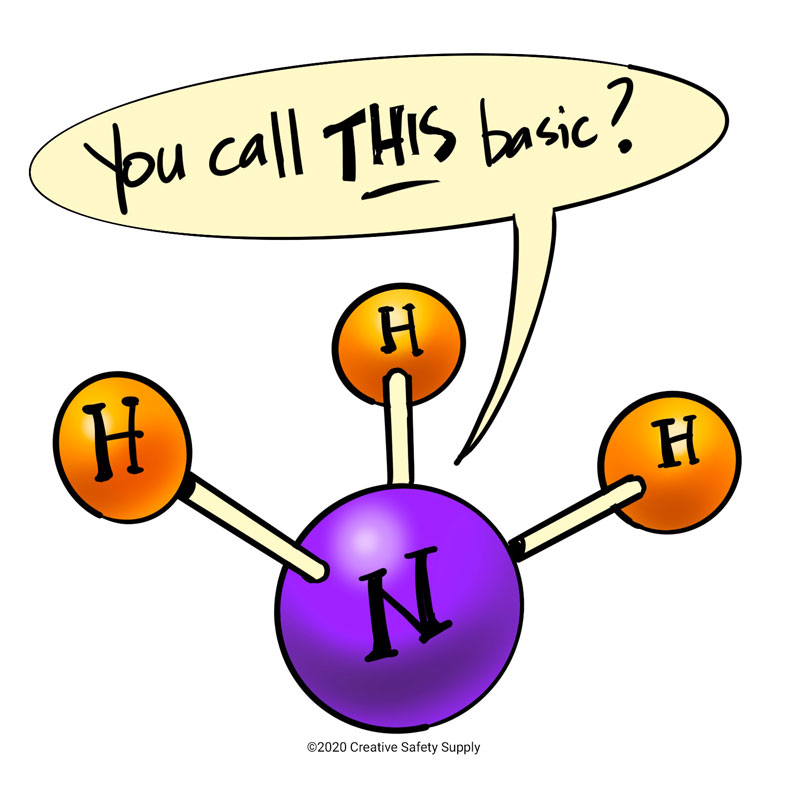
Az ammónia eleve nem tartalmaz hidroxidionokat, de amikor vízben oldódik, hidrogénionokat vesz fel a vízből, így hidroxid-, valamint ammóniumionok keletkeznek. Az ammónia azonban oldatban nem alakul át teljesen hidroxid- és ammóniumionokká, ezért gyenge bázisnak számít. Amikor szétesik, pozitív töltésű ammóniumionokká (NH4+) és negatív töltésű hidroxidionokká (OH-) alakul, de az ammóniamolekulák egy része még mindig össze van kötve. Mivel nem minden molekula bomlott szét, a disszociáció nem tekinthető teljesnek, mivel csak egy nagyon elenyésző százalékban keletkeztek ténylegesen hidroxidionok az ammónia molekulákból.
Most, amikor a bázisokat vagy savakat erősnek vagy gyengének minősítik, ennek a besorolásnak csak abban a tekintetben van értelme, hogy az adott vegyi anyag reakciójának koncentrációit hogyan határozzák meg. Nem írja le, hogy mennyire reaktívak, oxidáló vagy maró hatásúak. Az erős bázisok ugyanolyan maró hatásúak és veszélyesek lehetnek, mint az erős savak. Vegyük példaként a vízmentes ammóniát: pH-értéke körülbelül 11,6, mégis kémiai égési sérüléseket okoz az embereknek, és súlyos irritációt okoz a nyálkahártyákon, a bőrön és a szemen, ugyanúgy, ahogyan a sósav (pH 0) expozíciója maró hatású ugyanezekre a területekre.