Az enzimek szerkezeti instabilitása
A tény, hogy az aktív helyek olyan jól alkalmazkodnak az adott környezeti feltételek biztosításához, azt is jelenti, hogy ki vannak téve a helyi környezet hatásainak. Igaz, hogy a környezeti hőmérséklet növelése általában növeli a reakciósebességet, legyen az enzimkatalizált vagy egyéb reakció. A hőmérsékletnek az optimális tartományon kívüli növelése vagy csökkentése azonban úgy befolyásolhatja az aktív helyen belüli kémiai kötéseket, hogy azok kevésbé alkalmasak a szubsztrátok megkötésére. A magas hőmérséklet végül az enzimek, más biológiai molekulákhoz hasonlóan, denaturálódnak, ami egy olyan folyamat, amely megváltoztatja az anyag természetes tulajdonságait. Hasonlóképpen a helyi környezet pH-ja is befolyásolhatja az enzimek működését. Az aktív hely aminosavmaradványainak saját savas vagy bázikus tulajdonságai vannak, amelyek optimálisak a katalízishez. Ezek a maradékok érzékenyek a pH-változásokra, amelyek ronthatják a szubsztrátmolekulák kötődését. Az enzimek alkalmasak arra, hogy egy bizonyos pH-tartományban működjenek a legjobban, és a hőmérséklethez hasonlóan a környezet szélsőséges (savas vagy bázikus) pH-értékei is az enzimek denaturálódását okozhatják.
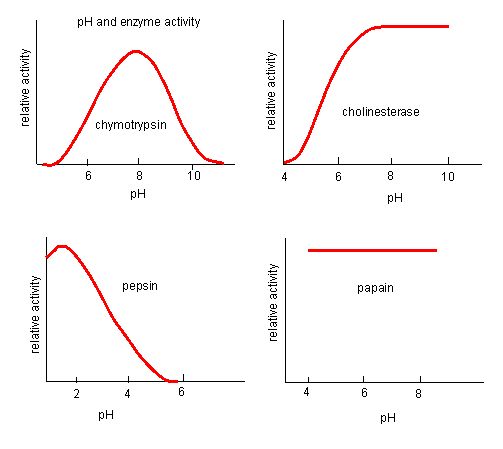
4. ábra. Az enzimeknek van egy optimális pH-értékük. Az a pH, amelynél az enzim a legaktívabb, az a pH, ahol az aktív centrum R-csoportjai protonálódnak/deprotonálódnak úgy, hogy a szubsztrát be tudjon jutni az aktív centrumba, és a reakció kezdeti lépése megkezdődhessen. Néhány enzimnek nagyon alacsony (savas) pH-ra van szüksége ahhoz, hogy teljesen aktív legyen. Az emberi szervezetben ezek az enzimek valószínűleg az alsó gyomorban találhatók, vagy a lizoszómákban (a sejten belüli nagyméretű vegyületek emésztésére szolgáló sejtszervezet) helyezkednek el.
Forrás: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
A folyamat, amelyben az enzimek denaturálódnak, általában a tercier szerkezet feloldásával kezdődik a tercier szerkezetet összetartó kötések destabilizációja révén. A hidrogénkötések, ionos kötések és kovalens kötések (diszulfidhidak és peptidkötések) mind felbomolhatnak a hőmérséklet és a pH nagymértékű változása következtében. Az enzimaktivitás és a hőmérséklet alábbi táblázatát felhasználva készítsd el a piros enzim energiatörténetét. Magyarázza meg, mi történhet 37 °C és 95 °C között.
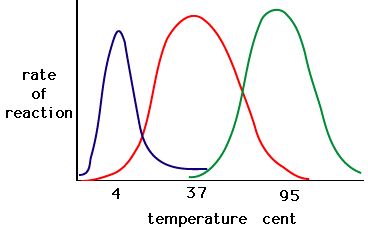
5. ábra. Az enzimeknek van egy optimális hőmérsékletük. Az a hőmérséklet, amelyen az enzim a legaktívabb, általában az a hőmérséklet, ahol az enzim szerkezete stabil vagy nem sérül. Néhány enzimnek meghatározott hőmérsékletre van szüksége ahhoz, hogy aktív maradjon és ne denaturálódjon. Forrás: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Induced fit and enzyme function
A tudósok sokáig úgy gondolták, hogy az enzim-szubsztrát kötődés egyszerű “zár-zár” módon történik. Ez a modell azt állította, hogy az enzim és a szubsztrát egyetlen pillanat alatt tökéletesen illeszkedik egymáshoz. A jelenlegi kutatások azonban egy kifinomultabb nézetet támogatnak, amelyet indukált illeszkedésnek neveznek. Az indukált illeszkedés modellje az enzim és a szubsztrát közötti dinamikusabb kölcsönhatás leírásával bővíti a “zár és kulcs” modellt. Ahogy az enzim és a szubsztrát találkozik, kölcsönhatásuk enyhe elmozdulást okoz az enzim szerkezetében, amely megerősíti az enzim és a szubsztrát átmeneti állapota közötti produktívabb kötési elrendeződést. Ez az energetikailag kedvező kötődés maximalizálja az enzim képességét a reakció katalizálására.
Amikor egy enzim megköti a szubsztrátját, egy enzim-szubsztrát komplex jön létre. Ez a komplex csökkenti a reakció aktiválási energiáját és elősegíti a reakció gyors lefolyását többféle módon. Alapszinten az enzimek elősegítik az egynél több szubsztrátot tartalmazó kémiai reakciókat azáltal, hogy a szubsztrátokat optimális orientációban hozzák össze. Az egyik molekula megfelelő régiója (atomjai és kötései) a másik molekula megfelelő régiójával kerül egymás mellé, amellyel reagálnia kell. Egy másik módja annak, hogy az enzimek elősegítik szubsztrátjaik reakcióját, az, hogy az aktív helyen belül energetikailag kedvező környezetet teremtenek a reakció lejátszódásához. Bizonyos kémiai reakciók enyhén savas vagy nem poláros környezetben mehetnek végbe a legjobban. Az aminosavmaradványoknak az aktív helyen belüli sajátos elrendezéséből adódó kémiai tulajdonságok teremtik meg az enzim specifikus szubsztrátjainak energetikailag kedvező környezetét a reakcióhoz.
A sok reakcióhoz szükséges aktiválási energia tartalmazza azt az energiát, amely a kémiai kötések kismértékű elferdítéséhez szükséges, hogy azok könnyebben reagálhassanak. Az enzimhatás segítheti ezt a folyamatot. Az enzim-szubsztrát komplex csökkentheti az aktiválási energiát azáltal, hogy a szubsztrátmolekulákat úgy alakítja át, hogy megkönnyítse a kötések felszakadását. Végül az enzimek azáltal is csökkenthetik az aktiválási energiát, hogy részt vesznek magában a kémiai reakcióban. Az aminosavmaradványok bizonyos ionokat vagy kémiai csoportokat biztosíthatnak, amelyek a reakciófolyamat szükséges lépéseként kovalens kötéseket képeznek a szubsztrátmolekulákkal. Ezekben az esetekben fontos megjegyezni, hogy az enzim a reakció befejeztével mindig visszatér eredeti állapotába. Az enzimek egyik jellemző tulajdonsága, hogy az általuk katalizált reakciók végső soron változatlanok maradnak. Miután egy enzim befejezte a reakció katalizálását, felszabadítja a termék(ek)et.
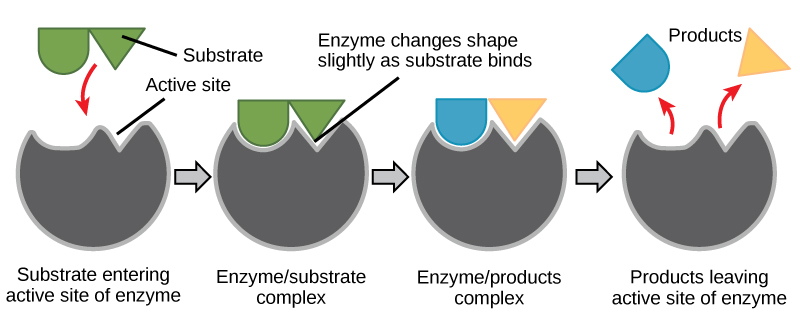
6. ábra. Az indukált-illeszkedő modell szerint mind az enzim, mind a szubsztrát dinamikus konformációs változásokon megy keresztül a kötéskor. Az enzim a szubsztrátot az átmeneti állapotába alakítja, ezáltal megnöveli a reakció sebességét.
A fenti reakció energiatörténetének megalkotása
A 6. ábra segítségével válaszoljon az energiatörténetben feltett kérdésekre.
1. Válassza ki a fenti reakciót! Melyek a reaktánsok? Mik a termékek?
2. Milyen munkát végzett az enzim?
3. Milyen állapotban van kezdetben az energia? Milyen állapotba alakul át az energia a végállapotban? Ez még mindig trükkös lehet, de próbáld meg azonosítani, hogy hol van az energia a kezdeti és a végső állapotban.