A morbillivírusok rendkívül fertőző kórokozók, és különböző kitörésekért felelősek a nem kitett populációkban (Pfeffermann et al., 2018). A Mononegavirales rendbe és a Paramyxoviridae családba tartoznak, és nem szegmentált, lineáris, negatív szálú RNS-genom jellemzi őket (Lamb és Parks, 2013). A morbillivírusokat az különbözteti meg, hogy közepesen súlyos vagy súlyos légúti, gyomor-bélrendszeri, immunszupressziós és/vagy neurológiai betegségeket okoznak a gazdák széles körében, beleértve az embert (kanyaróvírus), a húsevő állatokat (kutyamorbillivírus, korábban szopornyica vírus), a szarvasmarhákat (rinderpest vírus), delfineket és delfineket, valamint más, vadon élő, veszélyeztetett fajokat (Lamb és Parks, 2013; Martinez-Gutierrez és Ruiz-Saenz, 2016).
A kanyaróvírust (MeV) és a kutyák morbillivírusát (CDV) tartják a legfertőzőbb vírusoknak e családból (De Vries et al., 2015), és a CDV magas átviteli potenciálja, valamint a fajok közötti átviteli lehetősége miatt a globális egészségügyi, és természetvédelmi hatóságok nagymértékben aggódnak a CDV veszélyeztetett fajok megőrzésében betöltött szerepe és az állatokról az emberre történő esetleges “átugrása” miatt (Terio és Craft, 2013; Ohishi et al., 2014). A házi kutyák a CDV fő gazdái, és más emlősök számára is rezervoárnak tekinthetők (Suzuki et al., 2015; Duque-valencia et al., 2019); a CDV biológiája alapján azonban az ember is potenciális célponttá válhat (Cosby és Weir, 2018; Rendon-Marin et al, 2019).
A CDV emberre történő átvitelének potenciális kockázatának megértéséhez össze kell gyűjteni az összes létező bizonyítékot; és e kórokozó kutyapopulációban való eredetének és terjedésének tanulmányozása fontos kulcsot jelenthet e folyamat megértéséhez. A közelmúltban az International Journal of Paleopathology című folyóiratban megjelent tanulmány a CDV evolúciós eredetéről szóló vitára hívott fel. Arra a következtetésre jutott, hogy a CDV pandémiás kórokozóként Dél-Amerikában keletkezett, miután a dél-amerikai kolonizációs időszakban a MeV megfertőzte és adaptálta a kutyákat. Ezt az eredményt egy interdiszciplináris megközelítéssel érték el, amelyet a virginiai Weyanoke Old Town lelőhelyről származó 96 prekolumbián kori kutya (i. sz. 750-1470) paleopatológiai elemzésének szintetizálásával, történelmi jelentésekkel, molekuláris elemzéssel és morbillivírusos járványtannal fogadtak el (Uhl et al, 2019).
Az amerikai őshonos kutyapopulációk a gyarmatosítás időszakát követően szinte teljesen eltűntek, és európai és eurázsiai kutyák kerültek a kontinensre, kevés genetikai hátteret hagyva az amerikai elődökre (Ni Leathlobhair et al., 2018). Egy másik fontos tényező, amelyet érdemes figyelembe venni, hogy “ismeretlen” betegségeket is behurcolhattak, ami megnehezíti az új kórokozók eredetének nyomon követését. Ezenkívül a házi kutyák, sőt az emberi populációkra gyakorolt mesterséges szelekciós nyomás, különösen a gyarmatosítás időszakában, fokozhatta a betegségek előfordulását, ezáltal korlátozhatta a genetikai variációt (Ostrander et al, 2017), ami viszont kevésbé hatékony választ jelenthet a kórokozókkal szemben.
Az “új” kórokozók/betegségek közül a CDV-t először Antonio de Ulloa y de la Torre-Giral írta le 1746-ban, mint a kutyákat érintő betegséget Quito térségében és Dél-Amerika más részein, majd nem sokkal később Európában is jelentették. A CDV-t 1760-ban jegyezték fel Spanyolországban, Madridban egyetlen nap alatt 900 elpusztult kutyával, majd 3 évvel később, azaz 1764-re és 1770-re Nagy-Britanniát és Olaszországot is elérte (Blancou, 2004). A vírus átvihetőségéről és a kölyökkutyák nagyobb fogékonyságáról a felnőtt kutyákhoz képest később Edward Jenner számolt be az 1800-as évek elején. Összehasonlította átvihetőségüket a MeV-vel, és felfedezte, hogy a túlélők védettek a későbbi fertőzéssel szemben (Jenner, 1809; Nambulli et al., 2016).
Röviden, az európai úttörők XV. századi érkezése után az új fertőző betegségek vitathatatlanul a gyarmatosítás legpusztítóbb következményei lettek, mivel az amerikai őslakosok korábban nem voltak kitéve az Európában elterjedt kórokozóknak (Walker et al., 2015). Többszörös kanyarójárványok pusztítottak tehát az amerikai őslakos népességekben (Walker et al., 2015; Nambulli et al., 2016). Uhl és munkatársai a paleopatológiai, történeti, molekuláris és járványtani bizonyítékok vegyes megközelítésén keresztül arról számoltak be, hogy az amerikai őslakos populációkat sújtó súlyos kanyarójárványok elősegítették a kanyarónak a dél-amerikai városi környezet nagy házikutya-populációira való átugrását és a vírus endémiás CDV-ként való adaptációját (Uhl et al., 2019). Történelmi feljegyzések is bizonyíthatják, hogy néhány évvel a dél-amerikai kutyákhoz való alkalmazkodás után, 1760-ban a CDV Európába került, ahol kezdetben széles körű, magas mortalitással járó járványokat idézett elő, mielőtt endémiássá vált (Jenner, 1809).
Az evolúciós előrejelzésekkel kapcsolatos molekuláris filogeográfiát és a legfrissebb közös ősig terjedő időt (tMRCA) azonban a CDV Egyesült Államokból való eredetére vonatkozóan az 1880-as években számították ki (95%-os legmagasabb poszterior sűrűség, 1858-1913) (Panzera et al, 2015), ami egyértelműen ellentmond a vírus tizennyolcadik századi európai leírásának. Az ehhez a hipotézishez vezető szekvenciaelemzéseket alaposan meg kell vizsgálni, mivel a molekuláris filogeográfiai rekonstrukcióhoz felhasznált szekvenciák elfogultsága és korlátozott hozzáférhetősége miatt. Ráadásul a CDV és más morbillivírusok vírus-RNS genomjának labilitása miatt számos eredeti ősi szekvencia elveszett. E tényezők miatt megkérdőjeleződött az RNS-vírusokra vonatkozó jelenlegi tMRCA-számítások hasznossága (Sharp és Simmonds, 2011; Nambulli és mtsai., 2016).
Az Uhl és mtsai. szerint, a morbillivírus i. e. 376 körül származhatott a szarvasmarhából az “öreg kontinensen” (1. ábra), és az állatok háziasítása jelentős hatással lehetett a fajok közötti eseményekre, ami valószínűleg i. e. 900 körülre teszi a MeV kialakulásának kezdőpontját (Uhl et al., 2019). A jelenlegi CDV filogenetikai rekonstrukciókkal ellentétben a MeV divergenciáját a lazított óra Bayes-féle filogenetikai elemzés erősen támogatja. A MeV és a rinderpest-vírus közötti divergencia ideje nagyjából a tizenegyedik-tizenkettedik században következett be (Furuse et al., 2010). Más molekuláris adatok, például egy új (a CDV-vel és a PDV-vel közeli rokonságban álló), Brazíliából származó denevérekben keringő morbillivírus (DrMV) jelenléte lehetővé teszi a feltételezést, hogy a CDV-nek és a DrMV-nek közös dél-amerikai őse lehet (Drexler et al., 2012), ami közvetve alátámasztja a CDV korai dél-amerikai eredetének elképzelését.
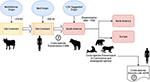
1. ábra. A kutyák morbillivírusának (CDV) lehetséges evolúciós terjedési útvonalának sematikus ábrázolása. A hivatkozásokat lásd a szövegben.
A CDV földrajzi eredetének és divergenciájának időpontjának ismeretelméleti és/vagy tudományos jelentőségén túlmenően vannak fontos támpontok, amelyeket tisztázni kell ahhoz, hogy jobban megértsük a CDV-k jelenlegi hatását a fajok közötti átvitelre, az állatvédelemre és a zoonózis potenciálra (1. ábra). Egyértelmű, hogy a MeV-fertőzéssel ellentétben, amelyet egyetlen gazdaszervezet (ember) tart fenn, a CDV széles körben bizonyítottan promiszkuózus kórokozó, amely fertőzést/betegséget okoz húsevő és nem húsevő fajok széles körében (Martinez-Gutierrez és Ruiz-Saenz, 2016). Ezt a promiszkuitást nemcsak annak tulajdonították, hogy a CDV hemagglutinin (H) képes kölcsönhatásba lépni a gazdasejtek receptoraival, mint például a SLAM a mononukleáris sejtekben és a nectin-4 a hámsejtekben, hanem a fent említett receptorok fajonkénti szekvenciáinak hasonlóságának is (Rendon-Marin et al., 2019). Az emlősök SLAM-receptorai között, beleértve a tengeri emlősöket is, az aminosav-hasonlóság >80% (Ohishi et al., 2014), ami alátámasztja a fajok közötti átvitelre vonatkozó eredményeket. Ezenkívül a nectin-4 szekvenciákban nincs fajhoz kötött eltérés az emberek, egerek és kutyák között, mivel az emberi nectin-4 in vitro receptorként működhet a CDV számára (Noyce és mtsai., 2011).
A különböző főemlősökben előforduló természetes CDV-kitörések aggodalmat keltettek a CDV emberre történő lehetséges átvitelével kapcsolatban (Yoshikawa és mtsai., 1989; Sun és mtsai., 2010; Qiu és mtsai., 2011; Sakai és mtsai., 2013a). Vannak jelentések arról, hogy a CDV majomtörzsek eredendően képesek a humán nectin-4-et használni a vírus bejutásához, és hogy ezek a majom CDV-k könnyen alkalmazkodnak a humán CD150 (SLAM) receptor használatához a vírus H fehérjéjének minimális aminosavváltozásait követően (Bieringer és mtsai., 2013; Sakai és mtsai., 2013b). A Cynomolgus makákók (Macaca fascicularis) in vivo kísérleti CDV-fertőzése alapján azonban MeV-immunitás jelenlétében a makákók részben keresztvédettek a CDV-kihívással szemben (De Vries és mtsai., 2014). Ez arra utal, hogy bár a CDV könnyen megfertőzheti a főemlősöket, a MeV-immunitás védelmet nyújt, és a CDV-fertőzés önkorlátozó lehet. Ezt az eredményt az emberre átvihetve a CDV-fertőzés potenciális kockázata áll fenn azoknál az embereknél, akiknek nincs keresztprotektív MeV-immunitásuk az oltás elmaradása és a vakcinázás sikertelensége miatt (Haralambieva és mtsai., 2015) vagy a vakcinázás hiánya miatt a lehetséges poszt-eradikációs korszakban (Holzmann és mtsai., 2016).
A jelentések szerint az “új vírusok” a vírusok állatokból emberre történő fajokon átívelése révén keletkezhetnek (Wolfe és mtsai., 2007). Új, strukturális és bioinformatikai vizsgálatok azt sugallják, hogy egyetlen aminosav változás egy fehérjeszekvenciában elegendő lehet ahhoz, hogy leküzdjék a két különböző gazdaszervezet, például az ember és a kérődzők közötti sejtreceptorok használatának korlátozását (Abdullah et al., 2018). A CDV H fehérjében in vitro egy egyedi mutáció lehetővé teszi, hogy ez a kórokozó megfertőzze a humán SLAM-receptort expresszáló sejteket (Otsuki és mtsai., 2013). Továbbá, ha elfogadjuk azt a hipotézist, hogy a CDV a MeV-ből fejlődött ki, akkor lehetséges, hogy egy CDV leszármazott képes lehet újra megfertőzni az embert, mivel mind a vírus, mind az ember folyamatos evolúciója miatt, ahogyan azt korábban más modellekben is feltételezték, annak ellenére, hogy az ősi “ugróvírus” idővel ezelőtt eltűnt a Földről (Emerman és Malik, 2010).
Az Uhl et al. által bemutatott egyik legérdekesebb eredmény továbbá az, hogy mind a CDV, mind a MeV géneket az emberi kodonhasználati torzításhoz (CUB) optimalizálták, ami arra utal, hogy a CDV kodonhasználata közelebb áll az emberi CUB-hoz, mint a kutya CUB-hoz, mivel a vírus vagy annak elődje, valószínűleg a MeV, eredetileg az emberhez alkalmazkodott (Uhl et al., 2019). A CUB arra a jelenségre utal, amikor egyes szinonim kodonokat gyakrabban használnak, mint másokat, és arra, hogy ez a preferencia hogyan változik fajon belül és fajok között (Behura és Severson, 2013). Az RNS-vírusokban a kodonhasználat szelekció alatt áll, mivel a vírusok teljesen függnek a gazdaszervezet tRNS-eitől, és a torzítás abból adódik, hogy a vírusok illeszkednek a gazdaszervezetek kodonhasználatához (Jenkins és Holmes, 2003). Az evolúció néha előnyben részesítheti a gazdaszervezetüknek megfelelő kodonhasználattal rendelkező vírusokat a replikációs sebesség és a gazdaszervezethez való alkalmazkodás elősegítése érdekében, amint arról más RNS-vírusok esetében is beszámoltak (Goni et al., 2012; Lauring et al., 2012; Di Paola et al., 2018; Freire et al., 2018).
Végezetül szeretnénk amellett érvelni, hogy a CDV lehetséges zoonózis-forgatókönyvében néhány más tényezőt is figyelembe kell venni. A MeV és a CDV közötti keresztsemlegesítést már évek óta felismerték (Brown és Mccarthy, 1974), és ez a feltevés már több mint fél évszázada fennállt, amikor a MeV-vakcinát a kölykök CDV elleni védelmére használták olyan korban, amikor a passzív anyai immunitás gyakran zavarta a CDV elleni vakcinázást (Baker et al., 1966; Brown et al., 1972). Ennek ellenére a kereskedelmi forgalomban kapható kettős CDV/MeV vakcina használata még mindig ajánlott az anyai immunitás megléte esetén történő vakcinázásra, és a vakcina hasznosnak bizonyult a klinikai kanyaróbetegség ellen főemlősöknél (Christe és mtsai., 2019). Ezért feltételezhetjük, hogy a MeV csordaimmunitással elkerülhető a CDV átugrása és az emberre való esetleges újbóli alkalmazkodás a kutyákon vagy vadon élő állatokon keresztül történő átvitel révén.
Köszönő megjegyzések
A vírusos kórokozók evolúcióját és eredetét nem lehet könnyen tanulmányozni; a továbbiakban multidiszciplináris megközelítésre van szükség az embereket fenyegető új lehetséges vírusos veszélyek megértéséhez és talán előrejelzéséhez. Sajátos biológiájuk miatt az olyan vírusos kórokozók, mint a CDV, egyedülálló modellt jelentenek az emberi populációhoz nagyon közel lévő vírusos kórokozók fajok közötti ugrásának és zoonotikus potenciáljának megértéséhez. A hagyományos molekuláris filogenetikai vizsgálatok és a paleopatológiai munkák mellett a kutatóknak különböző megközelítéseket kell alkalmazniuk a CDV eredetének és a fajok közötti ugrás jelenlegi vírus- és gazdaszervezeti követelményeinek tanulmányozására. A számítógépes módszerek, például a strukturális bioinformatika és a paleovirológiai vizsgálatok bevezetése segíthetne az előrejelzésben és a megelőzésben, vagy legalábbis jobb megértést nyújthatna erről az újonnan megjelenő, és talán zoonózisos betegségről egy más szemszögből, figyelembe véve nemcsak a szekvenálási adatokat, hanem a struktúrákat és funkciókat is, mint kulcsfontosságú információkat e cél érdekében.
A szerzők hozzájárulása
A felsorolt szerzők mindegyike jelentős, közvetlen és szellemi hozzájárulást nyújtott a munkához, és jóváhagyta azt a közzétételre.
Finanszírozás
Ezt a munkát a Departamento Administrativo de Ciencia, Tecnología e Innovación-COLCIENCIAS 123171249669 számú, JR-S-nek nyújtott támogatása támogatta anyagilag.
Enyilatkozat az összeférhetetlenségről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Brown, A. L., és Mccarthy, R. E. (1974). A kanyaró és a kutyák szopornyica vírusai közötti kapcsolat meghatározása késleltetett típusú túlérzékenységi reakciókkal kutyákban. Nature 248, 344-345. doi: 10.1038/248344a0
PubMed Abstract | CrossRef Full Text | Google Scholar