Introduction
Chronic kidney disease (CKD) is highly prevalent worldwide. Kínában 10 emberből közel 1 szenved valamilyen fokú veseműködési zavarban, ami összesen közel 150 millió beteget jelent (1). A vérszegénység és a másodlagos hyperparathyreosis a CKD két leggyakoribb szövődménye (2, 3). Valójában arról számoltak be, hogy az előrehaladott CKD-ben szenvedő (4. és 5. stádiumú CKD-be sorolt) betegek közel 90%-a vérszegénységben szenved (4). Az anémia kialakulása és súlyossága bizonyítottan jól korrelál a glomeruláris filtrációs ráta csökkenésével (4). A vérszegénység korai felismerése, értékelése és kezelése csökkentheti a morbiditást és a mortalitást, valamint javíthatja a CKD-s betegek életminőségét.
A másodlagos hyperparathyreosisra a szérum parathormon (PTH) emelkedett szintje jellemző. A túlzott PTH károsíthatja az erythropoiesist azáltal, hogy közvetlen toxikus hatást gyakorol az erythroid progenitor sejtekre és közvetett hatást a csontvelőfibrózis indukcióján keresztül (5, 6). Ezenkívül az urémiás betegek alacsony hemoglobinkoncentrációja az eritrociták ozmotikus törékenységének a magas PTH-koncentráció miatti növekedése miatt alakulhatott ki (7). Fordított összefüggést állapítottak meg a PTH és a hemoglobinszint között (8-10). Meytes és munkatársai azt találták, hogy a 7,5-30 U/ml közötti PTH-koncentráció, amely összehasonlítható az urémiás betegek szérum PTH-szintjével, a burst forming unit-erythroid (BFU-E) növekedés jelentős gátlását idézte elő egér csontvelő kultúrákban, ami a túlzott PTH részvételének lehetséges útvonalára utal az urémiás anémia genezisében (11).
Az eritropoiesist serkentő szerek (ESA-k) a CKD-s betegek vérszegénységének terápiájában meghatározóvá váltak, és a dializált betegeknél a leggyakrabban felírt gyógyszer, Kínában >95%-os felhasználás mellett (1). Az első rekombináns humán eritropoetin, az epoetin-alfa 1988-ban kapott engedélyt az Egyesült Államokban (12). Az epoetin-alfa és az epoetin-béta rövid hatású és költséghatékony terápiás szerek, és a CKD-s betegek többségénél – heti egy-három alkalommal – adják őket. A célzott hemoglobinszint elérése vagy fenntartása érdekében azonban a dózis meghosszabbított adagolási intervallummal nő. Az Epiao® (3000 μ/tubus) egy Kínában széles körben használt Epoetin-alfa-fajta, míg a Recormon® (2000 μ/tubus) egy Európában gyakrabban használt Epoetin-béta-fajta, amelyet Kínában körülbelül 4 éve alkalmaznak.
A közelmúltban végzett klinikai vizsgálatok eredményei azt mutatták, hogy a magas hemoglobincélértékeket elérő dózisok a halálozás vagy a nemkívánatos kimenetel, például a tromboembóliás események és a stroke fokozott kockázatával kapcsolatos aggályokat vetettek fel (13-16). Andrews és munkatársai azt találták, hogy a nagy dózisoknál megnövekedett adagolási gyakoriság növelte a trombotikus toxicitások előfordulását az alacsonyabb dózisú csoportokban ritkábban adagolt állatokhoz képest, annak ellenére, hogy minden csoportban hasonlóan magas volt a hematokrit (17), ami arra utal, hogy a magas hematokrit nem az egyetlen okozó tényező, amely ESA-val kapcsolatos toxicitásokhoz vezet, hanem összefügg a dózisszint, az adagolási gyakoriság és az adagolás időtartama is. Ezért a magas hematokrittól független, ESA-val összefüggő toxicitásokra nagy figyelmet kell fordítani.
A rendszeres hemodialízisen tartott urémiás betegeknél jelenleg korlátozott adatok állnak rendelkezésre az ESA-k dózisa és a PTH közötti lehetséges kapcsolatról. Ennek a retrospektív tanulmánynak a célja az volt, hogy kórházunk számítógépes adatbázis-rendszerében szereplő klinikai adatok alapján megvizsgálja az ESA-k dózisa és az intakt-PTH (iPTH) szintje közötti összefüggést hemodializált betegeknél.
Anyagok és módszerek
Betegek és eljárások
Ezt a retrospektív kohorszvizsgálatot 2015 februárjától 2015 májusáig végeztük a Xiamen Zhongshan Hospitalban, Xiamen University, Kína. A vizsgálatba olyan, legalább 3 hónapig fenntartott hemodialízisben részesülő urémiás betegek kerültek, akik az anémia kezelésére ESA-t alkalmaztak. A vizsgálatból kizárták azokat a betegeket, akik megfeleltek az alábbi kritériumoknak: (1) életkor <18 év; (2) aktív fertőzésben, rosszindulatú daganatos betegségben, vashiányos vérszegénységben (ferritin <100 ng/ml és szaturáció <20%) vagy 3 hónapon belüli aktív vérzésben szenvedő betegek; (3) hiányos adatokkal rendelkező betegek. A támogatható betegeket az alkalmazott ESA alapján két csoportba sorolták: Rekormon csoport és Epiao csoport.
Adatgyűjtés
Az adatokat a Xiamen Zhongshan Kórház számítógépes adatbázis-rendszeréből, a Jinshida-ból nyertük, amely 376 hemodializált beteg klinikai adatait kódolta újra. A következő adatokat gyűjtötték: életkor, nem, száraz súly, elsődleges betegségek diagnózisa, vér karbamid nitrogén (BUN), szérum kreatinin (Scr), hemoglobin, kalcium, foszfor, albumin, iPTH, szérum ferritin, transzferrin telítettség és az ESA-k adagolása. Ezeket az adatokat a hemodialízis napján reggel (dialízis előtt) mértük. A Kidney Disease Improving Global Outcomes (KDIGO) irányelvekkel összhangban a normális hemoglobinszintet 110 és 130 g/l közötti értékként határozták meg a fenntartott hemodialízisben részesülő urémiás betegeknél (8). A szérum kalcium és foszfor referenciaértékeit 2,1-2,54, illetve 1,1-1,78 mmol/l közötti értékekként határozták meg (18). A betegeket tovább osztályozták az iPTH-szintek alapján: 150, 300, 600 és 1500 pg/ml (19, 20).
A vizsgálat etikája
A vizsgálatot kórházunk elektronikus betegnyilvántartó rendszeréből nyert retrospektív adatok elemzésével végeztük. A humán kutatásra vonatkozó vizsgálati protokollt a Xiamen Egyetem Zhongshan Kórházának etikai bizottsága hagyta jóvá. Minden vizsgálati alanytól írásbeli beleegyezést kaptunk.
Statisztikai elemzés
A statisztikai elemzést az SPSS for Windows szoftver 17.0 verziójával végeztük. Az adatokat százalékban vagy átlagban ± az átlag standard hibája (SEM) kifejezve adtuk meg. A csoportok közötti demográfiai adatokat és laboratóriumi méréseket a Pearson-féle chi-négyzet-teszttel, a Fisher-féle egzakt teszttel vagy a Yate-féle folytonossági korrekcióval hasonlítottuk össze. A <0,05 P-értéket statisztikailag szignifikánsnak tekintettük.
Eredmények
A rendszeres hemodialízisen tartott urémiás betegek jellemzői
A vizsgálatba összesen 240 rendszeres hemodialízisen tartott urémiás beteget vontunk be. A betegek kiindulási jellemzőit az 1. táblázat tartalmazza. Nem volt szignifikáns különbség az életkor, a nem, a száraz súly, az elsődleges betegségek, a BUN, a Scr, a hemoglobin, a szérumfoszfát, a kalcium, az albumin, a szérumferritin és a transzferrin-szaturáció tekintetében a Recormon- és az Epiao-csoport között (1. táblázat, P > 0,05).

1. táblázat. A betegek kiindulási jellemzői.
Az összes alany átlagos hemoglobinszintje 103,15 ± 1,07 g/l volt. A 110 és 130 g/L közötti hemoglobinszintű betegek aránya 30,4% volt (n = 84). A vérszegénységet a hemoglobinszint alapján öt osztályba sorolták a vérszegénység súlyosságának megfelelően (21, 22): hemoglobinszint <60 g/L (2,1%, n = 5), hemoglobinszint ≥60 és <90 g/L (21,7%, n = 52), hemoglobinszint ≥90 és <110 g/L (38.7%, n = 93), hemoglobinszint ≥110 és <130 g/L (30,4%, n = 73), és hemoglobinszint ≥130 g/L (7,1%, n = 17).
A vérszegénység mértéke és az iPTH közötti kapcsolat
A különböző mértékű vérszegénység és az iPTH közötti kapcsolatot elemezték. Az eredmények azt mutatták, hogy a hemoglobinszint negatív kapcsolatban állt az iPTH-val (1A. ábra; 2. táblázat; P < 0,05). Nem találtak azonban szignifikáns összefüggést az anémia és a szérum kalcium- vagy foszforszint között (1B ábra; 2. táblázat; P > 0,05 mindkét esetben).
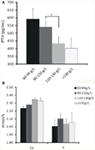
1. ábra. A hemoglobinkoncentráció és az iPTH, a szérum kalcium- vagy foszforszintek közötti kapcsolat. (A) A hemoglobinkoncentráció az iPTH-szint csökkenésével nőtt a rétegződés szerint. (B) A hemoglobinkoncentráció és a szérum kalcium- vagy foszforszint között nem találtunk szignifikáns összefüggést. Az adatokat t-próbával számoltuk. *P < 0,05.

2. TÁBLA. A szérum kalcium-, foszfor- és iPTH-szintek mérése a hemoglobinértékek alapján rétegzés szerint.
A 150-300 pg/mL iPTH-értékkel rendelkező betegeknél volt a legmagasabb a hemoglobin, a szérumferritin és a transzferrin-szaturáció szintje
Ahol az iPTH-szint 150-300 pg/mL között volt, a hemodializált betegeknél volt a legmagasabb a hemoglobin, a szérumferritin és a transzferrin-szaturáció átlagos szintje; ezek 106.25 g/L, 248,98 μg/L, illetve 30,97% volt (2. ábra).
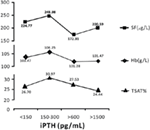
2. ábra. A 150-300 pg/ml közötti iPTH-szintű betegeknél volt a legmagasabb a hemoglobin, a szérumferritin és a transzferrin-szaturáció. Az adatok százalékban vagy átlag ± SEM-ben vannak kifejezve.
A Recormon vs. Epiao összehasonlítása a vérszegénység kezelésében
A Recormonnal és Epiao-val kezelt betegek hemoglobinszintje hasonló volt (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05; 3A ábra). Azonban a Recormon (3853,66 ± 225,13 μ/hét, n = 98) adagja a vérszegénység kezelésére szignifikánsan kisebb volt, mint az Epiao (7083,33 ± 264,93 μ/hét, n = 142, P < 0,05; 3B ábra, 1. táblázat).
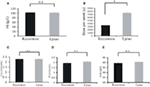
3. ábra. A Recormon vs. Epiao összehasonlítása a vérszegénység kezelésében. (A) A Recormonnal és Epiao-val kezelt betegek hemoglobinszintje hasonló volt (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05). (B) A Recormon adagja a vérszegénység kezelésére szignifikánsan kisebb volt, mint az Epiaoé, 3 853,66 ± 225,13 μ/hét, n = 98 vs. 7 083,33 ± 264,93 μ/hét, n = 142. (C-E) A kalcium (C), foszfor (D) és albumin (E) szintekben nem volt szignifikáns különbség a Recormon és Epiao csoportok között. Az adatokat t-próbával számoltuk; P > 0,05.
A kalcium-, foszfor- és albuminszérumszintek nem különböztek szignifikánsan a Recormon- és az Epiao-csoportok között (illetve 2.27 ± 0,47 vs. 2,29 ± 0,01 mmol/l, P > 0,05; 1,94 ± 0,10 vs. 2,06 ± 0,04 mmol/l, P > 0,05; 39,5 ± 0,44 vs. 40,2 ± 0,0.35 g/L, P > 0,05; 3C-E ábrák; 1. táblázat).
Az ESA-adagok és az iPTH-szintek közötti kapcsolat
A hemodializált betegek mindegyikénél a Recormon-csoportban alacsonyabb volt az iPTH-szint, mint az Epiao-csoportban (336.66 ± 57,76 pg/ml, n = 98 vs. 531,05 ± 39,57 pg/ml, n = 142; P < 0,05; 4A. ábra; 1. táblázat). Hasonló tendenciát találtunk a 110 és 130 g/L közötti hemoglobinszintű hemodializált betegeknél is (319,50 ± 74,9 pg/ml a Recormon csoportban, n = 28 vs. 499,5 ± 64,38 pg/ml az Epiao csoportban, n = 45; P < 0,05; 4A. ábra).
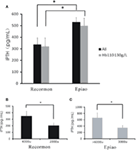
4. ábra. Az ESA-k dózisa és az iPTH-szintek közötti összefüggés. (A) Az iPTH szintje a Recormon és az Epiao csoportban. (B) A Recormon-csoportban az iPTH-szintek a Recormonnal 2000 vs. 4000 μ/hét adagban kezelt betegeknél. (C) Az Epiao-csoportban az iPTH-szintek az Epiao-val 3000 és >6000 μ/hét mellett kezelt betegeknél. Az adatokat t-próbával számoltuk; *P < 0,05.
A 110 és 130 g/l közötti hemoglobinszintű betegek körében az iPTH-szint 201,54 ± 42 volt.67 pg/ml (n = 10) a 2000 μ/hét Recormonnal kezelt betegeknél, ami szignifikánsan alacsonyabb volt, mint a 4000 μ/hét Recormonnal kezelt betegeknél (348,16 ± 117,9 pg/ml, n = 13; P < 0,05, 4B ábra). Hasonlóképpen, az Epiao-val 3000 μ/hétben kezelt betegek átlagos iPTH-szintje szignifikánsan alacsonyabb volt, mint az Epiao-val >6000 μ/hétben kezelt betegeké (347,15 ± 75,94 pg/ml, n = 12 vs. 661,01 ± 198,45 pg/ml, n = 27; P < 0,05, 4C ábra).
Diszkusszió
Ez a retrospektív vizsgálat az első, amely bizonyítékot szolgáltat arra, hogy az ESA-k (Epoetin-alfa és -béta) nagyobb dózisai magasabb iPTH-szintekkel járhatnak együtt a rendszeres hemodialízisen tartott urémiás betegeknél. Továbbá azt találtuk, hogy a 150-300 pg/ml közötti iPTH-szintű betegeknél volt a legmagasabb a hemoglobin, a szérumferritin és a transzferrin-szaturáció szintje, ami összhangban volt a KDIGO-irányelvek alapján ajánlott iPTH-szinttel (9).
A vérszegénység a CKD egyik leggyakoribb szövődménye. Az Egészségügyi Világszervezet az anémiát úgy definiálta, hogy férfiaknál és menopauza utáni nőknél 13,0 g/dl-nél alacsonyabb a hemoglobin koncentráció, illetve más nőknél <12,0 g/dl hemoglobin koncentráció. Az ESA-k alkalmazása jelentősen javította sok CKD-ben szenvedő vérszegény beteg életét. Kimutatták azonban, hogy az ESA-k nagy dózisai a CKD-ben szenvedő felnőttek és gyermekek esetében a kedvezőtlen kimenetelek fokozott kockázatával járnak. A nagy dózisú ESA-kkal kezelt betegeknél 1,2-1,5 százalékkal megnövekedett a halálozás kockázata (23). Ebben a vizsgálatban szignifikáns fordított összefüggést találtunk az iPTH-szint és a hemoglobin-koncentráció között az ESA-val kezelt hemodializált betegeknél, ami összhangban van a korábbi vizsgálatok eredményeivel (8-10).
Ebben a vizsgálatban a Recormon- és Epiao-csoportba tartozó betegek hasonló hemoglobin-koncentrációt mutattak; azonban a Recormon esetében alkalmazott dózis jelentősen alacsonyabb volt, mint az Epiao esetében. Azt is megállapítottuk, hogy az iPTH-szint a Recormon-csoportban szignifikánsan alacsonyabb volt, mint az Epiao-csoportban. Az ESA-k dózisa és az iPTH-szintek közötti összefüggés további meghatározása érdekében külön-külön elemeztük a Recormonnal vagy Epiaóval kezelt betegek klinikai adatait. A Recormonnal 2000 μ/hét dózisban kezelt betegek iPTH-szintje feltűnően alacsonyabb volt, mint a Recormonnal 4000 μ/hét dózisban kezelt betegeké. Hasonló tendenciát találtak az Epiao-val 3000 vagy 6000 μ/hét dózisban kezelt betegeknél is, ami arra utal, hogy az ESA-k nagy dózisai összefüggésben lehetnek a magas iPTH-szintekkel. Ezek az eredmények azt jelzik, hogy az ESA-toxicitások nem magyarázhatók kizárólag a magas hematokritértékkel. Tekintettel arra, hogy az ESA-k nagy dózisai magas iPTH-szintekhez társulhatnak a fenntartott dializált betegeknél, a végstádiumú vesebetegségben szenvedő betegek kezelése az ESA-k dózisának minimalizálásával vagy visszatartásával lehet a legjobb, különösen olyan betegek esetében, akiknél nemrégiben kardiovaszkuláris vagy cerebrovaszkuláris események, hipertóniás vészhelyzetek vagy akut tromboembóliás események történtek. Valójában, figyelembe véve a kardiovaszkuláris események fokozott kockázatát közel normális hemoglobin-koncentráció és nagy dózisú ESA-k mellett CKD-ben, Tajvanon nem ajánlott aránytalanul nagy dózisú ESA-k alkalmazása a 100-110 g/l közötti hemoglobinszint elérése érdekében (24).
Bár a vérszegénység patogenezise CKD-ben multifaktoriális, az eritropoetin hiánya a fő oka a CKD-s betegek vérszegénységének (25). A CKD-hez társuló vérszegénységhez hozzájáruló további tényezők közé tartozik a vashiány, a gyulladásos vérszegénység, az eritropoézis szuppressziója, a vörösvértestek túlélési idejének urémiás toxinok általi lerövidülése és a vérveszteség, például a gasztrointesztinális vérzés. Mivel a vashiány a vérszegénység egyik gyakori kiváltó oka, Tajvanon már 1996-ban ösztönözték az intravénás vaspótlást. A tajvani CKD-anémia kezelésének tapasztalatai alapján a lehető legalacsonyabb ESA-dózis és intravénás vaspótlás alkalmazásával elérhető az ésszerű hemoglobin-célérték (24).
Vizsgálatunknak számos korlátja van. Először is, ez a megfigyeléses vizsgálat egyközpontú vizsgálat. Másodszor, tekintettel a lehetséges zavaró tényezőkre és az indikáció szerinti szelekciós torzításra, ezen adatok óvatos értelmezésére van szükség. Valóban, az iPTH és az ESA-k közötti összefüggésre vonatkozó megfigyeléseink további feltárást igényelnek longitudinális prospektív vizsgálatokkal. Harmadszor, az Epiao-val kezelt betegek száma túlsúlyban van (142 az Epiao esetében vs. 98 a Rocormon esetében), ami valószínűleg az Epiao viszonylag olcsó árának köszönhető a Recormonhoz képest (1. táblázat). Negyedszer, az olyan farmakológiai beavatkozások, mint a vérnyomáscsökkentők, az iPTH- vagy hemoglobinszintek átmeneti ingadozását vagy akár interferenciáját eredményezhették.
Összefoglalva, ez a vizsgálat azt mutatja, hogy a nagyobb dózisú ESA-k magasabb iPTH-szintekkel járhatnak együtt a rendszeres hemodialízisben tartott urémiás betegeknél. A nagyobb dózisú ESA-k részvétele a másodlagos hyperparathyreosis patogenezisében továbbra is tisztázatlan, és további vizsgálatokat igényelhet. Eredményeink arra utalnak, hogy a lehető legalacsonyabb ESA-dózis alkalmazásával minimalizálhatók a lehetséges kockázatok, miközben ésszerű hemoglobin-célérték érhető el.
A szerzők hozzájárulása
A kéziratot valamennyi szerző átnézte és jóváhagyta, és nem áll máshol, hasonló formában és nyelven történő publikálás alatt.
Érdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Finanszírozás
Ezt a kutatást Fujian tartomány orvosi innovációs programalapja támogatta (No. 2011027).
Rövidítések
BUN, vér karbamid nitrogén; CKD, krónikus vesebetegség; ESA, eritropoiesist stimuláló szer; Hb, hemoglobin; iPTH, intakt parathormon; Scr, szérumkreatinin.
1. Hb, hemoglobin. Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2. The Lancet (2012) 379:815-22. Martin KJ, Gonzalez EA. Metabolikus csontbetegség krónikus vesebetegségben. J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. The calcium-sensing receptor: a key factor in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Am J Physiol Renal Physiol (2005) 288:F253-64. Levin A, Thompson CR, Ethier J, Carlisle EJ, Tobe S, Mendelssohn D, et al. Left ventricular mass index increase in early renal disease: impact of decline in hemoglobin. Am J Kidney Dis (1999) 34:125-34. doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kwack C, Balakrishnan VS. Az eritropoetin hyporesponsivitás kezelése. Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gallieni M, Corsi C, Brancaccio D. Hyperparathyreosis és anaemia veseelégtelenségben. Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Red blood cell osmotic fragility in chronically hemodialyzed patients. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Baradaran A, Nasri H. A vérszegénység fokozódása a másodlagos hyperparathyreosis miatt hemodializált betegeknél. Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Med J Islam Acad Sci (2001) 14(4):161-6. Sliem H, Tawfik G, Moustafa F, Zaki H. A társuló másodlagos hyperparathyreosis és a szérum fibroblaszt növekedési faktor-23 kapcsolata végstádiumú vesebetegségben: eset-kontroll vizsgálat. Indian J Endocrinol Metab (2011) 15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Ind. Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Hyperparathyreosis, anaemia és erythropoetin: hatások a dializált betegek szisztolés funkciójára. Abstracts of 31 st Congress of European Renal Association/European dialysis ND Transplantation Association, September 5-8, 1999 Madrid. Nephrol Dial Transpl (1999) 14:190.
Google Scholar
11. Google Scholar
11. Nephrol Dial Transpl (1999) 14:190. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. A parathormon hatása az eritropoézisre. J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Eschbach JW, Abdulhadi MH, Browne JK, Delano BG, Downing MR, Egrie JC, et al. Rekombináns humán eritropoetin végstádiumú vesebetegségben szenvedő anémiás betegeknél. Egy III. fázisú multicentrikus klinikai vizsgálat eredményei. Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ann Intern Med (1989) 111(12):992-1000. Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, et al. The effects of normal as compared with low hematocrit values in cardiac disease patients who are receiving hemodialysis and epoetin. N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14. N English J Med (1998) 339:584-90. Singh AK. Tartsuk-e meg a hemoglobinszintet mint életképes kimeneti mérőszámot? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15. Phrommintikul A, Haas SJ, Elsik M, Krum H. Mortality and target haemoglobin concentration in anaemic patients with chronic kidney disease treated with erythropoietin: a meta-analysis. Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Lancet (2007) 369:381-8. Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. Az eritropoiesist stimuláló szerek (ESA) adagolásának és a hemoglobinszinteknek a változása az amerikai nem dializált krónikus vesebetegeknél 2005 és 2009 között. Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. Az eritropoiesist serkentő szerek beadásából eredő magas hematokrit nem jelzi előre teljes mértékben a mortalitást vagy a toxicitásokat preklinikai fajokban. Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Toxicol Pathol (2014) 42:510-23. Vesebetegség: KDIGO (KDIGO) CKD-MBD munkacsoport. KDIGO klinikai gyakorlati útmutató a krónikus vesebetegség – ásványi anyagokkal és csontokkal kapcsolatos rendellenességek (CKD-MBD) diagnózisához, értékeléséhez, megelőzéséhez és kezeléséhez. Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19. Kidney Int Suppl (2009) 113:S1-130. dok. Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Am J Kidney Dis (2008) 52(3):519-30. Nemzeti Vese Alapítvány. K/DOQI klinikai gyakorlati útmutató a krónikus vesebetegséghez: értékelés, osztályozás és rétegzés. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21. Google Scholar
. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Am J Kidney Dis (2004) 44(1):94-111. Vesebetegség: KDIGO (Improving Global Outcomes) anaemia munkacsoport. KDIGO klinikai gyakorlati útmutató a krónikus vesebetegségben jelentkező vérszegénységről. Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23. Kidney Int Suppl (2012) 2:279-335. Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Treatment with high dose of erythropoiesis-stimulating agents and mortality: analysis with a sequential Cox approach and a marginal structural model. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. Anaemia kezelése krónikus vesebetegségben szenvedő betegeknél: Tajvani gyakorlati irányelvek. Nephrology (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. 25. Nephrology (Carlton) (2014) 19:735-9. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. A rekombináns kutyai eritropoetin klinikai hatékonysága és biztonságossága krónikus veseelégtelenséggel járó vérszegénységben szenvedő kutyákban és rekombináns humán eritropoetin okozta vörösvérsejt apláziában szenvedő kutyákban. J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar