Although dengue was once a periodic disease that caused long-interval epidemies, today is considered it is considered the most important mosquito-borne viral disease in the world . Évente körülbelül ötven-százmillió dengue-lázas esetet regisztrálnak világszerte . Ezek közül félmillió esetben alakul ki a dengue-láz (DF) legsúlyosabb formája, a dengue vérzéses láz (DHF) . A DHF olyan betegség, amely túlnyomórészt 15 év alatti gyermekeket érint, és amelyet hirtelen fellépő láz, trombocitopénia és érszivárgási szindróma jellemez . A DHF a Flaviviridae családba tartozó dengue-vírus fertőzése következtében alakul ki . A vírus ikozaéderes, burkolt, egyszálú, pozitív szenzusú RNS . Az ikozaéder mag átmérője negyven-ötven nanométer, és a vírus genomját beburkoló C fehérjét tartalmazza . A magot két vírusfehérje, az M és az E veszi körül, amelyek a lipidburkot alkotják . A fertőzést a dengue-vírus (DENV) négy szerotípusának egyike okozza: DENV-1, DENV-2, DENV-3 és DENV-4 . Az egyik szerotípussal való fertőzés nem biztosít immunitást a többi szerotípussal való fertőzéssel szemben .
Ha valaki, aki korábban már megfertőződött, újra megfertőződik, megnő a kockázata a dengue-sokk szindróma (DSS) és a DHF kialakulásának, ami az érrendszer elgyengülésével és megrepedésével, valamint belső vérzéssel jár . A nem semlegesítő antitestek fokozhatják a vírus felvételét az Fc-receptorokat expresszáló sejtekbe, így lehetővé válik a DHF antitest-függő fokozódása . Az Aedesmoszkitók különböző fajai a dengue-vírus vektorai, és a vírust az emberi gazdatest megcsípésével terjesztik . Az Aedes aegypti; egy kicsi, fekete-fehér, trópusi és szubtrópusi szúnyog, amely Közép-Amerikában, Latin-Amerikában, Délkelet-Ázsiában és a Csendes-óceán nyugati részén található, a fő vektor .
Epidemiológia
Ma a DHF-et nemzetközileg a legjelentősebb szúnyogok által terjesztett vírusos betegségnek tekintik. Világszerte több mint 100 országban endémiás, különösen a trópusi és szubtrópusi régiókban . Az Egyesült Államokban a DHF-et okozó Aedes aegyptispecies szezonálisan megtalálható Louisiana, Florida déli része, Új-Mexikó, Arizona, Texas, Georgia, Alabama, Mississippi, Észak- és Dél-Karolina, Kentucky, Oklahoma és Tennessee államokban . Az elmúlt 50 évben a dengue előfordulása 30-szorosára nőtt .
Az Egészségügyi Világszervezet (WHO) becslései szerint évente 50-100 millió dengue-lázas fertőzés fordul elő. Ezek közül 500 000 esetben alakul ki DHF, ami 22 000 halálesetet okoz, főként gyermekek körében . A WHO-hoz benyújtott hivatalos adatok alapján az amerikai kontinensen, Délkelet-Ázsiában és a Csendes-óceán nyugati részén a dengue-fertőzés 2008-ban meghaladta az 1,2 milliót, 2013-ban pedig a 3 milliót. 2013-ban csak az amerikai kontinensen 2,35 millió dengue megbetegedést jelentettek, ebből 37 687 esetben volt DHF . A DHF első ismert járványa után 1953 és 1954 között a Fülöp-szigeteken a betegség tovább terjedt egész Délkelet-Ázsiában .
Az 1950-es, 1960-as években és az 1970-es évek nagy részében Dél- és Közép-Amerika nagy részén ritka volt a dengue-járvány, mivel az elsődleges szúnyogvektort, az Aedes aegypti-t kiirtották. Amint azonban a kiirtást leállították, az Aedes aegypti újra elkezdett betelepülni ezekbe a régiókba. 1997-ben az Aedes aegyptiés a dengue vírus ismét világszerte elterjedt (1,2. ábra).A WHO szerint jelenleg több mint 2,5 milliárd ember él olyan területeken, ahol a dengue/DHF endémiás, és akiket a dengue vírussal való megfertőződés veszélye fenyeget. Számos tényező járul hozzá a vírus Aedes aegypti általi terjedéséhez; többek között a hőmérséklet, az esőzés, a vidékről városba irányuló migráció, a népességnövekedés, a tárolt víz, a szilárd hulladékok növekedése, ami lehetővé teszi a lárvák élőhelyét a vektor számára. Előfordulhatnak utazással összefüggő DHF-járványok is. A dengue-láz a világszerte legelterjedtebb arbovírus-fertőzés .
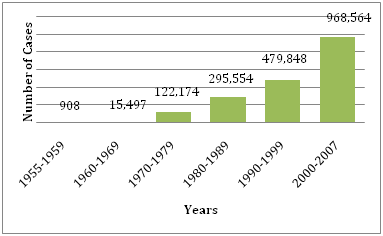
1. ábra: A WHO-nak bejelentett DF/DHF átlagos száma a megadott években .
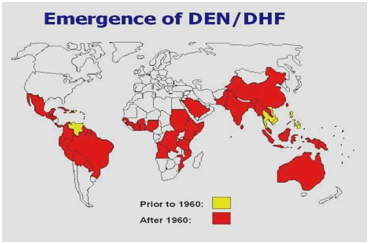
2. ábra: A dengue/dengue vérzéses láz elterjedése Amerikában, a Karib-térségben, Afrikában és a Közel-Keleten.
A DF és a dengue vírus terjedésének kockázati tényezői
A dengue láz fontos ízeltlábúak által terjesztett vírusos betegség . A kutatások azt mutatják, hogy az Aedes nemzetség, elsősorban az Aedes aegypti és az Aedes albopictus szúnyogok alkalmazkodtak az emberi lakott területek közelében való élethez, és felelősek a dengue-láz terjedéséért. A szúnyogok napközben táplálkoznak, és az embereket más állatokkal szemben előnyben részesítik. Az Aedes aegypti szúnyogok táplálkoznak a legnagyobb arányban, 76,9%-ban emberrel, majd az Aedes albopictus és az Aedes vittatus szúnyogok következnek 75%-kal, illetve 33,3%-kal. A DF előfordulását összefüggésbe hozták a növényzet mennyiségével, a fákkal való borítottsággal, a lakások minőségével és a környező földterülettel .
Az ember által létrehozott tenyészhelyekkel együtt az éghajlat is bizonyítottan befolyásolja a dengue ökológiáját a vektorok dinamikájának, a kórokozók fejlődésének és a szúnyog-ember interakciónak a befolyásolásával.13 A hőmérséklet segít befolyásolni a vektorok fejlődési ütemét, a mortalitást, a viselkedést, és szabályozza a vírus replikációját a vektoron belül. A meleg éghajlat lehetővé teszi a lárvák fejlődését és a vírus replikációjának nagyobb sebességét, míg a hideg éghajlat lelassítja a vírus fejlődését és csökkenti a szúnyogok túlélési idejét, ezáltal csökkentve a fertőző vektor lehetőségét és csökkentve a dengue-láz terjedését . A hőmérséklet is kölcsönhatásban van a csapadékkal, mint a párolgás fő szabályozója, ezáltal közvetlenül befolyásolja a vizes élőhelyek elérhetőségét, és közvetve befolyásolja a talajborítást és a földhasználatot, ami elősegítheti vagy akadályozhatja a vektorpopulációk növekedését .
A demográfiai és társadalmi változások, mint a népességnövekedés, az urbanizáció és a modern közlekedés nagyban hozzájárulnak a dengue aktivitás gyakoriságának növekedéséhez és földrajzi terjedéséhez . Ahogy az utazók az endémiás területekről elköltöznek, hajlamosak a további terjedés hordozóiként szolgálni . A vírustörzs virulenciája és a dengue-vírus genetikai variációja szintén hozzájárul a DHF nagyobb járványos terjedési potenciáljához .
A dengue vérzéses láz patogenezise
Amint a szúnyog az emberi gazdaszervezeten táplálkozik, a dengue vírust (DENV) a véráramba és a környező hámba és bőrbe juttatja. Ez az éretlen Langerhans-sejtek és keratinociták fertőzését eredményezi receptor-közvetített endocitózison keresztül . Az E fehérje, a felszíni fehérje átkonfigurálódik, és lehetővé teszi a membránfúziót és a vírus RNS felszabadulását a fertőzött sejtbe. A nem strukturális fehérjék, az NS1 és az NS2A szabályozzák a vírus RNS replikációját, és az NS1 szerepet játszhat a komplement kaszkád aktiválásában is. A fertőzött sejtek ezután apoptózis vagy nekrózis útján elpusztulhatnak, vagy a nyirokcsomókba vándorolhatnak, ahol makrofágok toborzódnak (3. ábra). A dengue négy szerotípusának (DENV-1-től DENV-4-ig) bármelyike által okozott fertőzés az esetek többségében tünetmentes lehet, mivel a gazdaszervezet immunrendszere képes azt helyileg semlegesíteni, de a klinikai tünetek széles skáláját is okozhatja, amelynek legsúlyosabb formája a DHF, amely DSS-hez és halálhoz vezethet. A DHF klinikai meghatározása: 2-7 napig tartó folyamatos láz, nyálkahártya- vagy bőrvérzéses manifesztációval, amelyhez trombocitopénia (<100 000 sejt/mm3) és a beteg vagy az azonos korú populáció alapszintje felett 20%-nál nagyobb hematokrit társul . A DHF patológiai jellemzői a pleurális vagy peritoneális felületekről történő plazmaszivárgás és az intrinsic koagulopátia, amelyet klinikailag vagy pozitív tourniquet teszt, vagy spontán vérzés, például petechiák vagy ekchimózisok, ínyvérzés vagy epistaxis, vagy gasztrointesztinális vérzés bizonyítékai alapján mérnek .

3. ábra: A hordozó Aedes aegypti szúnyog csípése után az éretlen Langerhans-sejtek és keratinociták DENV-vel fertőződnek. A fertőzött sejtek ezután lefelé vándorolnak a nyirokba, ahol makrofágok toborzódnak . Innen a fertőzés különböző szervekbe, többek között a májba, a lépbe és a csontvelőbe terjed. A csontvelő DENV által okozott nekrózisa a vérképzés elnyomásához és a vérben a trombogenezis csökkenéséhez vezethet . A hízósejtek, makrofágok és limfociták kemokin és citokin felszabadulása által okozott gyulladásos válasz fokozott éráteresztő képességet, vérlemezke diszfunkciót, trombocitopéniát és plazmaszivárgást okoz . Bár a mechanizmus nem jól ismert, úgy tűnik, hogy ez a kaszkád spontán vérzést is okoz, ami a petechiák, ínyvérzés és gyomor-bélrendszeri vérzés klinikai tüneteihez vezet .
A betegségnek ez a súlyos formája gyakran másodlagos fertőzés eredménye, amikor a gazdaszervezet egy második szerotípussal fertőződik, és a vírus és a gazdaszervezet immunválasza közötti összetett kölcsönhatás következik be . Bár az ezt a reakciót kiváltó mechanizmus nem jól ismert, bizonyítékok arra utalnak, hogy a korábbi fertőzés keresztreaktív antitesteket hozhat létre, amelyek megkötik az új szerotípust, de nem képesek semlegesíteni azt . Ezt nevezik antitest-függő fokozás (ADE) elméletnek . Úgy gondolják, hogy a korábbi fertőzések során a DENV strukturális fehérjéi, például az E fehérje vagy a prM ellen képződött antitestek nem képesek semlegesíteni az új kórokozót, és ehelyett az Fcγ receptor-pozitív sejtekhez való fokozott kötődéshez vezetnek, ami lehetővé teszi a vírus felerősített szaporodását . Válaszul az immunrendszer eltúlzott citokinválaszt szabadít fel, ami fokozott érpermeabilitáshoz és koagulopátiához vezet .
A maszt sejteket is bevonták a DHF patogenezisébe. Bizonyos esetekben úgy tűnik, hogy a hízósejtek védőfunkciót látnak el, ahol a de granuláció során vírusellenes molekulák szabadulnak fel, és más immunsejtek, például T-limfociták és természetes ölősejtek (NK) toborzódnak, amelyek mind segítenek a vírus semlegesítésében . Más esetekben azonban a helyi ellenőrzési mechanizmusok nem tudják megfékezni a vírust, és az a véráramban vagy a nyirokrendszeren keresztül más szervek, például a máj, a lép és a nyirokcsomók hízósejtjeit aktiválja. Amikor ezekben a szervekben de granuláció lép fel, proteázok szabadulnak fel, és gyulladásos mediátorok, például leukotriének és vaszkuláris endoteliális növekedési faktor (VEGF) szintetizálódnak, ami növeli a kapillárisok áteresztőképességét, és plazmaszivárgáshoz vezet . Ez azért fontos, mert a hízósejtek különböző csoportjai különböző mediátorokat szabadítanak fel a de granulációs folyamat során . A vírus-antitest-komplex, talán a dengue-vírus NS1 antigénjén keresztül, és a citokintermelés szintén komplementaktivációt eredményez. A felszabaduló C3a és C5a fragmentumokról ismert, hogy növelik az érpermeabilitást, és így hozzájárulnak a plazmaszivárgáshoz .
A felszabaduló citokinek típusa és mennyisége fontos szerepet játszik a betegség súlyosságának diktálásában. A makrofág gyulladásos fehérje 1β (MIP-1β) a jelek szerint a kevésbé súlyos betegség indikátora, mivel a fertőzött mononukleáris sejtek és az aktivált NK-sejtek szabadítják fel. Vegyi vonzerőként hat több NK-sejt számára, a gyulladásos helyre csalogatva őket, korlátozva a vírusszaporodást és a downstream citokinhatást. Az interferon γ (IFN-γ),másrészről, kimutatták, hogy plazmaszivárgást indukál és növeli a dengue-részecskék felvételét a célsejtek Fc-receptorainak növelésén keresztül, és ezért súlyosabb klinikai manifesztációkkal és rossz prognózissal jár . A DHF-ben megnövekedettnek talált egyéb citokinek, amelyek a plazmaszivárgás kiváltásában szerepet játszanak, többek között az interleukin 2 (IL-2), az α tumor nekrózis faktor (TNF- α), a makrofág migrációt gátló faktor (MIF), a monocita kemotaktikus protein-1 (MCP-1), az interleukin-8 (IL-8) és a nagy mobilitású csoportbox-1 (HMGB-1) . A citokinfelszabadulás hatása nem korlátozódik az érrendszeri permeabilitásra és a plazmaszivárgásra, hanem a DHF vérzéses megnyilvánulásaiban is szerepet játszik. A DHF-ben vérzést okozó mögöttes mechanizmus azonban kevéssé ismert. Bár a legtöbb fertőzött sejt apoptózis útján elpusztul, némi nekrózis mégis bekövetkezik, ami toxinok felszabadulását eredményezi, amelyek aktiválják a koagulációs és fibrinolízis rendszert. Ha a csontvelőben a magas vírusterhelés miatt nagyfokú nekrózis lép fel, a vérképzés elnyomottá válik, ami trombolízispeniát eredményez . A trombogenezis ebből eredő csökkenése és a vérlemezkék diszfunkciója okozhatja a kapillárisok törékenységét és a DHF-ben megfigyelhető klinikai manifesztációkat . Egyes tanulmányok szerint a máj DENV-fertőzésben való érintettsége szerepet játszhat a spontán vérzési hajlamban, az emelkedett májenzimszintek és a vérzésre való fokozott hajlam között összefüggés van .
Klinikai tünetek
A betegség klinikai manifesztációja magában foglalja a tünetmentes fertőzést, az enyhe dengue-lázat (DF), a dengue vérzéses lázat (DHF) vagy a dengue-sokk szindrómát (DSS), amely gyakran súlyos a kóros kapilláris permeabilitás és a plazmaszivárgás miatt . A súlyos dengue általában olyan betegeknél fordul elő, akik korábban már megfertőződtek dengue-vírussal (azaz másodlagos fertőzés). A súlyos dengue-fertőzés magas arányáról számoltak be olyan primer dengue-vírusfertőzésben szenvedő csecsemők esetében is, akiket korábban dengue-vírussal fertőzött anyák hoztak világra .
A DHF kezdeti fázisa dengue-lázként jelentkezik. Ennek a kezdeti fázisnak a tünetei a beteg életkorától függnek, és hirtelen magas láz (néha két 2 csúcs-nyerges háttal), súlyos fejfájás, csökkent étvágy, súlyos myalgia és arthralgia, makulopapulózus bőrkiütés, amely három-négy nappal a láz kezdeti megjelenése után jelenik meg, retro-orbitális fájdalom, fotofóbia, nyirokcsomó-érzés, enyhe vérzés (epistaxis, ínyvérzés, gyomor-bélrendszeri vérzés, haematuria és menorrhagia), és pozitív tourniquet teszt . A DHF-esetekre négy fő klinikai tünet jellemző, amelyek a magas láz, a vérzéses jelenségek és gyakran a hepatomegália és a keringési elégtelenség. A kezdeti fázisra jellemző akut lázas megbetegedés 39 °C-nál magasabb hőmérsékletet jelent, és 2-7 napig tart.
A kezdeti fázis fent említett tünetei fokozatosan súlyosbodnak, folyamatos lázzal és fejfájással, erős hasi fájdalommal vagy érzékenységgel, tartós hányással, hematemezissel, melénával, petechiával, könnyű véraláfutással, nyugtalansággal, letargiával, álmossággal, ingerlékenységgel, bőr alatti vérzéssel vagy véraláfutással . A 2-7 napos láz után a hőmérséklet gyors csökkenését gyakran a keringési zavarok különböző súlyosságú jelei kísérik. A beteg izzadhat, nyugtalan lehet, és a végtagjai hűvösek lehetnek, valamint a pulzusszám és a vérnyomás változásait mutathatja. A DHF specifikus jellemzői, a kóros vérzéscsillapítás és a vérplazmaszivárgás 24-48 óra elteltével megfigyelhetőek, mint a jellemző tünetek.
Ezeknek a fejleményeknek jó jelzője a máj 2 cm-nél nagyobb megnagyobbodása, mivel a hepatomegália általában megelőzi a plazmaszivárgást . Sok beteg felépül folyadék- és elektrolitkezeléssel vagy anélkül. Súlyos esetekben a plazmavesztés kezeletlenül sokkhoz és halálhoz vezethet . A kutatások azt sugallják, hogy mind a dengue másodlagos fertőzése, mind a citokin immunrendszeri válasz túlzó megtorlása növeli a beteg hajlamát a DHF kialakulására.
Az NS1 glikoproteinhez hasonló vírustermékekről úgy vélik, hogy befolyásolják a komplement aktiválódását és az érrendszeri permeabilitást, ami plazmaszivárgást eredményez, amely aszcitesz vagy pleurális folyadékgyülemekké alakul . A citokin válasz szintén felelős a vaszkuláris permeabilitás növekedéséért, aminek következtében csökken az intravaszkuláris onkotikus nyomás és elősegíti a folyadékveszteséget az extra vaszkuláris kompartmentumokba , (4. ábra). A kóros hemosztázis trombocitopéniából áll, amely a hematokrit emelkedésével jár együtt , meghosszabbodott parciális tromboplasztin idő és csökkent fibrinogén koncentráció, valamint a korábban említett petechiák, súlyos gasztrointesztinális vérzések, ekchimózis és epistaxis .
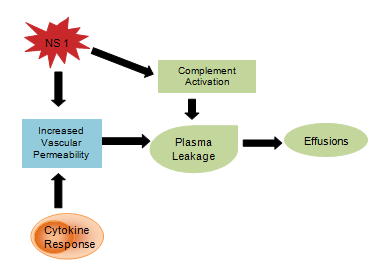
4. ábra: A citokin immunrendszer válasza.
A DHF lázas viremiás fázisában a trombocitopénia és az azt követő manifesztációk feltehetően a csontvelő szuppressziója miatt alakulnak ki. Mint korábban említettük, a csontvelő szuppressziója annak a következménye, hogy az a vírus szaporodási helye, és kifejezetten a vérképző progenitor sejteket támadja , A trombociták immunmediált pusztulását azonban a DHF betegek trombocita felszínén talált vírus-antitest komplexek felfedezése is sugallta.
A nem gyakori klinikai manifesztációk közé tartozik az akut hepatitis, a májelégtelenség, az akut veseelégtelenség, az encephalopathia vagy a cardiomyopathia (akut myocarditis) . A felnőttek halálos kimenetelű DHF-ről szóló tanulmány a Dengue-sokk szindrómától (DSS) eltérő halálozási okokat vizsgált súlyos dengue-betegeknél, és arra a következtetésre jutott, hogy a hipotermia, a leukocitózis és a bandémia a súlyos dengue kiváltó jelei lehetnek. A tanulmány továbbá azt tanácsolja a klinikusoknak, hogy legyenek tudatában a masszív GI-vérzés lehetséges kialakulásának, különösen a korai eszméletváltozással, mély trombocitopéniával, elhúzódó PT-vel és/vagy leukocitózissal rendelkező betegeknél.
Diagnózis, kezelés és menedzsment
A megfelelő klinikai ellátás szempontjából kritikus fontosságú a korai és pontos diagnózis. A dengue diagnózisa többféle módszerrel is felállítható. A diagnózis a vírus izolálásával, a vírusnukleinsav, az antitestek és antigének, vagy mindezen technikák kombinációjával állítható fel. A dengue-vírus tenyésztéssel történő kimutatása a végleges diagnosztikai teszt, de gyakorlati megfontolások korlátozzák a használatát. A vírus RNS kimutatása gyorsabb, de a szennyeződés hamis pozitív eredményhez vezethet. A szerológiai vizsgálat is hamis pozitív eredményt adhat a keresztreaktív antitestek miatt.
Az akut fertőzéseket a szérumban, a plazmában és a keringő vérsejtekben a korai lábadozó fázisban, azaz a tüneteket követő első 5-8 napban lehet kimutatni. Ebben az időszakban az elsődleges vírusterhelés elérheti a103 RNS-részecske/ml értéket, illetve a másodlagos fertőzéseknél meghaladhatja a 106 RNS-részecske/ml értéket . Jelenleg az NS1 antigén és az antitest tesztek kombinációját, valamint a molekuláris módszereket, például a valós idejű reverz transzkripciós-polimeráz láncreakciót (RT-PCR), egyre gyakrabban használják a diagnózis felállítására, mivel ezek gyorsabb eredményt adnak és érzékenyebbek lehetnek. Az immunhisztokémiai elemzés és az immunfluoreszcencia szintén megerősíti a vírus jelenlétét a vírusantigéneken keresztül. Az IgM antitestek a fertőzést követő 3-5 napon belül jelennek meg először .
A tünetek megjelenése után 2 héttel elérik a csúcsszintet, majd 30-60 nap elteltével általában kimutathatatlan szintre csökkennek . Az IgG antitestek, amelyek keresztreaktívabbak, a tünetek kezdeti 7-9 napja után alacsony szinten kimutathatók, lassan növekednek, akár a négyszeresére is, és több hónap, esetleg élethossziglan is kimutathatók maradnak . A humán antigén- és antitestválasz a gazdaszervezet immunstátuszától függ, és csak az elsődleges vagy másodlagos fertőzés során van jelen. A dengue-re nincsenek specifikus kezelések vagy vírusellenes gyógyszerek. A dengue patofiziológiája növeli az érrendszeri permeabilitást, ami jelentős plazmaveszteséget eredményez az intravaszkuláris rekeszből az extravaszkuláris térbe.
Ez a folyadékveszteség sokkhoz vezethet, és megfelelő korrekció nélkül hipoxiához, metabolikus acidózishoz és végül halálhoz vezet. Ezért az elsődleges kezelés a folyadék- és elektrolitegyensúlyt biztosító fekvőbeteg szupportív ellátást igényel. A csomagolt sejttérfogatot 4-6 óránként óránként ellenőrizni kell. Jelentős plazmavesztésnek minősül a csomagolt sejttérfogat vagy a hematokrit >20%-os növekedése. Ha a beteg eléri ezeket a szinteket, gyors és agresszív térfogatpótlásra van szükség.
Az infúziós folyadékpótlás mértéke a csomagolt sejttérfogattól és a vizeletürítéstől függ. A plazmaveszteség pótlására többféle folyadékot használnak, köztük fiziológiás sóoldatot, Ringer-laktátot vagy Ringer-acetátot, hígított 5%-os glükózoldatot, plazmát vagy plazmapótlót, például 40-es dextrint és friss teljes vért . Az intravénás folyadékpótlás mellett az elektrolitok szájon át is beadhatók, mivel ez enyhíti a szomjúság és a láz okozta dehidratáció egy részét. Támogató fájdalomcsillapítók, mint például paracetamol, használhatók a láz és egyéb tünetek kezelésére. A NSAID-okat és az aszpirint kerülni kell, mivel ezek Reye-szindrómát idézhetnek elő.
A DHF betegeknek a kórházi elbocsátás előtt a következő kritériumoknak kell megfelelniük: látható klinikai javulás, lázcsillapítók használata nélkül lázmentes >24 órán keresztül, fokozott étvágy, stabil hematokrit, megfelelő vizeletürítés, három nappal a súlyos metabolikus acidózisból való felépülés után, vérlemezkeszám >50.000/mm3, és nincs pleurális folyadékgyülem vagy ascites okozta légzési nehézség .
Aedes aegypti megelőzése és felszámolása
A dengue-vírus legelterjedtebb vektora, az aedes aegypti a felügyeleti és ellenőrzési tevékenységek fő célpontja. Más vektorok, például az Aedes albopictus is okozhatnak dengue-lázat, de a különböző vektorokra vonatkozó felügyeleti és ellenőrzési tevékenységeket csak akkor kell megfontolni, ha megbízható bizonyíték van arra, hogy ezek a vektorok járványügyi szempontból jelentős szerepet játszanak a dengue-fertőzések átvitelében . Az Aedes aegypti kiirtására irányuló első kezdeményezés 1901-ben Kubában történt. A fertőtlenítés és a szúnyogtelepek felszámolása elhagyott konténerek megsemmisítésével a vektor felszámolásának első lépései voltak. Miután Brazíliában 1928-ban és 1932-ben sárgaláz kitört, nyilvánvalóvá vált, hogy a városi lakosság teljes védelme az Aedes aegypti szúnyog teljes kiirtásától függ; ez vezetett ahhoz, hogy a Pánamerikai Egészségügyi Szervezet (PAHO) 1947-ben jóváhagyta a kontinentális Aedes aegypti kiirtási tervet a városi sárgaláz elleni küzdelem érdekében. 1947 óta a Pánamerikai Egészségügyi Hivatal (PASB) intenzíven támogatta a kampányokat az összes érintett országban, és sikerük 1962-re bebizonyosodott, amikor 18 kontinentális ország és számos karibi sziget elérte a felszámolást. Ezen erőfeszítések eredményeként az amerikai DENV-2 V genotípusa az egyetlen dengue vírus, amely ma még létezik.
A vektor felszámolására tett erőfeszítések ellenére az Aedes aegypti-t nem sikerült kiirtani Kubában, az Egyesült Államokban, Venezuelában és számos karibi országban . Az Aedes aegypti kiirtására tett évtizedes, példátlan emberi erőfeszítések nagyon gyorsan és gyorsan szétfoszlottak és fertőzéshez vezettek. A felügyelet hiánya és a felszámolási program struktúrájának romlása, az elégtelen környezeti higiénia és az elégtelen közösségi részvétel voltak azok a tényezők, amelyek a vektor felszámolására irányuló erőfeszítések visszaeséséhez vezettek . A mai napig nem áll rendelkezésre vakcina a dengue-fertőzések megelőzésére . A Takeda Vaccines Inc. egy élő, attenuált vakcina-jelöltet fejleszt tetravalens dengue-vakcina (TDV) néven, amely egy attenuált DENV-2 törzsből (TDV-2) és három olyan kiméra vírusból áll, amely a DENV-1, -3 és -4 prM és E fehérje génjeit tartalmazza, amelyeket az attenuált TDV-2 genomgerinccel összefüggésben expresszáltak (TDV-1, TDV-3, illetve TDV-4). A vakcina jól tolerálhatónak és immunogénnek bizonyult egy 2. fázisú klinikai vizsgálatban, amelyet dengue-endémiás országokban végeztek felnőttek és gyermekek körében.
A vakcina a fejlesztés 3. fázisában van. Ezenkívül a Sanofi Pasteur kifejlesztett egy rekombináns, élő hígított, tetravalens dengue vakcinát (CYD-TDV), amely endémiás országokban ≥9 éves egyéneknél konzisztens biztonságosságot és hatékonyságot mutatott; a fejlesztés késői szakaszában van . A Sanofi Pasteur által gyártott Dengvaxia (CYD-TDV) 2015 decemberében került először törzskönyvezésre Mexikóban, és a III. fázisú klinikai vizsgálatokban 3 dózisos sorozatban, 0/6/12 hónapos ütemezésben értékelték . A klinikai vizsgálatokban körülbelül öt további vakcinajelölt van értékelés alatt . A dengue-endémiás területekre utazók ki vannak téve a dengue-fertőzés kockázatának; ezért a megelőzés érdekében arra kell ösztönözni őket, hogy jól védett ablakokkal és ajtókkal rendelkező szálláshelyeket válasszanak, használjanak rovarriasztót, viseljenek megfelelő ruházatot, és ürítsenek ki és fedjenek le minden olyan állóvizet, amely esetleg szúnyogok tenyészhelyévé válhat .
A jelenlegi globális helyzet
A jelenlegi várakozások szerint a dengue előfordulása tovább fog nőni számos tényező miatt, beleértve a társadalmi-gazdasági helyzetet, a folyamatos klímaváltozást, az utazásokat és a globalizációt. A védőoltások még fejlesztés alatt állnak, és jelenleg nem létezik specifikus vírusellenes terápia a dengue növekvő veszélyének kezelésére . A dengue előfordulásának globális becsült száma 50 és 200 millió között van. A kartográfiai megközelítések alkalmazása azonban a közelmúltban azt sugallja, hogy az előfordulási szám közelebb van a 400 millióhoz . A WHO 2012-ben a dengue-t a szúnyogok által terjesztett vírusos betegségek közé sorolta . Ezt a besorolást a vírusnak és vektorának jelentős földrajzi terjedése indokolja olyan területekre, amelyek korábban nem voltak érintettek (5. ábra).
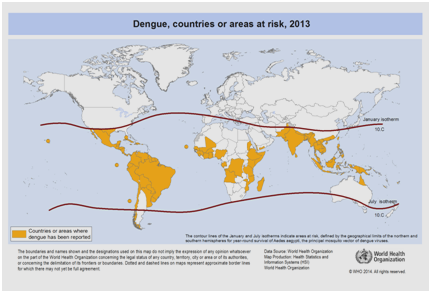
5. ábra: A világ azon országai vagy területei, ahol 2013-ban dengue-t jelentettek az Egészségügyi Világszervezet által gyűjtött adatok szerint .
Azt a költség is alátámasztja, amelyet a betegség magával hoz. Összehasonlítva a dengue és más fertőző betegségek terhét az érintett régióban, a dengue sokkal több emberi szenvedést okoz és nagyobb terhet jelent, mint a többi vektor által terjesztett betegség . A WHO szerint Délkelet-Ázsiában a dengue a gyermekek kórházi kezelésének és halálozásának vezető oka . Hammond et al. tanulmánya arról számolt be, hogy a betegséggel kapcsolatos megbetegedések és halálozások többsége inkább a gyermekeket érinti, mint bármely más korcsoportot. A 4-9 hónapos korú csecsemők és az 5-9 éves korú gyermekek viselik a legnagyobb terhet a dengue megbetegedésben (6. ábra). A betegség súlyossága ezeknél a gyermekeknél gyakran a másodlagos DENV-fertőzésnek köszönhető. Egy Dıaz-Quijano és Waldman által Latin-Amerikában és a Karib-térségben végzett ökológiai tanulmány megállapította, hogy a dengue halálozási arány meghatározó tényezői közé tartozik az elismert endémiásság hossza, a népsűrűség és az esőzés .
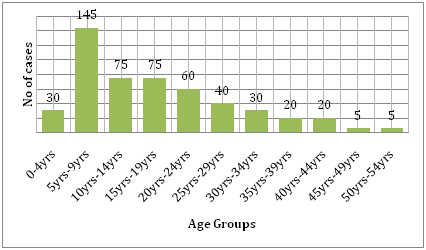
6. ábra: A Leónban vizsgált kohorsz korcsoportonkénti megoszlása .
A megbetegedések és a halálozás hatásán túlmenően a dengue-vírus nagy pénzügyi terhet ró az érintett régiókra, amelyek közül sokan rosszul vannak felkészülve e költségek viselésére. 2010-ben a dengue-vírus pénzügyi terheit átlagosan évi 2,1 milliárd dollárra becsülték az amerikai kontinensen (2010-es amerikai dollárban), az érzékenységi elemzések szerint 1-4 milliárd dolláros tartományban, és jelentős éves eltérésekkel . A WHO szerint a dengue ma már világszerte aggodalomra ad okot, és az ázsiai-csendes-óceáni térségben él a legtöbb (75%) dengue-vírusnak kitett ember a világon. Az elmúlt évtizedben a Csendes-óceán nyugati részén is folyamatosan nőtt a bejelentett DF-esetek száma .
Még ha a 20. század közepén nem is terjedt el a DF, mostanra az amerikai kontinensen megnőtt az őshonos DF endémiája. Csak az amerikai kontinensen 2010-ben több mint 1,6 millió dengue esetet jelentettek, és ebből 49 000 súlyos dengue volt . Afrikában a DF kitörései egyre nagyobbak és gyakoribbak, de nem jelentik őket következetesen a WHO-nak. A rendelkezésre álló kitörési adatok alapján 1960 és 2010 között 22 afrikai ország jelentett szórványos eseteket. Európában az 1928-as görögországi kitörés óta nem jelentettek DF-járványt. Most Európában a járvány kitörésének veszélye fenyeget, amelyet az Aedes albopictusnak tulajdonítanak a betegséget endémiásan előforduló országokból való utazás miatt. A becslések szerint az elkövetkező években a betegség előfordulása növekedni fog a multifaktoriális kockázati tényezők miatt .
.