A rák a sejteket szabályozó kontrollok összeomlásának eredménye. Az összeomlás okai közé mindig a fontos génekben bekövetkező változások tartoznak. Ezek a változások gyakran mutációk, a kromoszómák DNS-szekvenciájának változásai. A mutációk lehetnek nagyon kis változások, amelyek csak néhány nukleotidot érintenek, vagy lehetnek nagyon nagyok, amelyek a kromoszómák szerkezetében jelentős változásokat eredményeznek.
A kis és nagy mutációk egyaránt befolyásolhatják a sejtek viselkedését. A fontos gének mutációinak kombinációi rák kialakulásához vezethetnek. Az ezen az oldalon tárgyalt anyag ismerteti a mutáció és a rák közötti kapcsolatot, a különböző mutációkat és azok okait. Az ezen az oldalon szereplő témákkal kapcsolatos további információk a legtöbb bevezető biológia tankönyvben is megtalálhatók, mi a Campbell Biology, 11. kiadást ajánljuk.1
Témák ezen az oldalon:
- Mutáció és rák
- Öröklött mutációk és rák
- A mutáció típusai
- Pontmutációk
- Transzlokációk
- Génamplifikáció
- Inverziók, Deléciók és duplikációk
- Aneuploidia
- Epigenetikai változások
- Mutáció okai
- Mutáció összefoglalása
- Tudjuk a folyamatot: Mutáció
Mutáció és rák
A rákos sejtek által tanúsított rendellenes viselkedés a kulcsfontosságú szabályozó génekben bekövetkezett mutációk sorozatának eredménye. A sejtek egyre abnormálisabbá válnak, ahogy egyre több gén károsodik. Gyakran a DNS-javítást irányító gének maguk is károsodnak, így a sejtek még fogékonyabbá válnak az egyre növekvő mértékű genetikai zűrzavarra.
Az alábbi animáció a kromoszómák, a gének és a DNS közötti kapcsolatot mutatja be.
A legtöbb rákos megbetegedés feltehetően egyetlen mutáns elősejtből ered. Ahogy ez a sejt osztódik, a keletkező “leánysejtek” egy idő után különböző mutációkat és eltérő viselkedést kaphatnak. Azok a sejtek, amelyek előnyre tesznek szert az osztódásban vagy a sejthalállal szembeni ellenálló képességben, hajlamosak átvenni az uralmat a populáció felett. Ily módon a tumorsejtek képesek olyan képességek széles skálájára szert tenni, amelyek a képviselt sejttípus egészséges változatában normális esetben nem fordulnak elő. A rákos sejtekben megfigyelhető viselkedésbeli változások állnak a honlap Rákbiológia részének középpontjában.
A kulcsfontosságú szabályozó gének (tumorszupresszorok és proto-onkogének) mutációi megváltoztatják a sejtek viselkedését, és potenciálisan a rákban megfigyelhető szabályozatlan növekedéshez vezethetnek.
Az eddig vizsgált szinte valamennyi ráktípus esetében úgy tűnik, hogy a normál, egészséges sejtből a rákos sejtbe való átmenet egy fokozatos fejlődés, amely számos genetikai változást igényel, amelyek együttesen hozzák létre a rákos sejtet. Ezek a mutációk mind az onkogéneken, mind a tumorszupresszorokon előfordulnak. Ez az egyik oka annak, hogy a rák sokkal gyakoribb az idősebb egyéneknél. Ahhoz, hogy egy rákos sejt létrejöjjön, mutációk sorozatának kell bekövetkeznie ugyanabban a sejtben. Mivel annak a valószínűsége, hogy bármelyik gén mutálódjon, nagyon kicsi, érthető, hogy annak az esélye, hogy több különböző mutáció forduljon elő ugyanabban a sejtben, valóban nagyon valószínűtlen. Emiatt egy 70 éves szervezet sejtjeinek több ideje volt arra, hogy felhalmozzák a rákos sejtek kialakulásához szükséges változásokat, de egy gyermek sejtjei sokkal kisebb valószínűséggel szerezték meg a szükséges genetikai változásokat. Természetesen néhány gyermek rákos lesz, de ez sokkal gyakoribb az idősebb egyéneknél. Az alábbi grafikon a vastagbélrák arányát mutatja az Egyesült Államokban az életkor függvényében. A grafikon a National Cancer Institute-tól származik. 2
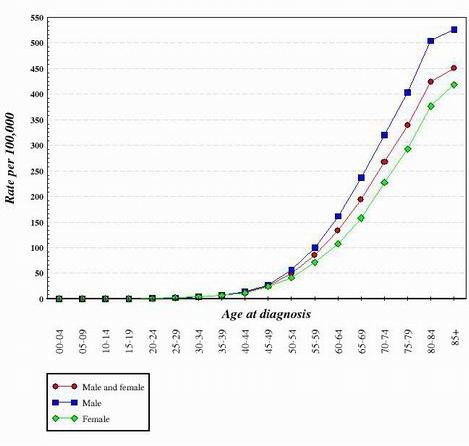
A fentihez hasonló görbék alakját vizsgálva arra a következtetésre jutottak, hogy számos genetikai változás szükséges ahhoz, hogy a sejtek rákossá váljanak.
A laboratóriumban a kutatók kulcsfontosságú szabályozó fehérjék megváltoztatásával vagy bevezetésével próbáltak daganatos sejteket létrehozni. Számos tanulmányban próbálták meghatározni a rákos sejtek létrehozásához szükséges minimális számú genetikai változtatást, érdekes eredményekkel.3
A természetben a mutációk idővel felhalmozódhatnak a sejtekben, és ha a gének “megfelelő” csoportja mutálódik, rákot eredményezhet. Egy 2012-es tanulmány kimutatta, hogy egy egészséges egyén csontvelői őssejtjei számos mutációt halmoznak fel, ahogy az illető öregszik. A kulcsfontosságú génekben bekövetkező néhány további változás is rákot okozhat. Az eredmények arra utalnak, hogy a “normális” sejtek és a rákos sejtek sok esetben talán nem is különböznek annyira.4
Öröklött mutációk a rákban
A dolgok bonyolítása érdekében egyértelmű, hogy a rákos sejtek létrehozásához szükséges változások sokféle módon megvalósulhatnak. Bár minden rákos sejtnek ugyanazt a szabályozási spektrumot kell legyőznie ahhoz, hogy növekedjen és előrehaladjon, az érintett gének különbözhetnek. Ráadásul a gének szabályozatlanná válásának vagy elvesztésének sorrendje is eltérő lehet. Példának okáért két különböző személy vastagbélrákos daganatában a tumorszupresszorok és onkogének nagyon különböző készletei lehetnek jelen, még akkor is, ha a végeredmény (rák) ugyanaz.
A rákos megbetegedésekben – még az azonos szervben előforduló rákos megbetegedésekben is – megfigyelhető nagyfokú heterogenitás azt jelenti, hogy a diagnózis és a kezelés bonyolult. A daganatok molekuláris osztályozásában elért jelenlegi előrelépéseknek lehetővé kell tenniük a kezelési protokollok racionális megtervezését az adott esetben ténylegesen érintett gének alapján. Az új diagnosztikai tesztek több száz vagy több ezer gén szűrését foglalhatják magukban, hogy az egyén daganatának személyre szabott profilját hozzák létre. Ez az információ lehetővé teszi majd az egyénre szabott rákkezelést. Erről bővebb információért lásd a Genomika/Proteomika fejezetet.
A szabályozatlan sejtnövekedéshez vezető genetikai változások kétféle módon szerezhetők meg. Lehetséges, hogy a mutáció fokozatosan, több év alatt következik be, ami egy “sporadikus” rákos eset kialakulásához vezet. Alternatív megoldásként lehetséges, hogy egy adott ráktípus családi formájának kialakulásához vezető, diszfunkcionális gének öröklődnek. Néhány példa az ismert örökletes összetevőjű rákos megbetegedésekre:
- Mellrák- A BRCA1 és BRCA2 gének mutáns változatainak öröklése ismert kockázati tényező. Bár sok, ha nem a legtöbb emlőrákos egyénnél nem mutatható ki kimutatható elváltozás ezekben a génekben, a mutáns forma megléte növeli az emlőrák kialakulásának valószínűségét.
- Vastagbélrák- A DNS-javító gének, például az MSH2 gén hibái ismertek arról, hogy hajlamosítanak az örökletes nem polipozitású vastagbélrákra (HNPCC).
- Retinoblasztóma- Az Rb tumorszupresszor gén hibái ismertek arról, hogy ezt a szemrákot és számos más ráktípust okoznak. Erről a konkrét betegségről bővebben az Rb
Rb
Ez az ismert örökletes ráktípusok nem teljes listája, és biztos, hogy a különböző ráktípusok genetikájának tisztázásával további örökletes rákformákat fognak azonosítani.
A témával kapcsolatos további információk Robert A. Weinberg The Biology of Cancer című könyvének 2. és 4. fejezetében találhatók.
A mutáció típusai
A fehérjék előállításának folyamata, a transzláció, az átírás útján keletkezett mRNS “leolvasásán” alapul. A gént kódoló DNS bármilyen változása a keletkező mRNS megváltozásához vezet. A megváltozott mRNS pedig olyan fehérje előállításához vezethet, amely már nem működik megfelelően. Egy gén DNS-ének egyetlen nukleotidjának megváltoztatása is egy teljesen működésképtelen fehérjéhez vezethet.
A DNS-t többféle módon lehet megváltoztatni. Az alábbiakban a genetikai változások különböző típusait ismertetjük részletesebben.
Pontmutációk
A genetikai változások két általános kategóriába sorolhatók. Az első kategóriába azok a változások tartoznak, amelyek csak egy vagy néhány nukleotidot változtatnak meg a DNS-szál mentén. Az ilyen típusú változásokat nevezzük pontmutációknak.
Amikor a riboszómák egy hírvivő RNS-molekulát olvasnak, minden három nukleotidot egy aminosavként értelmeznek. Ezeket a három betűs kódokat kodonoknak nevezzük. Egy angol mondat analógiájára: “A kövér macska megette a patkányt” 6 kodont tartalmazna. A mutáció által okozott változások olyan dolgokat eredményezhetnek, mint ‘A kövér denevér megette a patkányt.’ vagy ‘The fa’ vagy ‘The fat oca tat her at…’. A fehérjére gyakorolt hatás attól függ, hogy hol történik a változás és milyen jellegű.
A riboszómák által olvasott hárombetűs kodonokat a mutáció háromféleképpen változtathatja meg:
Nonszensz mutációk
Az új kodon hatására a fehérje idő előtt megszűnik, és egy olyan fehérje keletkezik, amely megrövidül, és gyakran nem működik megfelelően vagy egyáltalán nem.
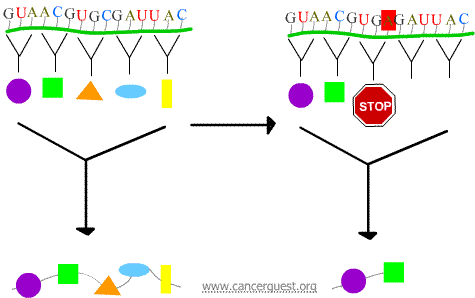
Missense mutációk
Az új kodon miatt egy helytelen aminosav kerül be a fehérjébe. A fehérje funkciójára gyakorolt hatás attól függ, hogy mi kerül a normál aminosav helyére.

Frameshift mutációk
1 vagy 2 nukleotid elvesztése vagy elnyerése az érintett kodon és az azt követő összes kodon hibás olvasását okozza. Ez egy nagyon eltérő és gyakran nem funkcionális fehérjetermékhez vezet.
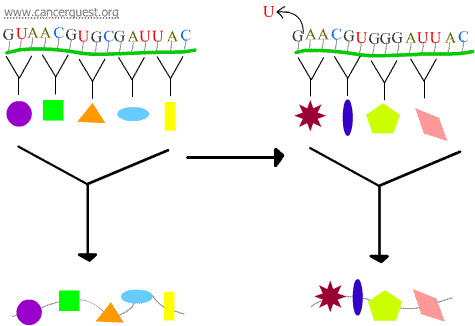
Transzkripciós hibák
Egy bizonyos DNS-károsodás olyan módosított nukleotidot vagy nukleotidok kis csoportját eredményezi, amelyet az RNS-polimeráz nem tud “beolvasni”. Amikor az RNS-polimeráz komplex eléri ezeket a helyeket, néha megkerüli a sérülést azzal, hogy nukleotidokat ad hozzá a folytatás érdekében, még akkor is, ha ez azt jelenti, hogy rosszat tesz be. Ezt a folyamatot nevezzük transzkripciós mutagenezisnek, és jelentős szerepet játszhat a rák kialakulásában.5
Transzlokációk
A mutációk másik kategóriája a DNS nagyobb mennyiségű, gyakran a kromoszóma szintjén történő módosítását jelenti. Ezeket transzlokációknak nevezzük, és a kromoszómatöredékek törésével és mozgásával járnak. Gyakran előfordul, hogy két különböző kromoszóma törése két “új” kromoszóma kialakulását teszi lehetővé, új génkombinációkkal.
Míg úgy tűnhet, hogy ez nem okoz nagy gondot, mivel az összes gén továbbra is jelen van, a folyamat többféleképpen is deregulált sejtnövekedéshez vezethet-
1. Előfordulhat, hogy a gének nem íródnak át és nem fordítódnak le megfelelően az új helyükön.
2. Egy gén mozgása a transzkripció szintjének növekedéséhez vagy csökkenéséhez vezethet.
3. A törés és újraegyesítés egy génen belül is bekövetkezhet (ahogy a fenti zöld színnel látható), ami inaktiválásához vezet.
Egyes rákbetegségek esetében bizonyos transzlokációk nagyon gyakoriak, és akár a betegség diagnosztizálásában is felhasználhatók. A transzlokációk gyakoriak a leukémiákban és a limfómákban, és ritkábban azonosították őket a szilárd szövetek rákos megbetegedéseiben. Ilyen például a 9. és 22. kromoszóma közötti csere, amely a krónikus myelogén leukémiában (CML) szenvedő betegek több mint 90%-ánál fordul elő. A csere a 22-es kromoszóma rövidült formájának kialakulásához vezet, amelyet Philadelphia-kromoszómának neveznek (a kromoszóma felfedezésének helye után). Ez a transzlokáció az abl proto-onkogénből egy onkogén kialakulásához vezet.67
A többi rákos megbetegedés, amely gyakran (vagy mindig) bizonyos transzlokációkkal jár együtt, a Burkitt-limfóma, a B-sejtes limfómák és a leukémia számos típusa.
Génamplifikáció
Ez a nagyon szokatlan folyamat a normál DNS-replikációs folyamatot súlyosan megzavarja. Az eredmény az, hogy ahelyett, hogy a kromoszóma egy régiójának egyetlen másolata készülne, sok másolat keletkezik. Ez a kromoszóma adott régiójában található gének sok másolatának előállításához vezet. Néha az amplifikált régióból olyan sok másolat keletkezik, hogy azok tulajdonképpen saját kis pszeudo-kromoszómákat, úgynevezett dupla perces kromoszómákat képezhetnek.
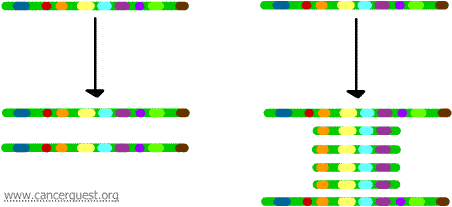
A másolatok mindegyikén lévő gének átíródhatnak és lefordíthatók, ami az amplifikált géneknek megfelelő mRNS és fehérje túltermeléséhez vezet, ahogy az alábbiakban látható. A szaggatott vonalak a gén minden egyes példányának átírása révén keletkező mRNS-t jelölik.
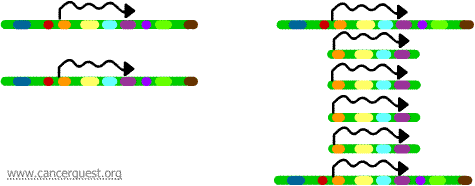
Míg ez a folyamat normális sejtekben nem látható, a rákos sejtekben igen gyakran előfordul. Ha egy onkogén szerepel az amplifikált régióban, akkor a gén ebből eredő túlterjedése deregulált sejtnövekedéshez vezethet. Erre példa a myc onkogén amplifikációja a daganatok széles körében, valamint az ErbB-2 vagy HER-2/neu onkogén amplifikációja az emlő- és petefészekrákban. A HER-2/neu onkogén esetében a klinikai kezeléseket úgy tervezték meg, hogy a fehérjeterméket túlexpresszáló sejteket célozzák.
A génamplifikáció a rákkezelés egyik legnagyobb problémájához is hozzájárul: a gyógyszerrezisztenciához. A gyógyszerrezisztens daganatok a kemoterápiás gyógyszerek jelenlétében is képesek tovább növekedni és terjedni. Az általában érintett gént MDR-nek nevezik, ami a többszörös gyógyszerrezisztenciát jelenti. Ennek a génnek a fehérjeterméke a sejtek membránjában található pumpaként működik. Képes szelektíven kilökni a molekulákat a sejtből, beleértve a kemoterápiás gyógyszereket is. Ez az eltávolítás hatástalanná teszi a gyógyszereket.
Ezt részletesebben a Gyógyszerrezisztencia című fejezetben tárgyaljuk. A különböző gének felerősödése hatástalanná tehet más kemoterápiás gyógyszereket.
Inverziók, duplikációk és deléciók
Inverziók
Ezekben az elváltozásokban a DNS szegmensei kikerülnek egy kromoszómából, majd ellentétes orientációban újra beillesztésre kerülnek. Az előző példákhoz hasonlóan ez az átrendeződés abnormális génexpresszióhoz vezethet, akár egy onkogén aktiválásával, akár egy tumorszupresszor gén deaktiválásával.
Duplikációk/Deléciók
Replikációs hibák révén egy gén vagy géncsoport egynél többször másolódhat egy kromoszómán belül. Ez annyiban különbözik a génamplikációtól, hogy a gének nem replikálódnak a kromoszómán kívülre, és csak egy plusz alkalommal másolódnak, nem pedig több száz vagy ezer alkalommal. A gének a replikációs folyamat meghibásodása vagy más genetikai károsodás miatt is elveszhetnek.

Aneuploidia
Aneuploidia az a genetikai változás, amely egész kromoszómák elvesztésével vagy gyarapodásával jár. A sejtosztódási folyamat problémái miatt előfordulhat, hogy a replikált kromoszómák nem pontosan válnak szét a leánysejtekben. Ez olyan sejteket eredményezhet, amelyek túl sok vagy túl kevés kromoszómával rendelkeznek. Egy példa egy meglehetősen gyakori aneuploid állapotra, amely nem kapcsolódik a rákhoz, a Down-szindróma, amelyben a 21-es kromoszóma egy extra példánya van az érintett egyén összes sejtjében.
A lenti animációban két kromoszóma másolata keletkezik, de amikor a sejt osztódik, a kromoszómák nem egyenletesen oszlanak el a két keletkező sejt között (leánysejtek). Az eredmény az, hogy az egyik sejtnek túl sok kromoszómája van, az egyiknek pedig nem elég.
A rákos sejtek nagyon gyakran aneuploidok. Az emberek sejtjeiben normális esetben 46 kromoszóma van, de a rákos sejtekben gyakran sokkal több, néha 100-nál is több. Az extra kromoszómák jelenléte instabillá teszi a sejteket, és súlyosan megzavarja a sejtosztódás szabályozását. Jelenleg vita folyik arról, hogy minden rákos megbetegedés aneuploid-e vagy sem. Függetlenül attól, hogy ez így van-e, egyértelmű, hogy az aneuploidia a rákos sejtek közös jellemzője.
Epigenetikai változások
A DNS-szekvencia tényleges változásai mellett a génexpresszió a DNS és a kromatin olyan változásai révén is módosulhat, amelyek nem változtatják meg a szekvenciát. Mivel ezek a változások nem változtatják meg a génekben lévő DNS szekvenciáját, epigenetikus változásoknak nevezzük őket. Az alábbiakban az epigenetikai változások két típusát ismertetjük.
Metiláció
Ebben a változásban a DNS egyes nukleotidjai úgy módosulnak, hogy a bázishoz metil (-CH3) csoportot adnak. A DNS metilációja a DNS adott régiójának inaktiválásával jár. A rákos sejtekben rendellenes DNS-metilációs mintázatokat figyeltek meg. A metiláció a leírt változásokhoz hasonlóan megváltoztatja az érintett gének kifejeződését.
Acetiláció
Ebben az epigenetikai változásban a DNS köré tekeredő hisztonfehérjék acetil (-CH3CHO) csoportok hozzáadásával módosulnak. Ez a változás a DNS:hiszton kölcsönhatás lazulását eredményezi, és fokozott génexpresszióval jár. Az acetilcsoportok DNS-hez való hozzáadásának és eltávolításának folyamatainak módosítása a rákkezelési kutatások aktív területe.
Tovább az epigenetikai változásokról és a rákkezelésről.
A mutáció okai
Amint láttuk, a rákos sejtek normális elősejtekből jönnek létre a genetikai károsodások felhalmozódása révén. A mechanizmusok, amelyekkel a változásokat előidézik, változatosak. Tágabb értelemben a genetikai változások (mutáció) okozói elsősorban az alábbiakban ismertetett kategóriákba tartoznak, amelyeket a következő fejezetben részletesen tárgyalunk.
Spontenzív mutációk
Spontenzív mutációk: A DNS-ben lévő bázisok (A, T, G, C) megváltoznak vagy elvesznek javítatlan replikációs hibák vagy véletlenszerű molekuláris események következtében. Például egy aminocsoport elvesztése a citozinból, a DNS-ben normálisan megtalálható bázisból, uracil keletkezéséhez vezet, amely bázis normálisan nem található meg a DNS-ben. Ha ezt a változást nem észlelik és nem fordítják vissza, mutáció alakulhat ki. Esetenként egy teljes bázis is elveszhet a DNS-gerinc és a bázis közötti kötés felhasadása következtében. Ez egy rés keletkezik a DNS-kettős spirálban, ami, ha nem javítják ki, a DNS következő másolásakor (azaz a replikáció során) mutációhoz vezethet.
Induced Mutations
Induced mutations: Mutációkat lehet előidézni azzal, hogy szervezeteket (vagy sejteket) különböző kezeléseknek teszünk ki. Néhány a leggyakoribbak közül:
Sugárzás- Az egyik első ismert mutagén, a sugárzás a mutációk erős indukálója. A különböző típusú sugárzások különböző típusú genetikai változásokat okoznak. Az ultraibolya (UV) sugárzás pontmutációkat okoz. A röntgensugárzás töréseket okozhat a DNS kettős spiráljában, és transzlokációkhoz, inverziókhoz és más típusú kromoszómakárosodásokhoz vezethet. A napfényben lévő UV-sugaraknak való kitettség összefüggésbe hozható a bőrrákkal. Megjegyzendő, hogy a sugárzás DNS-károsító tulajdonságait számos különböző sugárzáson alapuló rákkezelésben hasznosították.
Az alábbiakban egy olyan mutációtípus látható, amelyet az ultraibolya sugárzás okoz. Ebben a példában a DNS kettős spiráljának UV-sugarakkal való bombázása két bázis összekapcsolódását okozza. Ez megváltoztatja a DNS szerkezetét, és ha nem javítják ki, maradandó változásokhoz vezethet.
A sugárzás másik típusa a természetben előforduló radioaktív elemek (mint a radon és az urán) vagy az ember által létrehozott források, például az atomreaktorokban található (és létrehozott) források által kibocsátott energia. Az ilyen típusú sugárzásnak különböző típusai vannak, és különböző típusú károsodást okozhatnak a sejtekben és szövetekben. A sugárzás közvetlenül károsíthatja a DNS-t, vagy vegyi anyagok (pl. reaktív oxigénfajok vagy ROS) képződését okozhatja, amelyek aztán károsíthatják a DNS-t vagy más sejtkomponenseket.
A radioaktív anyagokból származó sugárzásnak való kitettség jól dokumentált. A II. világháborúban Japánra ledobott atombombák túlélőinek elemzései a leukémiák nagymértékű növekedését mutatták ki röviddel az expozíciót követően, majd a következő évtizedekben más ráktípusok növekedését.8
A nukleáris erőművekből is véletlenül kerültek ki veszélyes mennyiségű radioaktív anyagok. A csernobili atomreaktorból véletlenül kiszabadult radioaktív anyagok miatt bekövetkezett sugárterhelést összefüggésbe hozták a pajzsmirigyrák és más rosszindulatú rákos megbetegedések számának növekedésével.9
Az orvosi képalkotó gépek (például a röntgengépek és a CT-szkennerek) szintén sugárzásnak teszik ki a betegeket. Az egyes vizsgálatokhoz használt mennyiségekről nem gondolják, hogy jelentős mennyiségű rákot okoznának, de az évek során végzett sok vizsgálat hosszú távú hatása nem egyértelmű.10 Hasonlóképpen, a repülőgépek utasainak a repülőtereken végzett teljes testszkennelésnek való kitettségéről nem gondolják, hogy rákveszélyt jelentene.11 A repülőgépek utasai szintén ki vannak téve az űrből érkező sugárzásnak, de alacsony szinten, és úgy gondolják, hogy nem jelent rákkockázatot, még a repülőszemélyzet tagjai számára sem.1112
Kémiai mutagének- Számos különböző vegyi anyagról ismert, hogy mutációkat okoz. Ezek a vegyi anyagok úgy fejtik ki hatásukat, hogy a DNS-hez vagy a DNS építőköveihez kötődnek, és megzavarják a replikációs vagy transzkripciós folyamatokat. Néhány példa a hatásos mutagénekre: a benzo-a-pirén, a cigarettafüstben található vegyi anyag, és az aflatoxin, a leggyakrabban a helytelenül tárolt mezőgazdasági termékekben található mutagén.
Krónikus gyulladás- A krónikus gyulladás DNS-károsodáshoz vezethet, mivel az immunrendszer sejtjei mutagén vegyi anyagokat termelnek. Erre példa lehet a hepatitis vírussal való fertőzés okozta hosszú távú gyulladás. Tudjon meg többet a vírusokról és a rákról.
Az oxigéngyökök- A mitokondriumainkban a táplálékból történő energia megkötése során olyan vegyi anyagok keletkezhetnek, amelyek nagyon reaktívak, és képesek károsítani a sejtmembránokat és magát a DNS-t is. Ezek a reaktív oxigén intermedierek (ROI) a sejtek sugárzásnak való kitettsége során is keletkezhetnek, ahogy az alábbiakban látható.
A ROI mutagén aktivitása összefügg a rák kialakulásával, valamint számos rákellenes kezelés, köztük a sugárkezelés és a kemoterápia hatásával. 131415
A rendellenes sejtosztódás
A mitózis során előfordulhat, hogy a sejtosztódás során nem sikerül a replikált kromoszómákat pontosan két leánysejtre osztani. Az ilyen típusú hiba aneuploid sejtek keletkezéséhez vezet. A sejtek vagy hiányozni fognak, vagy jelentős számú génnel gyarapodnak. Ez a ritka folyamat olyan sejteket hozhat létre, amelyek hajlamosabbak a szabályozatlan sejtosztódásra. Mint korábban említettük, az emberből izolált rákos megbetegedések nagy százaléka aneuploid.
Ha egy sejtben mutáció van egy olyan génben, amelynek fehérjeterméke az osztódási folyamat “ellenőrzéséért” felelős, a dolgok gyorsan kicsúszhatnak az irányítás alól, és az egyes osztódások leánysejtjei egyre rendellenesebbé válhatnak.
Vírusok mint mutagének
A rákos esetek jelentős százalékáért a vírusokat tartják felelősnek. A vírusok sokféleképpen okozhatnak rákot, és az egyes vírustípusok hatásmechanizmusa valószínűleg kissé eltérő. Egyes vírusok (köztük számos retrovírus) mutációkat okozhatnak azáltal, hogy génjeiket beillesztik a fertőzött sejt genomjába. A beillesztett DNS elpusztíthatja vagy megváltoztathatja az érintett gének aktivitását.161718
A vírusok közvetett módon is okozhatnak mutációkat. Példának okáért: A hepatitiszvírussal való fertőzés évekig is eltarthat. Ez idő alatt a szervezet védekező rendszere mérgező vegyi anyagok termelésével próbál megszabadulni a vírustól. Ezek a vegyi anyagok károsíthatják az egyébként egészséges “járulékos” sejteket, és elindíthatják őket a rákhoz vezető úton. A vírusok számos más módon is okozhatnak rákot. 1920
A vírusoknak számos rákos megbetegedés kialakulásában betöltött szerepe miatt létrehoztunk egy, a vírusoknak és a ráknak szentelt részt.
A transzpozonok mint mutagének
A transzpozonok olyan rövid DNS-szekvenciák, amelyek képesek a DNS egyik helyéről egy másik helyre vándorolni. A transzpozonok egy enzimet, a transzpozáz enzimet kódolják, amely a transzpozont a genom új helyére illeszti (lásd a transzpozonok vázlatát balra lent) A transzpozonokat Barbara McClintock fedezte fel, és munkájáért Nobel-díjat kapott.2122 Az emberi genomban sok inaktivált transzpozon-kópia található, amelyek elvesztették a képességüket, hogy új helyre mozogjanak vagy “ugorjanak”. Az emberi genom mintegy 50%-a “halott” transzpozonokból áll.23
Az aktív transzpozonok mozgása mutációkhoz vezethet, megváltoztatva a gének aktivitását. A transzpozonok mozgásának (az úgynevezett transzpozíciónak) látható példája az indiai kukorica magjainak színeződése (lásd lent jobbra). Az emberben aktív transzpozonok feltételezhetően részt vesznek az emberi betegségekben, beleértve a rákot is.242526


Mutációs összefoglaló
Genetikai változás (mutáció) Bevezetés
- A rákos sejtek által tanúsított rendellenes viselkedés a kulcsfontosságú szabályozó gének (pl. DNS-javító gének) mutációinak sorozatának eredménye.
- A legtöbb rákos sejtről úgy gondolják, hogy egyetlen prekurzor sejtből ered, amely elegendő mutációt szerez ahhoz, hogy rákos sejt legyen.
DNS-mutációk
- A genetikai változások lehetnek kicsik, csak egy vagy néhány nukleotidot érinthetnek (pontmutációk), vagy lehetnek egészen nagyok, megváltoztathatják egy vagy több kromoszóma szerkezetét.
- Pontmutációk
- A transzláció a fehérje előállítása olyan enzimek által, amelyek három nukleotid “szót” (kodont) “olvasnak” a hírvivő RNS (mRNS) mentén.
- Még egyetlen nukleotid megváltoztatása is vezethet egy gén DNS-ének mentén teljesen működésképtelen fehérjéhez. A mutációkat aszerint csoportosítjuk, hogy milyen változásokat okoznak az érintett génből származó fehérjetermékben.
- Nonsense mutációk – Az új (mutáns) kodon a fehérjeszintézis idő előtti leállását okozza.
- Missense mutációk – A megváltozott kodon egy helytelen aminosav beépülését eredményezi a fehérjébe.
- Frameshift mutációk – Az mRNS-ben 1 vagy 2 nukleotid elvesztése vagy megnyerése a kodonok rossz olvasását okozza. Gyakran rövidült és nem funkcionális fehérjéket eredményez.
- Kromoszómaszintű változások
- Transzlokációk – Kromoszómaszakaszok törése és (néha) cseréje.
- Génamplifikáció – A rendellenes replikáció a kromoszóma egy régiójának több példányát hozza létre. Ez végső soron a megfelelő fehérjék túltermeléséhez vezet.
- Inverziók – DNS-szegmensek kikerülnek egy kromoszómából, majd ellentétes orientációban újra beillesztésre kerülnek.
- Duplikációk/Deléciók – Egy gén vagy géncsoport teljesen elveszhet, vagy egynél többször másolódhat egy kromoszómán belül.
- Aneuploidia – Olyan genetikai változás, amely egész kromoszómák elvesztésével vagy gyarapodásával jár.
- Spontán mutációk előfordulhatnak javítatlan DNS vagy véletlenszerű molekuláris események következtében.
- Aneuploidia nagyon gyakori a rákos sejtekben.
Epigenetikai változások
- A génkifejeződés a DNS és a kromatin olyan változásai révén is módosulhat, amelyek nem változtatják meg a genetikai szekvenciát. Ilyen például a DNS-metiláció és a hisztonok acetilációja.
- Metiláció – A DNS egyes nukleotidjai metilcsoport hozzáadásával módosulnak, ami a DNS adott régiójának inaktiválásával jár
- Acetiláció – Az acetilcsoportok hozzáadása fellazítja a DNS-t és növeli a génexpressziót.
Induced Mutations
- Mutációkat lehet előidézni azzal, hogy szervezeteket (vagy sejteket) különböző kezeléseknek teszünk ki:
- Sugárzás – Az UV-sugarak pontmutációkat, a röntgensugarak pedig többféle károsodást okoznak.
- Kémiai mutagének – Megkötődhetnek a DNS-hez vagy a DNS építőköveihez, és megzavarhatják a replikációs vagy transzkripciós folyamatokat.
- Krónikus gyulladás – Az immunrendszer sejtjei által termelt mutagén vegyi anyagok DNS-károsodása
- Oxygen gyökök – A sejt energiatermeléséből ered, és károsíthatja a DNS-t.
Más genetikai változások
- A kromoszómák helytelen osztódását eredményező hibás sejtosztódás aneuploidiához vezethet.
- A vírusok többféle módon okozhatnak genetikai károsodást, és a rákos megbetegedések széles körével hozhatók kapcsolatba.
Mutáció és rák
- Úgy tűnik, hogy a normális, egészséges sejtből a rákos sejtbe való átmenet fokozatos folyamat.
- A rák kialakulásához számos különböző onkogén és tumorszupresszor genetikai változására van szükség.
- Minden rákos megbetegedésnek ugyanazt a szabályozási spektrumot kell legyőznie ahhoz, hogy növekedjen és előrehaladjon, de az érintett gének különbözhetnek.
- A rák heterogenitása megnehezíti a diagnózist és a kezelést.
- Egy adott ráktípus familiáris formájának kialakulásához vezető diszfunkcionális gének öröklődhetnek.
Know the Flow: Mutation
A Know the Flow egy interaktív játék, amellyel tesztelheti tudását. A játékhoz:
- Húzd ki a megfelelő választási lehetőségeket a jobb oldali oszlopból, és helyezd őket sorrendben a bal oldali dobozokba. Ne feledje, hogy a hat lehetőségből csak ötöt használhat fel a játék befejezéséhez.
- Amikor végzett, kattintson az ‘Ellenőrzés’ gombra, hogy megnézze, hányat talált helyesen.
- Hibás válaszok esetén kattintson a ‘Leírás’ gombra, hogy megnézze a folyamatokkal kapcsolatos információkat.
- Az újbóli próbálkozáshoz válassza az ‘Újraindítás’ lehetőséget, és kezdje elölről.
-
1
-
2
-
3
-
4
-
5
-
További információEgy sejtben a DNS szintézis folyamata zajlik
-
További információEgy kromoszóma egy régiójának több példánya készül
-
Tudjon meg többetA sokszorosított gének átírása
-
Tudjon meg többetA sokszorosított gének átírása
-
Tudjon meg többetEgy kulcs többszörözése. fehérje gyógyszerrezisztens tumor növekedéséhez vezet
-
Tudjon meg többetDuplikáció történik
Játszd újra
- lejátszásához 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biológia (11. kiadás). Pearson.
- 2. Pearson. Surveillance, Epidemioloy, and End Results (SEER) képviseletében National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. “Meghatározott genetikai elemekkel rendelkező emberi tumorsejtek létrehozása”. Nature 400: 464-468
- 4. Nature 400: 464-468
- . Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, 2012. július 20.
- 5. Brégeon D, Doetsch PW. Transzkripciós mutagenezis: okok és részvétel a tumorok kialakulásában. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. “Kromoszómavizsgálatok normális és leukémiás humán leukocitákon”. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. “Egy új konzisztens kromoszóma-rendellenesség krónikus myelogén leukémiában, amelyet kinakrin fluoreszcenciával és Giemsa festéssel azonosítottak.” Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASIES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9. Mar.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Orvosi képalkotó eljárásokból származó kis dózisú ionizáló sugárzásnak való kitettség. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Repülőtéri teljes testszűrés: What Is the Risk? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Kozmikus sugárzás a kereskedelmi repülésben. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. “Oxidatív stressz, DNS-károsodás és emlőrák”. AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. “Oxidatív stressz és kísérleti karcinogenezis”. Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. “Oxigéngyökök, lipidperoxidáció és DNS-károsodás”. (2002)181-182:219-222
- 16. Nair V. Retrovírusok által kiváltott onkogenezis és a retrovírus vektorok biztonsága. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr vírus és Burkitt limfóma. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogén retrovírusok és a rák. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B vírus által indukált onkogenezis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV okozta hepatocelluláris karcinóma: A krónikus gyulladástól a rákig. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. A mutálható lókuszok eredete és viselkedése a kukoricában. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobel-díjas előadása
- 23. McClintock, Barbara Nobel Prize lecture
- 23. Burns KH, Boeke JD. Az emberi transzpozon tektonika. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobil genetikai elemek és a rák. A mutációktól a génterápiáig. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobil elemek az emberi genomban: következmények a betegségekre. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. A humán genomok természetes mutagenezise endogén retrotranszpozonok által. Cell. 2010 Jun 25;141(7):1253-61.