Legge sul decadimento radioattivo
Quando un singolo nucleo si trasforma in un altro con l’emissione di radiazione, si dice che il nucleo decade. Il decadimento radioattivo avviene per tutti i nuclei con \(Z > 82\), e anche per alcuni isotopi instabili con \(Z < 83\). Il tasso di decadimento è proporzionale al numero di nuclei originali (non decaduti) N in una sostanza. Il numero di nuclei persi per decadimento, \(-dN\) nell’intervallo di tempo dt, si scrive
\
dove \(\lambda\) è chiamato la costante di decadimento. (Il segno meno indica che il numero di nuclei originali diminuisce nel tempo). In altre parole, più nuclei sono disponibili per decadere, più ne decadono (nel tempo dt). L’equazione \ref{eq2} può essere riscritta come
Integrando entrambi i lati dell’equazione, e definendo \(N_0\) come il numero di nuclei a \(t = 0\), otteniamo
Questo ci dà
Prendendo i lati sinistro e destro dell’equazione \ref{eq4} come potenza di \(e\), abbiamo la legge del decadimento radioattivo.
Legge del decadimento radioattivo
Il numero totale \(N\) di nuclei radioattivi rimanenti dopo il tempo \(t\) è
dove \(\lambda\) è la costante di decadimento per quel particolare nucleo.
Il numero totale di nuclei scende molto rapidamente all’inizio, e poi più lentamente (Figura \PageIndex{2}}).
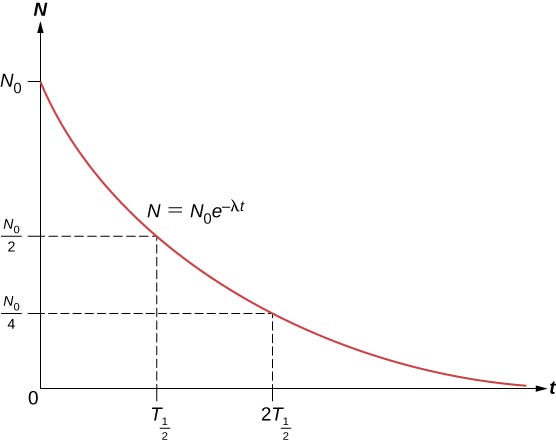
L’emivita \((T_{1/2})\) di una sostanza radioattiva è definita come il tempo in cui la metà dei nuclei originali decade (o il tempo in cui rimane la metà dei nuclei originali). Le emivite degli isotopi instabili sono mostrate nel grafico dei nuclidi. Il numero di nuclei radioattivi che rimangono dopo un numero intero (n) di emivite è quindi
Se la costante di decadimento \((\lambda)\) è grande, l’emivita è piccola, e viceversa. Per determinare la relazione tra queste quantità, si noti che quando \(t = T_{1/2}\), allora \(N = N_0/2\).
Quindi, l’equazione \ref{eq5} può essere riscritta come
Dividendo entrambi i lati per \(N_0\) e prendendo il logaritmo naturale si ottiene
che si riduce a
Quindi, se conosciamo il tempo di dimezzamento T1/2 di una sostanza radioattiva, possiamo trovare la sua costante di decadimento. La vita \(\overline{T}) di una sostanza radioattiva è definita come la quantità media di tempo che un nucleo esiste prima di decadere. La vita di una sostanza è solo il reciproco della costante di decadimento, scritta come
L’attività A è definita come la grandezza del tasso di decadimento, o
Il cambiamento infinitesimale dN nell’intervallo di tempo dt è negativo perché il numero di particelle madri (non decadute) sta diminuendo, quindi l’attività (A) è positiva. Definendo l’attività iniziale come \(A_0 = \lambda N_0\), abbiamo
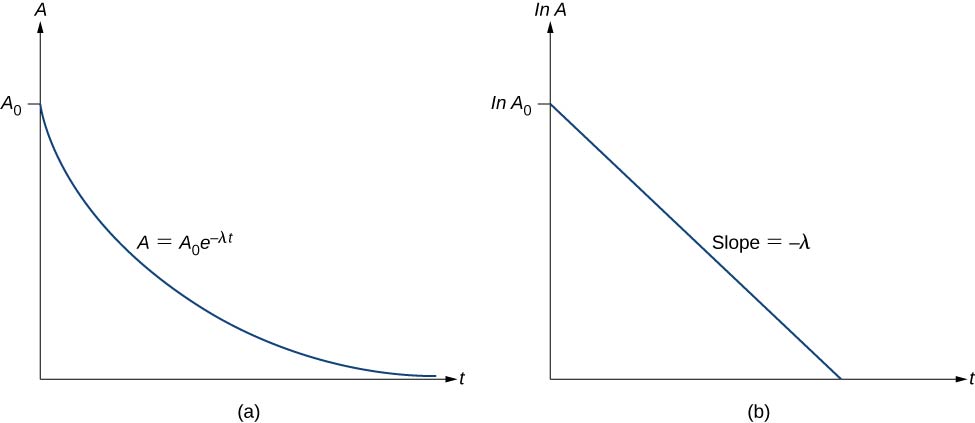
Quindi, l’attività A di una sostanza radioattiva diminuisce esponenzialmente con il tempo (Figura \PageIndex{3}\).
Esempio \(\PageIndex{1}}): Costante di decadimento e attività dello stronzio-90
L’emivita dello stronzio-90, \ce{38}^{90}Sr}, è 28,8 y. Trova (a) la sua costante di decadimento e (b) l’attività iniziale di 1,00 g del materiale.
Strategia
Possiamo trovare la costante di decadimento direttamente dall’equazione \ref{eq8}. Per determinare l’attività, dobbiamo prima trovare il numero di nuclei presenti.
Soluzione
a. La costante di decadimento si trova ad essere
b. La massa atomica di \(_{38}^{90}Sr) è 89,91 g. Usando il numero di Avogadro \(N_A = 6,022 \times 10^{23}\) atomi/mol, troviamo il numero iniziale di nuclei in 1,00 g di materiale:
\
Da questo, troviamo che l’attività \(A_0\) a \(t = 0\) per 1.00 g di stronzio-90 è
Esprimendo \(\lambda\) in termini di emivita della sostanza, si ottiene
Quindi, l’attività si dimezza dopo un’emivita. Possiamo determinare la costante di decadimento \(\lambda\) misurando l’attività in funzione del tempo. Prendendo il logaritmo naturale dei lati sinistro e destro dell’equazione \ref{eq11}, otteniamo
Questa equazione segue la forma lineare \(y = mx + b\). Se tracciamo \ln A contro t, ci aspettiamo una linea retta con pendenza \(-lambda\) e intercetta y \(\ln \, A_0\) (Figura \PageIndex{3b}). L’attività A è espressa in unità di becquerel (Bq), dove un \(1 \, Bq = 1 \, decadimento \, per \, secondo\). Questa quantità può anche essere espressa in decadimenti al minuto o decadimenti all’anno. Una delle unità più comuni per l’attività è il curie (Ci), definito come l’attività di 1 g di \(^{226}Ra\). La relazione tra il Bq e il Ci è
Esempio \(\PageIndex{2}): Qual è l’attività del carbonio nel tessuto vivente?
Circa il \20% del corpo umano in massa è carbonio. Calcola l’attività dovuta al \14}C\ in 1,00 kg di carbonio che si trova in un organismo vivente. Esprimi l’attività in unità di Bq e Ci.
Strategia
L’attività di \(^{14}C\) è determinata usando l’equazione \(A_0 = \lambda N_0\), dove λ è la costante di decadimento e \(N_0\) è il numero di nuclei radioattivi. Il numero di nuclei \(^{14}C\ in un campione di 1,00 kg è determinato in due passi. In primo luogo, determiniamo il numero di nuclei \(^{12}C\) usando il concetto di mole. In secondo luogo, si moltiplica questo valore per \(1,3 volte 10^{-12}\ (l’abbondanza nota di \(^{14}C\) in un campione di carbonio di un organismo vivente) per determinare il numero di \(^{14}C\) nuclei in un organismo vivente. La costante di decadimento è determinata dall’emivita nota di \(^{14}C\ (disponibile da ).
Soluzione
Una mole di carbonio ha una massa di 12,0 g, poiché è quasi pura \(^{12}C\). Quindi, il numero di nuclei di carbonio in un chilogrammo è
Il numero di nuclei di carbonio in 1 kg di carbonio è quindi
Ora possiamo trovare l’attività \(A\) usando l’equazione \ref{eq11}. Inserendo i valori noti ci dà
o \(7,89 \volte 10^9\) decadimenti all’anno. Per convertire questo nell’unità Bq, convertiamo semplicemente gli anni in secondi. Così,
o 250 decadimenti al secondo. Per esprimere A in curie, usiamo la definizione di una curie,
Così,
Significato
Circa \(20%) del corpo umano in peso è carbonio. Nel corpo umano avvengono centinaia di decadimenti di \14\C\ ogni secondo. Il carbonio-14 e altre sostanze radioattive presenti naturalmente nel corpo compongono l’esposizione di fondo di una persona alle radiazioni nucleari. Come vedremo più avanti in questo capitolo, questo livello di attività è ben al di sotto delle dosi massime raccomandate.