Le cellule contengono molta acqua. Uno dei ruoli dell’acqua è quello di sciogliere diversi materiali. Per esempio, ci sono molti diversi composti ionici (sali) nelle cellule. Gli ioni sono usati per mantenere i potenziali cellulari e sono importanti nella segnalazione cellulare e nella contrazione muscolare.
Come puoi dire se un composto è ionico o covalente?
Non c’è una risposta semplice a questa domanda. Molti legami sono da qualche parte nel mezzo. In un legame covalente polare, una coppia di elettroni è condivisa tra due atomi per soddisfare i loro ottetti, ma gli elettroni si trovano più vicini a un’estremità del legame che all’altra. C’è più carica negativa verso un’estremità del legame, e questo lascia più carica positiva all’altra estremità.
Guardare i valori di elettronegatività dei diversi atomi ci aiuta a decidere quanto uniformemente è condivisa una coppia di elettroni in un legame. L’elettronegatività aumenta verso l’angolo superiore destro della tavola periodica a causa di una combinazione di carica nucleare e fattori di schermatura. Gli atomi nell’angolo superiore destro della tavola periodica hanno una maggiore attrazione per i loro elettroni di legame condivisi, mentre quelli nell’angolo inferiore sinistro hanno un’attrazione più debole per gli elettroni nei legami covalenti.
In un legame carbonio-ossigeno, più elettroni sarebbero attratti dall’ossigeno perché è alla destra del carbonio nella sua fila nella tavola periodica. Composti come l’etere dimetilico, CH3OCH3, sono un po’ polari. La formaldeide, CH2O, è ancora più polare. Gli elettroni nei legami pi sono tenuti più liberi degli elettroni nei legami sigma, per ragioni che riguardano la meccanica quantistica. Questo permette all’ossigeno di tirare gli elettroni verso di sé più facilmente in un legame multiplo che in un legame sigma.

Non tutte le polarità sono facili da determinare dando un’occhiata alla tavola periodica. La direzione del dipolo in un legame boro-idrogeno sarebbe difficile da prevedere senza guardare i valori di elettronegatività, poiché il boro è più a destra ma l’idrogeno è più in alto. Come si è scoperto, l’idrogeno è leggermente negativo.
Un legame è ionico se la differenza di elettronegatività tra gli atomi è abbastanza grande che un atomo potrebbe tirare un elettrone completamente lontano dall’altro. Questa situazione è comune nei composti che combinano elementi dal bordo sinistro della tavola periodica (sodio, potassio, calcio, ecc.) con elementi nell’estremo angolo superiore destro della tavola periodica (più comunemente ossigeno, fluoro, cloro). Il cloruro di sodio è un composto ionico.
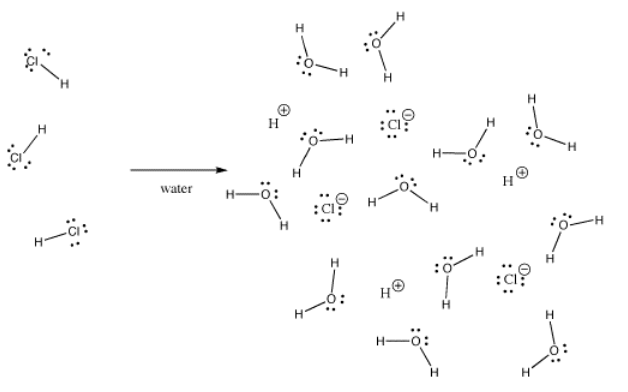
Molti legami possono essere covalenti in una situazione e ionici in un’altra. Per esempio, il cloruro di idrogeno, HCl, è un gas in cui l’idrogeno e il cloro sono legati covalentemente, ma se HCl è gorgogliato in acqua, si ionizza completamente per dare l’H+ e il Cl- di una soluzione di acido cloridrico. Anche nell’HCl gassoso, la carica non è distribuita uniformemente. Il cloro è parzialmente negativo e l’idrogeno è parzialmente positivo.
L’idrossido di potassio, KOH, contiene un legame covalente (O-H) e uno ionico (K-O). L’idrogeno è complicato perché è in cima alla tavola periodica e anche sul lato sinistro. È abbastanza elettropositivo da formare legami ionici in alcuni casi. È appena abbastanza elettronegativo per formare legami covalenti in altri casi.
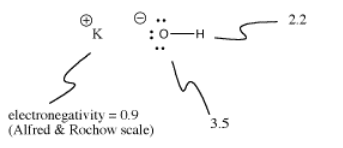
In KOH, il legame K-O è ionico perché la differenza di elettronegatività tra potassio e ossigeno è grande. La differenza di elettronegatività tra l’ossigeno e l’idrogeno non è piccola. Un legame O-H può a volte ionizzare, ma non in tutti i casi.
A volte la ionizzazione dipende da cos’altro sta succedendo in una molecola. Poiché il legame K-O nell’idrossido di potassio è ionico, il legame O-H non è molto probabile che si ionizzi. C’è già una carica negativa sull’ossigeno. La separazione di carica costa energia, quindi è più difficile mettere una seconda carica negativa sull’ossigeno ionizzando anche il legame O-H. Spesso le prime ionizzazioni nelle molecole sono molto più facili delle seconde ionizzazioni.
Esercizio \(\PageIndex{1})
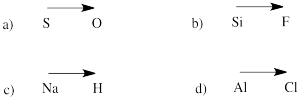
Prevedere la direzione della polarità in un legame tra gli atomi delle seguenti coppie:
a) zolfo-ossigeno b) silicio-fluoro
c) idrogeno-sodio d) cloro-alluminio
Risposta
Perché è così comune che un elemento dell’estrema sinistra della tavola periodica sia presente come catione, e che gli elementi all’estrema destra portano carica negativa, possiamo spesso assumere che un composto contenente un esempio di ciascuno avrà almeno un legame ionico.
Esercizio \(\PageIndex{2})
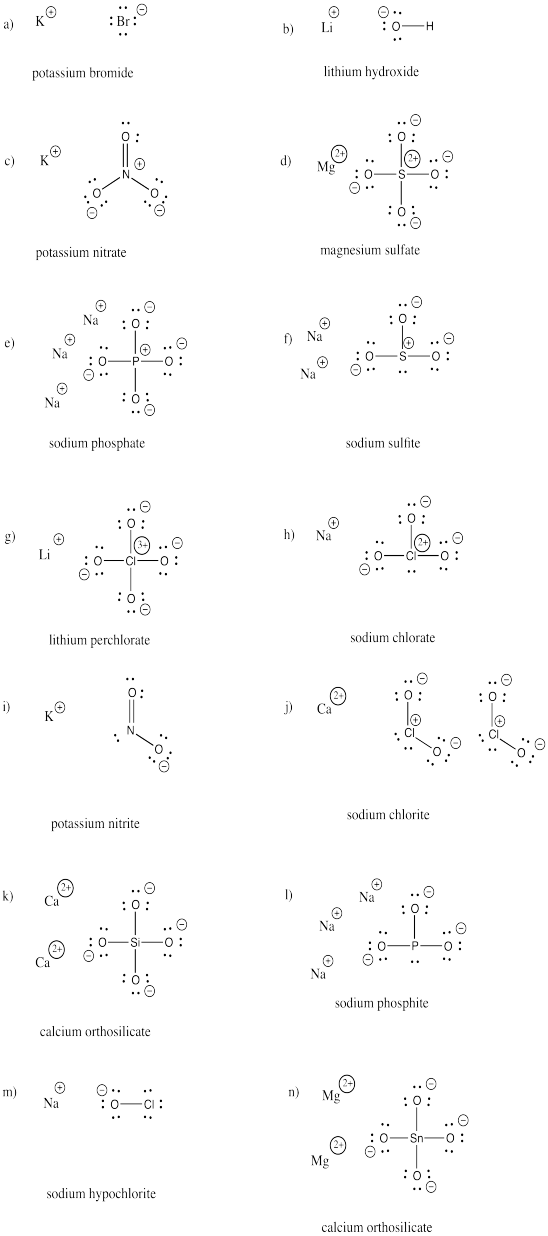
Disegna le strutture dei seguenti composti. Ognuno contiene almeno un anione e un catione.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Risposta
Esercizio \(\PageIndex{3})
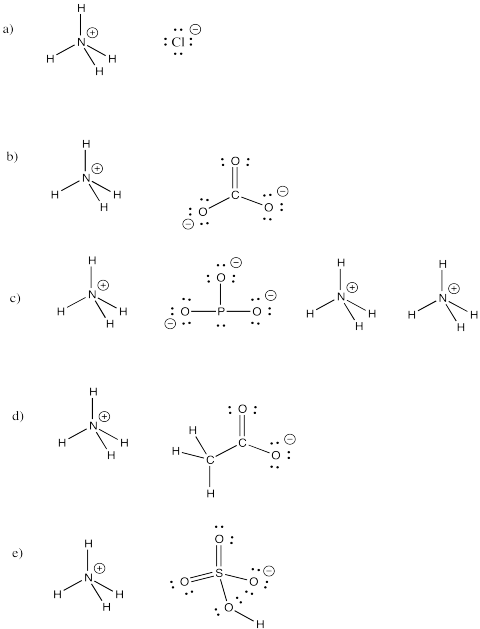
Ione ammonio, NH4+, è uno ione molecolare comune. Disegna le strutture dei seguenti composti che includono questo ione.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Risposta
Esercizio \(\PageIndex{4})
Molti anioni hanno nomi che ti dicono qualcosa sulla loro struttura.
| prefisso- o -suffisso |
significato comune |
nome esempio | formula esempio |
| -l’ide | atomo è presente come anione | cloruro | Cl – |
| -ato | atomo è presente come ossicianione; di solito una forma comune | clorato | ClO3- |
| -ite | atomo è presente come ossianione, ma con meno ossigeni (o uno “stato di ossidazione” più basso) di un’altra forma comune | clorito | ClO2- |
| per- | atomo è presente come ossianione, ma con ancora più ossigeni della forma “-ate” | perclorato | ClO4- |
| ipo- | atomo è presente come ossianione, ma con ancora meno ossigeni della forma “-ite” | ipoclorito | ClO- |
Utilizzando la tabella come guida, proporre dei nomi per i seguenti anioni:
a) Br- b) O2- c) F- d) CO32- (ossianione comune) e) NO3- (ossianione comune) f) NO2-
g) S2- h) SO42- (ossanina comune) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (ossanione comune) o) PO33- p) I- q) IO3- (ossianione comune) r) IO4-
Risposta a)
bromuro
Risposta b)
ossido
Risposta c)
fluoruro
Risposta d)
carbonato
Risposta e)
nitrato
Risposta f)
nitrito
Risposta g)
solfuro
Risposta h)
solfato
Risposta i)
solfito
Risposta j)
persolfato
Risposta k)
carburo
Risposta l)
nitruro
Risposta m)
arsenuro
Risposta n)
fosfato
Risposta o)
fosfito
Risposta p)
ioduro
Risposta q)
iodato
Risposta r)
periodato
Attribuzione
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)