Spettri di emissione atomica
Gli elettroni in un atomo tendono ad essere disposti in modo tale che l’energia dell’atomo sia la più bassa possibile. Lo stato di terra di un atomo è lo stato di energia più bassa dell’atomo. Quando a questi atomi viene data energia, gli elettroni assorbono l’energia e si spostano ad un livello energetico più alto. Questi livelli energetici degli elettroni negli atomi sono quantizzati, il che significa di nuovo che l’elettrone deve spostarsi da un livello energetico all’altro in passi discreti, piuttosto che continuamente. Uno stato eccitato di un atomo è uno stato in cui la sua energia potenziale è più alta dello stato di terra. Un atomo nello stato eccitato non è stabile. Quando ritorna allo stato di terra, rilascia l’energia che aveva precedentemente guadagnato sotto forma di radiazione elettromagnetica.
Come fanno gli atomi a guadagnare energia? Un modo è far passare una corrente elettrica attraverso un campione chiuso di un gas a bassa pressione. Dato che i livelli di energia degli elettroni sono unici per ogni elemento, ogni tubo di scarica a gas si illuminerà con un colore distintivo a seconda dell’identità del gas (vedi sotto).

Le insegne “Neon” sono esempi familiari di tubi a scarica di gas. Tuttavia, solo le insegne che brillano del colore rosso-arancione visto in figura sono effettivamente riempite di neon. Le insegne di altri colori contengono gas diversi o miscele di gas.
Gli scienziati hanno studiato il caratteristico colore rosa della scarica di gas creata dal gas idrogeno. Quando un fascio stretto di questa luce è stato visto attraverso un prisma, la luce è stata separata in quattro linee di lunghezze d’onda molto specifiche (e frequenze poiché \(\lambda\) e \nu\) sono inversamente correlati). Uno spettro di emissione atomica è il modello di linee formate quando la luce passa attraverso un prisma per separarla nelle diverse frequenze di luce che contiene. La figura qui sotto mostra lo spettro di emissione atomica dell’idrogeno.
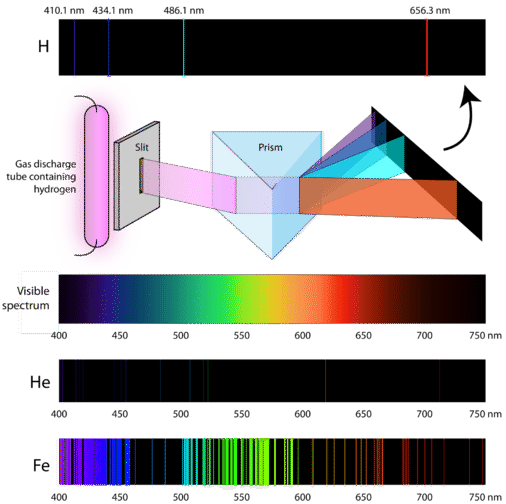
La teoria classica non era in grado di spiegare l’esistenza degli spettri di emissione atomica, noti anche come spettri di emissione lineare. Secondo la fisica classica, un atomo allo stato di terra sarebbe in grado di assorbire qualsiasi quantità di energia piuttosto che solo quantità discrete. Allo stesso modo, quando gli atomi si rilassano di nuovo in uno stato di energia inferiore, qualsiasi quantità di energia potrebbe essere rilasciata. Questo risulterebbe in quello che è noto come uno spettro continuo, dove tutte le lunghezze d’onda e le frequenze sono rappresentate. La luce bianca vista attraverso un prisma e l’arcobaleno sono esempi di spettri continui. Gli spettri di emissione atomica erano un’ulteriore prova della natura quantizzata della luce e portarono a un nuovo modello dell’atomo basato sulla teoria dei quanti.