Tendenze periodiche
Prima ci concentreremo sui singoli atomi, e penseremo alle tendenze associate alla posizione di un elemento sulla tavola periodica. Useremo come primi modelli i semplici composti organici etano, metilammina ed etanolo, ma i concetti si applicano ugualmente a biomolecole più complesse con le stesse funzionalità, per esempio le catene laterali degli aminoacidi alanina (alcano), lisina (ammina) e serina (alcol).
Tendenza periodica orizzontale in acidità e basicità:
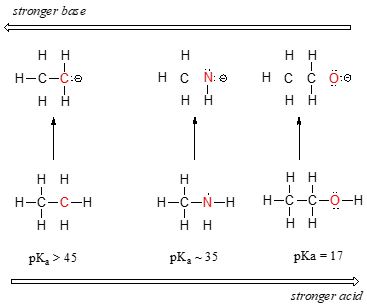
Possiamo vedere una chiara tendenza all’acidità mentre ci spostiamo da sinistra a destra lungo la seconda fila della tavola periodica dal carbonio all’azoto all’ossigeno. La chiave per capire questa tendenza è considerare l’ipotetica base coniugata in ogni caso: più stabile (più debole) è la base coniugata, più forte è l’acido. Guarda dove finisce la carica negativa in ogni base coniugata. Nella base coniugata dell’etano, la carica negativa è sostenuta da un atomo di carbonio, mentre sulla base coniugata della metilammina e dell’etanolo la carica negativa si trova su un azoto e un ossigeno, rispettivamente. Ricordate dalla sezione 2.4A che l’elettronegatività aumenta anche quando ci spostiamo da sinistra a destra lungo una riga della tavola periodica, il che significa che l’ossigeno è il più elettronegativo dei tre atomi, e il carbonio il meno.
Nota
Più un atomo è elettronegativo, più è in grado di sostenere una carica negativa. Le basi più deboli hanno cariche negative sugli atomi più elettronegativi; le basi più forti hanno cariche negative sugli atomi meno elettronegativi.
Quindi, l’anione metossido è il più stabile (energia più bassa, meno basico) delle tre basi coniugate, e l’anione etilcarbanione è il meno stabile (energia più alta, più basico). Al contrario, l’etanolo è l’acido più forte, e l’etano l’acido più debole.
Muovendosi verticalmente all’interno di una data colonna della tavola periodica, osserviamo di nuovo una chiara tendenza periodica nell’acidità. Questo è meglio illustrato con gli aloacidi e gli alogenuri: la basicità, come l’elettronegatività, aumenta man mano che si sale nella colonna.
Tendenza verticale periodica in acidità e basicità:

Conversamente, l’acidità negli aloacidi aumenta man mano che si scende nella colonna.
Per dare un senso a questa tendenza, considereremo ancora una volta la stabilità delle basi coniugate. Poiché il fluoro è l’elemento alogeno più elettronegativo, potremmo aspettarci che il fluoro sia anche lo ione alogeno meno basico. Ma in realtà, è il meno stabile, e il più basico! Si scopre che quando ci si muove verticalmente nella tavola periodica, la dimensione dell’atomo batte la sua elettronegatività per quanto riguarda la basicità. Il raggio atomico dello iodio è circa il doppio di quello del fluoro, quindi in uno ione ioduro, la carica negativa è distribuita su un volume significativamente più grande:

Questo illustra un concetto fondamentale nella chimica organica:
Le cariche elettrostatiche, sia positive che negative, sono più stabili quando sono “distribuite” su un’area più grande.
Vedremo questa idea espressa ancora e ancora durante il nostro studio della reattività organica, in molti contesti diversi. Per ora, applichiamo il concetto solo all’influenza del raggio atomico sulla forza di base. Poiché il fluoruro è il meno stabile (più basico) delle basi coniugate degli alogenuri, HF è il meno acido degli aloacidi, solo leggermente più forte di un acido carbossilico. HI, con un \(pK_a\) di circa -9, è quasi forte come l’acido solforico.
Più importante per lo studio della chimica organica biologica, questa tendenza ci dice che i tioli sono più acidi degli alcoli. Il \(pK_a\) del gruppo tiolo sulla catena laterale della cisteina, per esempio, è circa 8,3, mentre il \(pK_a\) per il gruppo alcolico sulla catena laterale della serina è dell’ordine di 17.
Ricordate il concetto di “forza motrice” che è stato introdotto nella sezione 6.2? Ricordate che la forza motrice di una reazione è solitamente basata su due fattori: la stabilità relativa della carica e l’energia di legame totale relativa. Vediamo come questo si applica ad una semplice reazione acido-base tra l’acido cloridrico e lo ione fluoruro:
Sappiamo che HCl (\(pK_a\) -7) è un acido più forte di HF (\(pK_a\) 3.2), quindi l’equilibrio per la reazione sta dalla parte del prodotto: la reazione è esergonica, e una ‘forza motrice’ spinge il reagente verso il prodotto.
Cosa spiega questa forza motrice? Consideriamo prima il fattore di carica: come abbiamo appena imparato, lo ione cloruro (sul lato prodotto) è più stabile dello ione fluoruro (sul lato reagente). Questo spiega in parte la forza motrice che va dal reagente al prodotto in questa reazione: stiamo andando da uno ione meno stabile a uno ione più stabile.
Che dire dell’energia di legame totale, l’altro fattore della forza motrice? Se si consulta una tabella delle energie di legame, si vedrà che il legame H-F sul lato del prodotto è più energetico (più forte) del legame H-Cl sul lato del reagente: 570 kJ/mol contro 432 kJ/mol, rispettivamente). Anche questo contribuisce alla forza motrice: stiamo passando da un legame più debole (meno stabile) a un legame più forte (più stabile).