24th Annual Glaucoma Report
Follow the links below to read other articles from annual update on glaucoma:
Glaucoma Care with Laser Precision
MIGS Madness: Un atlante di opzioni
Gestione della chirurgia invasiva del glaucoma
Glaucoma: Stili di vita dei ricchi e famosi antiossidanti (guadagnare 2 crediti CE)
Gli esperti non hanno ancora raggiunto un consenso su un’eziologia universalmente accettata del glaucoma. Tuttavia, sono d’accordo su questo: la riduzione della pressione intraoculare (IOP) è l’unico fattore di rischio modificabile per rallentare la sua progressione. La farmacoterapia topica è l’approccio tradizionale di prima linea, e le opzioni sono più abbondanti che mai.
Questo articolo, parte terza della nostra serie Take Charge of Glaucoma, esplora i molti farmaci che gli OD possono impiegare, con consigli su quando usare quale terapia per quali pazienti.
Autonomia precoce
I farmaci che agiscono sul sistema nervoso autonomo (cioè, Colinergici e adrenergici) sono stati alla base della terapia del glaucoma fin dal 1800.1,2 I colinergici inducono la miosi, che allunga e stimola il reticolo trabecolare (TM) per aumentare il deflusso dell’acquoso in quel punto e nel canale di Schlemm.3 I membri di questa classe includono pilocarpina, carbacholo, fisostigmina, neostigmina ed ecotiofato. Di questi, solo il pilo è ancora in uso di routine. Il trattamento mostra una risposta correlata alla dose con una diminuzione della IOP di circa il 20% quando viene prescritta QID.4
Take Charge of Glaucoma
Seguite i link qui sotto per leggere altri articoli della nostra serie sul glaucoma in quattro parti:
Parte Uno: Glaucoma: Una crociata delle cure primarie
Parte seconda: Preparare la tua cassetta degli attrezzi diagnostica
Parte quarta: Gioca un ruolo nella cura post-operatoria del glaucoma
Anche se efficace, l’uso del colinergico è limitato dai suoi effetti collaterali oculari e sistemici. Questi includono lo spasmo dei muscoli ciliari (con associato mal di testa e miopia indotta), miosi, tossicità corneale, arrossamento, uveite, possibile formazione di cataratta, depressione respiratoria e distress gastrointestinale. Inoltre, i nuovi farmaci hanno una maggiore efficacia di abbassamento della IOP, che lascia i colinergici riservati a casi specifici in cui l’effetto miotico può avere un beneficio aggiunto, come la chiusura acuta dell’angolo.
Gli agonisti adrenergici, d’altra parte, hanno un impatto sui recettori alfa o beta adrenergici (o entrambi se non selettivi). L’epinefrina, il principale agente non selettivo, riduce la IOP diminuendo prima la produzione acquosa e poi aumentando il deflusso attraverso il trabecolato.5 Purtroppo, ha un’applicazione limitata a causa dei significativi effetti collaterali sistemici. La dipivefrina, un prodrug dell’epinefrina sviluppato negli anni ’70, permette l’uso di concentrazioni molto più basse del composto madre, con meno effetti sistemici.6 Gli adrenergici non selettivi vedono oggi un uso minimo, tranne nei casi in cui altri farmaci possono essere controindicati.
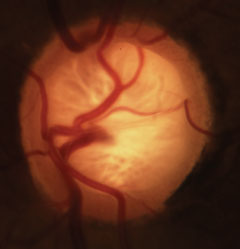
Coppettazione glaucomatosa con caratteristica perdita del bordo neuroretinico, della lamina e alterazione della vascolarizzazione. Clicca sull’immagine per ingrandirla.
Beta-bloccanti
Gli antagonisti adrenergici, o beta (β)-bloccanti, inibiscono la produzione acquosa e rappresentano lo standard con cui vengono confrontati i nuovi farmaci. In particolare, i β-bloccanti riducono l’ultrafiltrazione, che limita la disponibilità di substrato di umore acqueo disponibile per la trasmissione nella camera posteriore.1,7,8 Questi farmaci possono essere non selettivi, cioè inibiscono entrambe le isoforme dei recettori β-adrenergici (β1 e β2), o cardioselettivi, che hanno un’affinità molto maggiore per il recettore β1. Il β2 è il recettore adrenergico predominante nell’occhio, quindi gli agenti non selettivi avranno un maggiore impatto sul controllo della IOP.9,10
I β-bloccanti topici includono timololo, levobunololo, metipranololo, carteololo e betaxololo. Solo il betaxololo è cardioselettivo, il che lo rende utile in alcune controindicazioni, ma può essere meno efficace nel ridurre la IOP.11 I betabloccanti riducono la IOP dal 20% al 30% e possono essere dosati due volte al giorno. Possono anche essere dosati una volta al giorno, in particolare quando si usano soluzioni in forma di gel a causa del loro maggiore tempo di contatto oculare.12,13 Gli antagonisti adrenergici possono avere meno impatto durante il sonno, quindi bisogna fare attenzione quando i β-bloccanti sono dosati vicino all’ora di andare a letto, soprattutto se prescritti come regime giornaliero.14,15 Se i pazienti stanno assumendo β-bloccanti sistemici, l’effetto ipotensivo oculare dei β-bloccanti topici è ridotto, e altre classi di farmaci topici potrebbero essere considerate.16
Anche se questa classe di farmaci dovrebbe essere principalmente evitata in condizioni polmonari o cardiache, in casi selezionati può essere ragionevole considerare la terapia con beta-bloccanti. Tuttavia, questo dovrebbe essere fatto con il consenso dello specialista appropriato (cardiologico o polmonare).
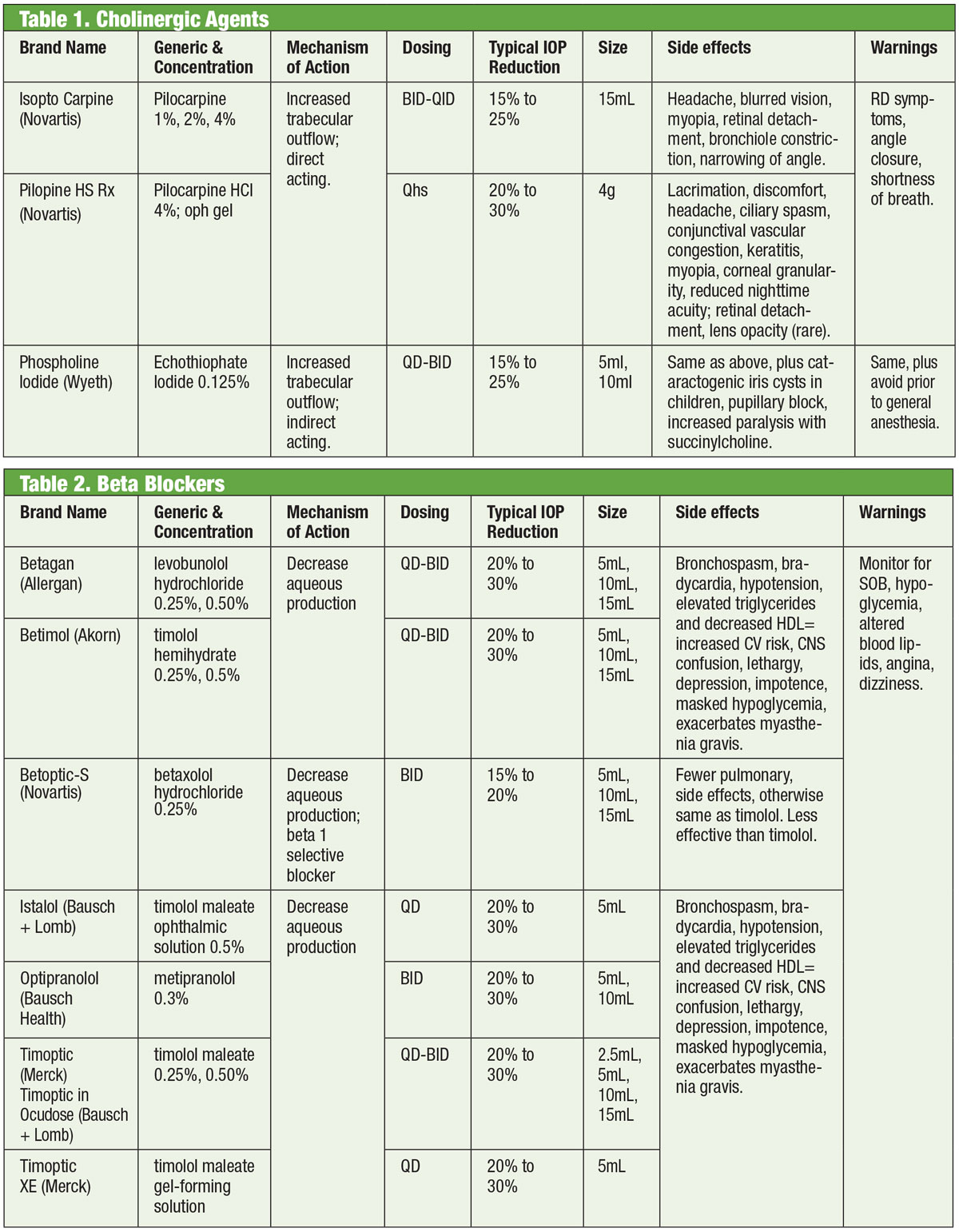
Tavole: Bruce Onofrey, OD, RPh. Clicca l’immagine per ingrandirla.
Generalmente, tuttavia, l’uso di β-bloccanti dovrebbe essere evitato in quelli con blocco atrioventricolare, bradicardia sinusale e malattia polmonare ostruttiva.17
Inibitori dell’anidrasi carbonica
I ricercatori hanno riconosciuto la capacità degli inibitori dell’anidrasi carbonica (CAI) per via orale di diminuire la IOP fin dagli anni 50.18 Essi ottengono questo risultato sopprimendo la produzione acquosa.18 Tuttavia, gli effetti collaterali sistemici (come affaticamento, disturbi gastrointestinali e parestesia) limitano il loro uso cronico nel glaucoma.18 I CAI orali sono ancora utilizzati nei casi in cui i CAI topici causano ipersensibilità o quando l’uso delle gocce è precluso, così come nei casi di chiusura acuta dell’angolo.18 I tentativi di formulare una varietà topica sono riusciti con l’introduzione della dorzolamide a metà degli anni ’90 e, subito dopo, della brinzolamide.19
Ci sono almeno sette diversi isoenzimi dell’anidrasi carbonica (CA), con la CA-II nei processi ciliari che è prevalentemente coinvolta nella produzione acquosa.18 Sia la dorzolamide che la brinzolamide sono potenti inibitori di questo isoenzima, ma hanno diverse differenze clinicamente rilevanti. Per esempio, la dorzolamide ha un pH di 5,6 mentre la brinzolamide ha un pH di 7,5. Inoltre, la brinzolamide è disponibile come sospensione. Queste sono solo alcune delle proprietà che possono spiegare gli effetti collaterali individuali dei prodotti, che possono includere bruciore nel caso della dorzolamide e visione offuscata nel caso della brinzolamide.19
Anche se i farmaci sono etichettati dalla FDA per il dosaggio TID, alcuni medici optano per la somministrazione BID. Per la brinzolamide, gli studi di fase III riportano riduzioni della IOP clinicamente equivalenti sia con regimi BID che TID.20 Altri non riportano differenze statisticamente significative tra il dosaggio BID o TID con la dorzolamide.18 In alternativa, altri consigliano il dosaggio TID per la monoterapia e il dosaggio BID quando viene usato come terapia aggiuntiva.21
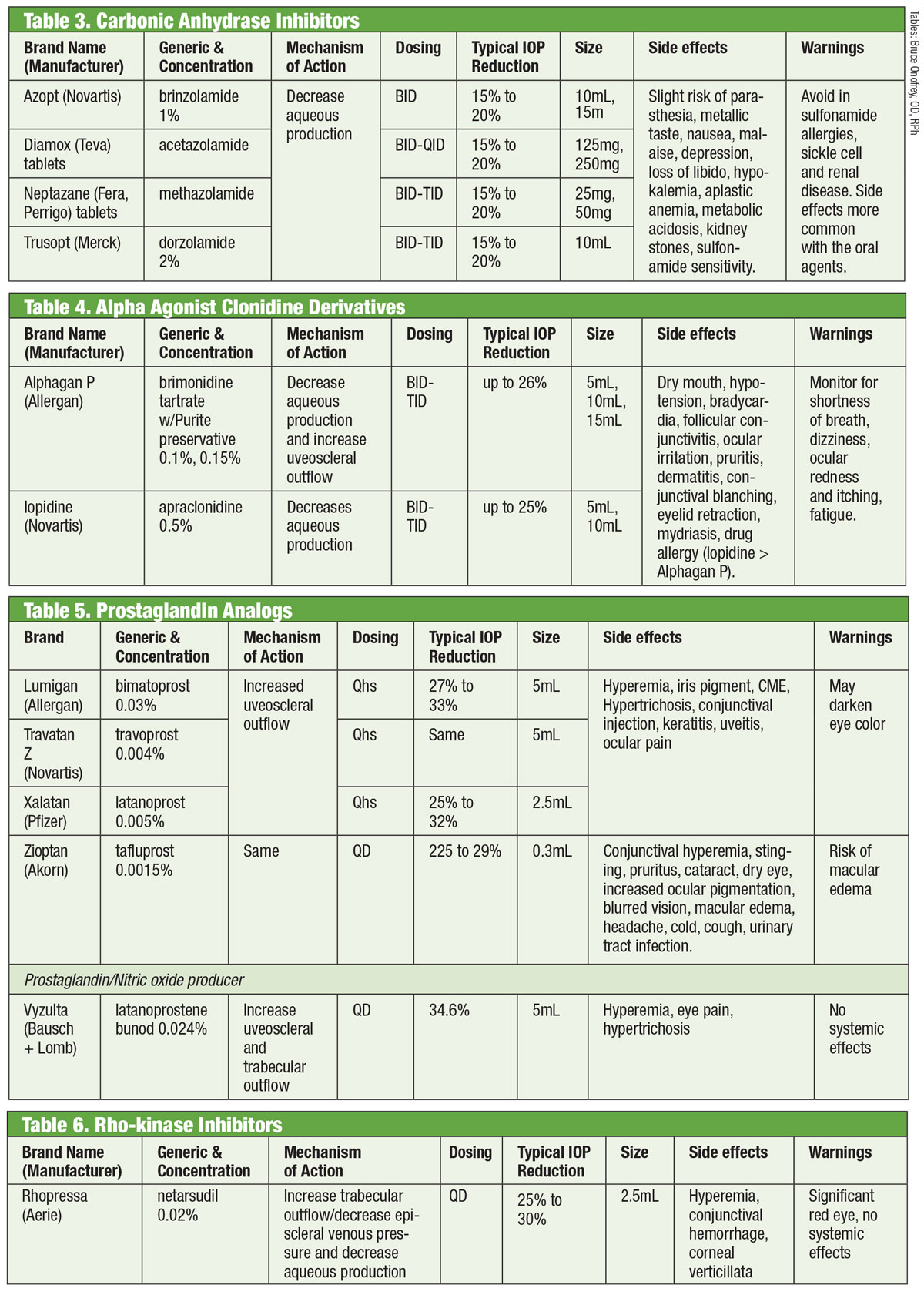
Tavole: Bruce Onofrey, OD, RPh. Clicca sull’immagine per ingrandirla.
Agonisti alfa
La clonidina ha rappresentato il primo agonista alfa (AA) efficace per abbassare la IOP. Tuttavia, anche in forma topica produceva profondi effetti collaterali sistemici di bradicardia, sedazione e ipotensione.22 La sostituzione del gruppo amidico dell’Apraclonidina diminuiva la penetrazione della barriera emato-encefalica e quindi gli effetti collaterali. Purtroppo, la sua efficacia diminuita nel tempo e una maggiore incidenza di allergia oculare la limitano all’uso a breve termine.
Introdotta nel 1997, la brimonidina è un potente AA con una selettività 32 volte maggiore per gli adrenorecettori β2 rispetto all’apraclonidina.22 Abbassa la IOP attraverso un doppio meccanismo di diminuzione della produzione acquosa e di aumento del deflusso uveosclerale.23 Come il suo predecessore, ha un notevole tasso di allergia (fino al 20%), che può verificarsi fino a otto mesi dall’inizio della terapia.22 Sono state sviluppate tre formulazioni, ognuna con un’efficacia simile: 0,2% con cloruro di benzalconio (BAK); e 0,15% e 0,1% con il conservante Purite.24 Allergan ha poi interrotto la formulazione con conservante BAK.
The Straight Dope
La marijuana medica ha fatto grande notizia di recente, grazie a una serie di cambiamenti legislativi negli Stati Uniti. Sebbene sia stata studiata come metodo per ridurre la IOP dagli anni ’70, gli investigatori l’hanno trovata capace di abbassare la IOP solo per brevi periodi di tempo. Questo, insieme al suo profilo di effetti collaterali piuttosto pesante, lo rende un povero candidato per il trattamento. Tuttavia, la ricerca dice che potrebbe avere un ruolo da svolgere per “pazienti con glaucoma allo stadio finale che hanno fallito la terapia medica massima e la chirurgia o che sono candidati poveri chirurgici.”
Sun X, Xu C, Chadha N, et al. Marijuana per il glaucoma: una ricetta per il disastro o un trattamento? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Anche se gli effetti collaterali sono per lo più correlati all’uso di prostaglandine, la letteratura mostra l’uveite anteriore indotta dalla brimonidina.25 La durata variava da sette giorni a cinque anni con una media di quasi 20 mesi.
Analoghi delle prostaglandine
Queste forniscono la più robusta riduzione della IOP di tutte le gocce migliorando il deflusso acquoso uveosclerale. Gli analoghi delle prostaglandine (PGA) si legano ai recettori nel corpo ciliare e inducono il rilassamento della muscolatura liscia, e alterano la matrice extracellulare all’interno del muscolo ciliare per aumentare il deflusso acquoso attraverso le vie uveosclerali.26 Dosate una volta al giorno, di solito al momento di coricarsi, le PGA producono una riduzione della IOP dal 30% al 35%; le opzioni includono latanoprost, bimatoprost, travoprost e tafluprost (fornito in una singola dose, opzione senza conservanti).26 L’effetto collaterale più comune delle PGA è l’iperemia congiuntivale, spesso nelle prime settimane dopo l’inizio della terapia.26 Si possono anche osservare irritazione oculare, esacerbazione di condizioni infiammatorie esistenti (edema maculare, irite), atrofia del cuscinetto di grasso periorbitale, pigmentazione della pelle perioculare, ciglia e iride e ipertricosi.26
Una nuova variante nella categoria degli analoghi delle prostaglandine è il latanoprostene bunod 0,024%. Questo composto ha un doppio meccanismo: aumentare il deflusso uveosclerale e migliorare il deflusso del reticolo trabecolare attraverso l’impatto dell’ossido nitrico.27 L’occhio scompone il latanoprostene bunod due volte per produrre i componenti attivi acido latanoprost e ossido nitrico.28 Quest’ultimo influisce su una via di segnalazione che rilassa i componenti contrattili nel trabecolato, il che aumenta il deflusso.28 L’impatto aggiuntivo fa scendere la IOP >1 mm Hg rispetto al solo latanoprost in più punti temporali, con una riduzione totale della IOP che va da 7,5 mm Hg a 9,1 mm Hg. Gli effetti collaterali con latanoprostene bunod erano paragonabili a quelli del latanoprost da solo, con forse meno pigmentazione perioculare e ipertricosi, secondo gli investigatori.28,29
Inibitori di ROCK
In un occhio normale, la principale via di drenaggio dell’umore acqueo è il trabecolato. La resistenza all’umore acqueo attraverso questa struttura è aumentata nei pazienti con glaucoma, aumentando la IOP.30 Fino a poco tempo fa, i farmaci per il glaucoma non riuscivano a colpire questa struttura. Questo è cambiato nel 2017 con l’introduzione di Rhopressa (netarsudil 0,02%, Aerie), un inibitore della rho-chinasi (ROCK).
Tabella: Bruce Onofrey, OD, RPh. Clicca sull’immagine per ingrandirla.
La Rho-chinasi è ampiamente espressa in molti tessuti, compreso il trabecolato, dove promuove l’assemblaggio delle fibre di stress di actina e regola la contrazione cellulare.31 Gli inibitori della ROCK aumentano il deflusso dell’acqua diminuendo la contrazione cellulare guidata da actina e miosina e riducendo la produzione di proteine della matrice extracellulare.32 Rhopressa ha anche un’azione inibitoria contro il trasportatore della norepinefrina (NET), rendendolo un inibitore ROCK/NET. Il meccanismo NET può essere il risultato di un ridotto flusso di sangue al corpo ciliare attraverso la vasocostrizione indotta dalla norepinefrina, che si traduce in una ridotta produzione acquosa.33 Inoltre, netarsudil diminuisce anche la pressione venosa episclerale (EVP), fornendo così molteplici vie per la riduzione della IOP.32 L’effetto collaterale oculare più comune è l’iperemia oculare (circa la metà dei pazienti trattati), che per la maggior parte è lieve, transitoria e auto-risolvente.32
Da notare che lo stesso rho gioca un ruolo importante nella crescita e nella guida degli assoni, così come nella regolazione della sopravvivenza e della morte dei neuroni.34 I ricercatori hanno scoperto che, dopo una lesione del nervo ottico, l’applicazione topica di netarsudil riduce la morte delle cellule gangliari della retina e promuove la rigenerazione assonale.34
Mettere insieme i pezzi
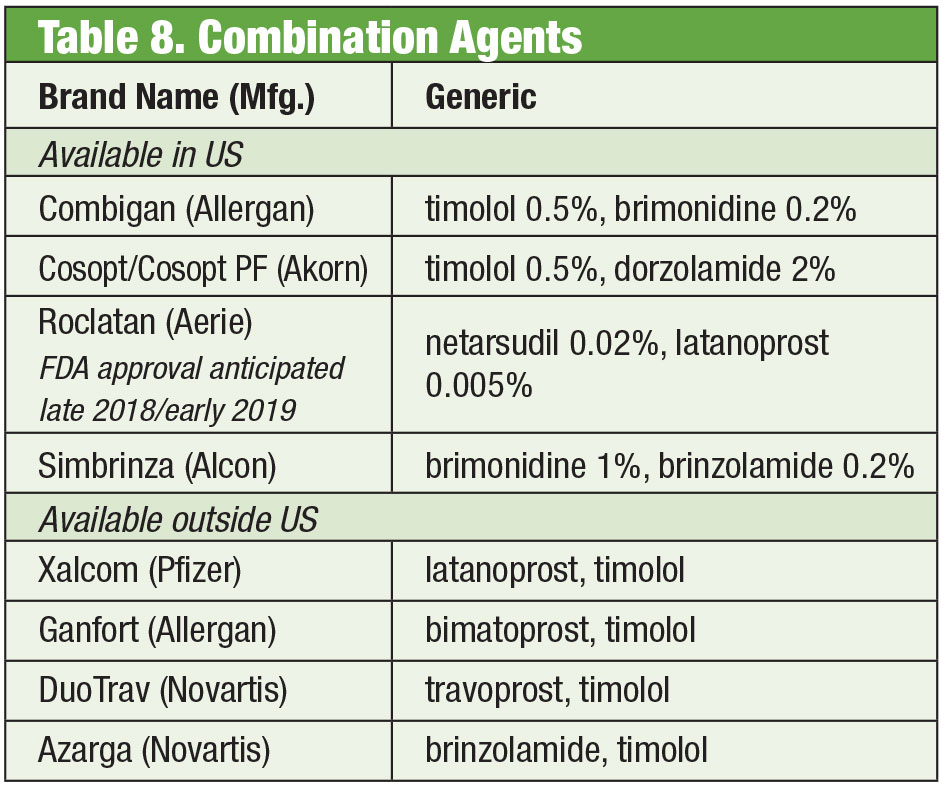
A volte i pazienti hanno bisogno di più di quello che offrono i prodotti di serie. La sensibilità del paziente o la tossicità della superficie oculare dovuta all’uso cronico di conservanti può portare alla ricerca di alternative. Alcuni farmaci composti sono disponibili senza conservanti. Se la conformità è un problema, queste miscele possono contenere fino a quattro farmaci in un unico flacone. Inoltre, molte combinazioni fisse sono state usate efficacemente fuori dagli Stati Uniti, ma non sono attualmente approvate dalla FDA; il compounding dà ai medici americani accesso a questi regimi. Se il costo è una limitazione, il compounding potrebbe essere un ulteriore vantaggio. Mentre il prodotto composto spesso non è coperto dal piano assicurativo del paziente, il prezzo di uno o due prodotti combinati può essere più conveniente di quello di più opzioni di farmaci singoli, anche formulazioni generiche. Due farmacie di compounding offrono più varianti preimpostate: Simple Drops di Imprimis Pharmaceuticals e la linea di prodotti Omni di Ocular Science. Ulteriori personalizzazioni sono possibili anche da ciascuna di esse.
Anche se i singoli agenti sono approvati dalla FDA, particolari combinazioni potrebbero non esserlo. Spetta al professionista soppesare i rischi e i benefici della conformità.
Prodotti per glaucoma composti:
Gocce semplici (Imprimis Pharmaceuticals)
Tutti disponibili senza conservanti.
– Tim-Lat PF (timololo/latanoprost)
– Brim-Dor PF (brimonidina/dorzolamide)
– Tim-Brim-Dor PF (timololo/brimonidina/dorzolamide)
– Tim-Dor-Lat PF (timololo/dorzolamide/latanoprost)
– Tim-Brim-Dor-Lat PF (timololo/brinzolamide/dorzolamide/latanoprost)
– Dor-Tim (dorzolamide/timololo)
– Dorzolamide PF
– Latanoprost PF
Omni Drops (Ocular Science)
Contiene benzalconio cloruro, ma in concentrazioni inferiori (0.001%) rispetto alle comuni formulazioni generiche (0,002%).
– Timololo/latanoprost
– Timololo/brimonidina/dorzolamide (formula AM)*
– Timololo/brimonidina/dorzolamide/latanoprost (formula PM)*
* Destinato ad essere usato all’unisono, con la versione AM senza la prostaglandina, che viene comunemente dosata solo una volta al giorno.
Prodotti combinati fissi
Nonostante l’efficacia di questi singoli prodotti, è comune per molti pazienti con glaucoma richiedere più terapie per controllare la loro condizione.35 Quando è necessaria una doppia terapia, può essere meglio offrire lo stesso dispenser, promuovendo una maggiore conformità e riducendo l’impatto sulla superficie oculare dalla tossicità.36 Il timololo si abbina alla brimonidina (come Combigan, Allergan) e alla dorzolamide (come Cosopt, Akorn), entrambe dosate due volte al giorno, con un’opzione senza conservanti disponibile per il prodotto timololo-dorzolamide. Un’altra combinazione due volte al giorno – Simbrinza – associa brimonidina e dorzolamide. Le combinazioni fisse mostrano una buona efficacia sia come terapia primaria che in aggiunta alle PGA. Gli effetti collaterali sono paragonabili ai singoli componenti.
Aderenza/Percezione del paziente
Anche se la decisione di raccomandare il trattamento può essere complessa e dipende da molti fattori, una volta che il medico e il paziente concordano di iniziare la terapia, alcuni fatti di base devono essere riconosciuti e devono essere impiegati principi fondamentali.
Clicca sull’immagine per ingrandirla.
La progressione del campo visivo e la gravità della malattia sono legate alla scarsa aderenza.37 Secondo uno studio, i pazienti con condizioni mediche croniche utilizzano in media dal 30% al 70% delle dosi di farmaci prescritte e il 50% interrompe i farmaci entro i primi mesi di terapia.38 L’aderenza ai farmaci per il glaucoma è simile a quella di altre condizioni croniche.38 Di conseguenza, può esistere un divario efficacia-efficacia in cui, anche se è stato dimostrato che i farmaci topici sono efficaci in grandi studi clinici, in pratica possono essere inefficaci a causa della non conformità del paziente.39
I fattori principali che contribuiscono alla scarsa aderenza nel glaucoma sono, tra gli altri, il profilo degli effetti collaterali dei farmaci, il costo della terapia, l’educazione del paziente e il rapporto medico-paziente.40 Inoltre, la malattia può essere asintomatica fino a tarda età, con mancanza di consapevolezza della perdita del campo visivo.41
E ora qualcosa di completamente diverso
I farmaci sono stati la spina dorsale della gestione del glaucoma per oltre un secolo, e lo sviluppo di nuovi farmaci continua senza sosta. Ma alcuni ricercatori stanno cercando alternative oltre la bottiglia. Gli occhiali incorporati con una bobina elettromagnetica, accoppiati con una lente a contatto contenente una traccia d’oro, potrebbero un giorno aiutare ad abbassare la IOP. Sviluppato da una società chiamata Bionode, la combinazione è progettata per generare una corrente elettrica che scorre attraverso i muscoli ciliari per stimolare il percorso di drenaggio naturale e diminuire la IOP.
American Academy of Oftalmologia. Gli occhiali da vista potrebbero un giorno trattare il glaucoma. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accessed July 3, 2018.
Un’ulteriore barriera all’aderenza è la difficoltà nell’instillazione delle gocce e nel programma di dosaggio.42 Infatti, fino all’80% dei pazienti contamina le gocce toccandosi il viso, fino al 61% non instilla esattamente una goccia e, cosa più critica, fino al 37% manca l’occhio con la goccia.43 Il medico non deve mai dare per scontato che il paziente sia abile nell’instillazione delle gocce. Prima di iniziare la terapia con le gocce, insegnare al paziente come instillare le gocce in modo appropriato e farglielo dimostrare con successo prima di lasciare lo studio. Questo può essere efficacemente delegato ad un tecnico optometrista e rinforzato con un manuale educativo sulla tecnica (stampabile in PDF su www.glaucoma.org/treatment/eyedrop-tips.php) così come l’uso di video come quello prodotto dalla Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Se il paziente ha difficoltà significative nell’instillare il collirio, un aiuto meccanico per il dosaggio può migliorare le probabilità di successo. L’aderenza al programma di dosaggio corretto migliora con l’uso di promemoria automatizzati basati sulla telecomunicazione e di applicazioni di promemoria per smartphone e tablet.44,45 Una combinazione di educazione in ufficio, definizione degli obiettivi, regime di gocce semplificato e tecnologia dovrebbe essere adottata per migliorare l’aderenza.46 Affrontare le barriere note all’aderenza ai farmaci è un primo passo necessario verso il successo.
Ridurre la pressione
La IOP è l’unico fattore di rischio glaucomatoso modificabile conosciuto e la sua riduzione ha innegabilmente dimostrato di ridurre il rischio di progressione della malattia.47,48 Ridurre efficacemente la IOP diventa quindi l’obiettivo nella gestione dei pazienti con glaucoma. Dopo che la malattia è stata accuratamente classificata, in genere si stabilisce un obiettivo terapeutico. I modelli di pratica preferiti negli Stati Uniti suggeriscono l’uso di un intervallo di IOP target che il medico ritiene possa ridurre prospetticamente il rischio di cecità per tutta la vita dei pazienti, minimizzando al contempo l’onere legato al trattamento.49-52
Anche se più metodologie possono aiutare a determinare una IOP target iniziale (IOP di soglia, calcolata, unica per tutti), il metodo più semplice e basato sull’evidenza è quello di ridurre la IOP di una percentuale dal picco diurno basale della IOP a cui si verifica il danno al nervo ottico. La IOP è dinamica e presenta fluttuazioni a breve e lungo termine, il che rende la tonometria attualmente disponibile non perfettamente riproducibile. Pertanto, si raccomanda al medico di ottenere più letture della PIO in diversi momenti della giornata prima di iniziare il trattamento per tentare di stabilire un picco diurno della PIO su cui basare l’intervallo target.53-55 Tuttavia, se non si ottengono più curve della PIO nelle 24 ore, è improbabile che si riesca a rilevare un vero picco. In definitiva, il medico dovrà valutare il successo del trattamento riducendo il tasso di progressione sui test strutturali e funzionali.48,56,57
Le riduzioni percentuali della IOP raccomandate come obiettivo vanno dal 20% al 50% a seconda della condizione (es, sospetto di glaucoma, ipertensione oculare, glaucoma a tensione normale, glaucoma ad alta tensione, glaucoma a chiusura d’angolo) la gravità della malattia di base e l’aspettativa di vita.58-61
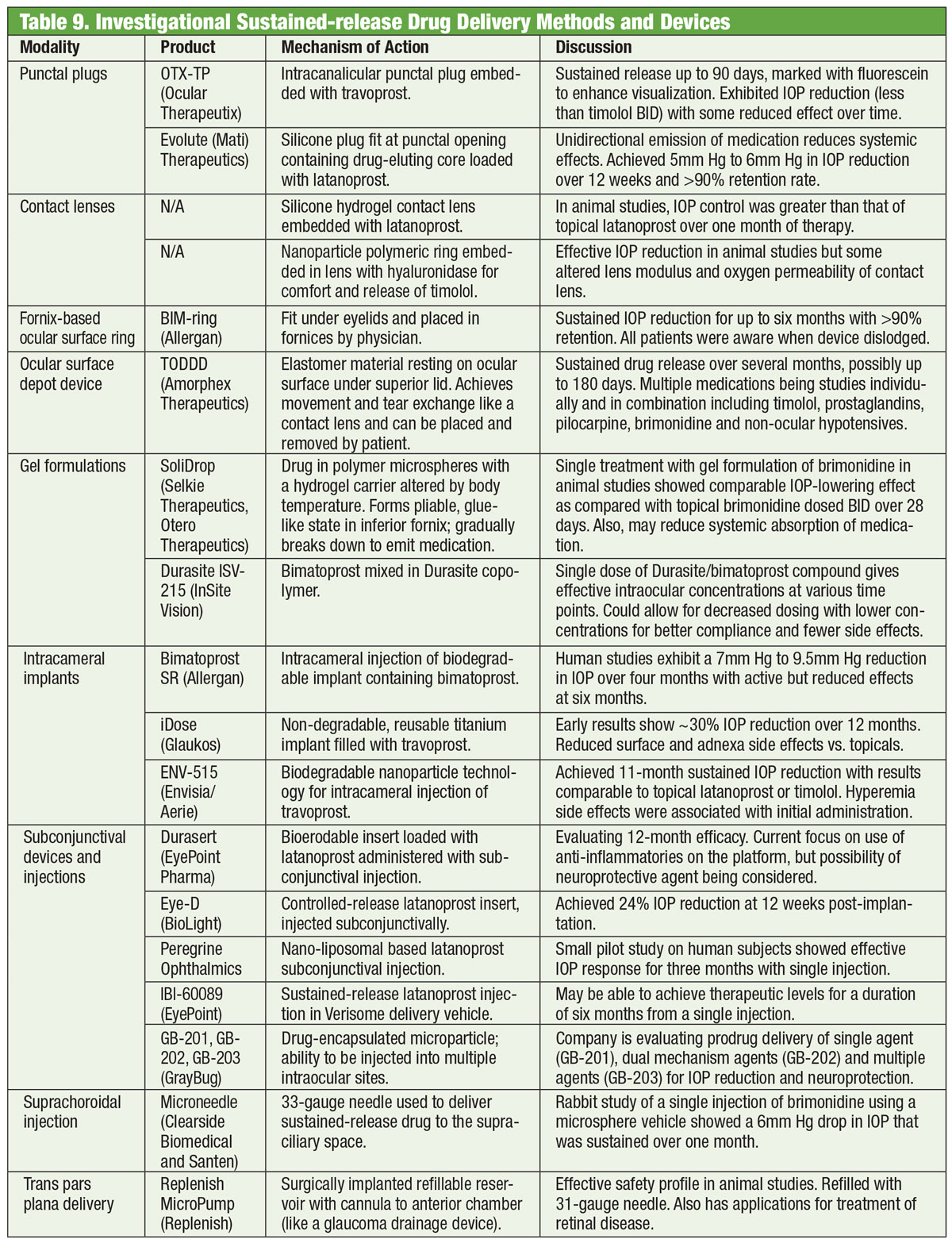
Tabella: Bruce Onofrey, OD, RPh. Clicca sull’immagine per ingrandirla.
Iniziare
Le PGA sono approvate per il trattamento di prima linea negli Stati Uniti e sono più efficaci nell’abbassare la IOP, hanno un profilo di effetti collaterali relativamente limitato e sono dosate meno frequentemente (una volta al giorno) di altre classi di farmaci.62,63
Una volta selezionato un agente specifico, il paziente dovrebbe essere rivisto tra non più di quattro settimane per valutare l’efficacia della goccia, per prevenire eventuali eventi avversi che possono sorgere, garantire l’aderenza del paziente e rafforzare il valore del trattamento.
In definitiva, un’educazione adeguata e un follow-up vigile con test strutturali e funzionali aiuterà a minimizzare la perdita della vista.
Il dott. Dorkowski è il coordinatore clinico per il programma di assistenza domiciliare/assistita presso SCO.
Il dott. Williamson è il supervisore della residenza presso il Memphis VA Medical Center.
Il dottor Rixon è un assistente presso il Memphis VA ed è un membro della Optometric Glaucoma Society.
Il dott. Onofrey è autore del The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. Gli agenti bloccanti beta-adrenergici e il trattamento del glaucoma. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. Una storia della farmacologia del glaucoma. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Effetti diretti degli agenti muscarinici sulle vie di deflusso negli occhi umani. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Il meccanismo d’azione dei farmaci adrenergici nel glaucoma. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinefrina: un nuovo pro-farmaco nel trattamento del glaucoma. Oftalmologia. 1978;85(3):268-75.
7. Neufeld AH. Studi sperimentali sul meccanismo d’azione del timololo. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Il meccanismo del timololo nell’abbassamento della pressione intraoculare: nell’occhio normale. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Recettori beta adrenergici nei processi ciliari pigmentati. Br J Ophthalmol. 1982;66:788-92.
10. Cera MB, Molinoff PB. Distribuzione e proprietà dei recettori beta-adrenergici nel corpo ciliare umano. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Un confronto in doppio mascherato di betaxololo vs timololo nel trattamento del glaucoma ad angolo aperto. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Beta-bloccanti oftalmici dopo il timololo. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Valutazione del timololo nel glaucoma cronico ad angolo aperto: Una volta al giorno vs due volte al giorno. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Effetti di timololo, epinefrina e acetazolamide sul flusso acquoso durante il sonno. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Variazione circadiana della pressione intraoculare con i beta-bloccanti. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Effetti della terapia beta-bloccante sistemica sull’efficacia e la sicurezza della brimonidina e del timololo topici. Gruppi di studio brimonidina 1 e 2. Oftalmologia. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucoma e malattie sistemiche. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Proprietà farmacologiche e ipotensive oculari degli inibitori topici dell’anidrasi carbonica. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Consegna di farmaci topici nell’occhio: dorzolamide. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide sospensione oftalmica: una revisione della sua farmacologia e l’uso nel trattamento del glaucoma ad angolo aperto e ipertensione oculare. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Confronto dell’effetto additivo di abbassamento della pressione intraoculare di latanoprost e dorzolamide quando aggiunto a timololo in pazienti con glaucoma ad angolo aperto o ipertensione oculare: uno studio randomizzato, open-label, multicentrico in Grecia. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidenza dell’allergia alla brimonidina in pazienti precedentemente allergici all’apraclonidina. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Efficacia e sicurezza della brimonidina come terapia aggiuntiva per i pazienti con pressione intraoculare elevata in un ampio studio comunitario in aperto. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidina-purite 0,1% versus brimonidina-purite 0,15% due volte al giorno nel glaucoma o nell’ipertensione oculare: uno studio randomizzato di 12 mesi. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Uveite anteriore indotta da brimonidina. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Aggiornamento sul meccanismo d’azione delle prostaglandine topiche per la riduzione della pressione intraoculare. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Efficacia del latanoprostene bunod 0,024% rispetto al timololo 0,5% nell’abbassare la pressione intraoculare nelle 24 ore. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod soluzione oftalmica 0,024% per l’abbassamento della IOP nel glaucoma e nell’ipertensione oculare. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Confronto tra latanoprostene bunod 0,024% e timololo maleato 0,5% nel glaucoma ad angolo aperto o nell’ipertensione oculare: Lo studio LUNAR. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Il reticolo trabecolare: Una revisione di base di forma e funzione. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Accessed June 29, 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Scoperta dell’inibitore ROCK netarsudil per il trattamento del glaucoma ad angolo aperto. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Due studi clinici di fase 3 che confrontano la sicurezza e l’efficacia di netarsudil a timololo in pazienti con elevata pressione intraoculare: rho kinase elevated iop treatment trial 1 e 2 (ROCKET-1 e ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Scoperta e sviluppo preclinico di netarsudil, un nuovo agente ipotensivo oculare per il trattamento del glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. La somministrazione topica di un inibitore di roccia/net promuove la sopravvivenza delle cellule gangliari retiniche e la rigenerazione degli assoni dopo la lesione del nervo ottico. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Modelli di terapia aggiuntiva in pazienti con glaucoma utilizzando analoghi della prostaglandina. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Combinazioni fisse. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. I tassi di aderenza e la progressione del campo visivo glaucomatoso sono correlati? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Utilizzando i dati delle dichiarazioni farmaceutiche per studiare l’aderenza ai farmaci per il glaucoma: metodologia e risultati del Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Efficacia dei farmaci che abbassano la pressione intraoculare determinata dal washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Perché la gente (ancora) diventa cieca dal glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Un punto di vista sul glaucoma: lo stiamo vedendo chiaramente? Occhio. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. Le barriere più comuni all’aderenza dei farmaci per il glaucoma: Un sondaggio trasversale. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instillazione di gocce e glaucoma. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: Lo studio di promemoria automatizzato di dosaggio. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. Il glaucoma occhio Wills app: Interesse dei pazienti e dei loro caregiver in un’applicazione per il glaucoma basata su smartphone e tablet. J Glaucoma. 2016;25(9):e787-e791.
46. Giuseppe A, Pasquale LR. Attributi associati all’aderenza alla terapia medica del glaucoma e ai suoi effetti sugli esiti del glaucoma: Una revisione basata sull’evidenza e potenziali strategie per migliorare l’aderenza. Semin Ophthalmol. 2017;32(1):86-90.
47. Clemente CI, Bhartiya S, Shaarawy T. Nuove prospettive sulla pressione intraoculare target. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalizzare la pressione intraoculare: pressione intraoculare target nell’impostazione del monitoraggio della pressione intraoculare di 24 ore. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Pressione target nella terapia del glaucoma. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Cura del paziente con glaucoma ad angolo aperto. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Abbassamento aggressivo precoce della pressione intraoculare, pressione intraoculare target e un nuovo concetto di cura del glaucoma. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Oftalmologia. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Modelli di pressione intraoculare diurna non sono ripetibili a breve termine in individui sani. Oftalmologia. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Riproducibilità a lungo termine dei modelli di pressione intraoculare diurna in pazienti con glaucoma. Oftalmologia. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Variabilità giorno per giorno nella pressione intraoculare nel glaucoma e nell’ipertensione oculare. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilità clinica del monitoraggio della pressione intraoculare al di fuori del normale orario di ufficio nei pazienti con glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Pressione intraoculare di picco e progressione glaucomatosa nel glaucoma primario ad angolo aperto. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: uno studio randomizzato determina che i farmaci ipotensivi oculari topici ritardano o impediscono l’insorgenza del glaucoma primario ad angolo aperto. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Riduzione della pressione intraoculare e progressione del glaucoma: Risultati del Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Lo studio avanzato di intervento sul glaucoma (AGIS): Il rapporto tra controllo della pressione intraoculare e deterioramento del campo visivo. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progressione del campo visivo nello studio collaborativo di trattamento iniziale del glaucoma. L’impatto del trattamento e di altri fattori basali. Oftalmologia. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost nel trattamento del glaucoma. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impatto dell’introduzione di latanoprost generico sull’aderenza del farmaco glaucoma. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. Un confronto randomizzato e controllato di latanoprostene bunod e latanoprost 0,005% nel trattamento dell’ipertensione oculare e del glaucoma ad angolo aperto: Lo studio VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.