Obiettivi di apprendimento
- Descrivere le caratteristiche di un gas.
Le tre fasi (o stati) comuni della materia sono i gas, i liquidi e i solidi. I gas hanno la densità più bassa dei tre, sono altamente comprimibili e riempiono completamente qualsiasi contenitore in cui sono posti. I gas si comportano così perché le loro forze intermolecolari sono relativamente deboli, quindi le loro molecole si muovono costantemente indipendentemente dalle altre molecole presenti. I solidi, al contrario, sono relativamente densi, rigidi e incomprimibili perché le loro forze intermolecolari sono così forti che le molecole sono essenzialmente bloccate in posizione. I liquidi sono relativamente densi e incomprimibili, come i solidi, ma scorrono facilmente per adattarsi alla forma dei loro contenitori, come i gas. Possiamo quindi concludere che la somma delle forze intermolecolari nei liquidi è tra quelle dei gas e dei solidi. La figura 10.1.1 confronta i tre stati della materia e illustra le differenze a livello molecolare.
Figura 10.1.1 Una sostanza biatomica (O2) negli stati solido, liquido e gassoso
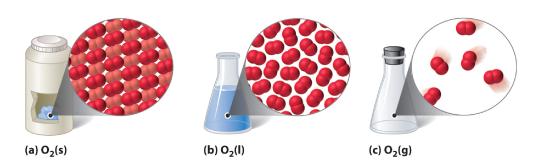
(a) L’O2 solido ha un volume e una forma fissa e le molecole sono impacchettate strettamente insieme. (b) L’O2 liquido si conforma alla forma del suo contenitore ma ha un volume fisso; contiene molecole relativamente compatte. (c) L’O2 gassoso riempie completamente il suo contenitore – indipendentemente dalla dimensione o dalla forma del contenitore – e consiste di molecole ampiamente separate.
Lo stato di una data sostanza dipende fortemente dalle condizioni. Per esempio, H2O si trova comunemente in tutti e tre gli stati: ghiaccio solido, acqua liquida e vapore acqueo (la sua forma gassosa). Nella maggior parte delle condizioni, incontriamo l’acqua come liquido essenziale per la vita; la beviamo, cuciniamo con essa e ci facciamo il bagno. Quando la temperatura è abbastanza fredda da trasformare il liquido in ghiaccio, possiamo sciare o pattinare su di esso, impacchettarlo in una palla di neve o in un cono di neve, e persino costruirci abitazioni. Vapore acqueoLa distinzione tra un gas e un vapore è sottile: il termine vapore si riferisce alla forma gassosa di una sostanza che è un liquido o un solido in condizioni normali (25°C, 1,0 atm). L’azoto (N2) e l’ossigeno (O2) sono quindi indicati come gas, ma l’acqua gassosa nell’atmosfera è chiamata vapore acqueo. è un componente dell’aria che respiriamo, ed è prodotto ogni volta che riscaldiamo l’acqua per cucinare il cibo o fare il caffè o il tè. Il vapore acqueo a temperature superiori a 100°C è chiamato vapore. Il vapore è usato per azionare grandi macchinari, comprese le turbine che generano elettricità. Le proprietà dei tre stati dell’acqua sono riassunte nella tabella 10.1.1
La struttura geometrica e le proprietà fisiche e chimiche di atomi, ioni e molecole di solito non dipendono dal loro stato fisico; le singole molecole d’acqua nel ghiaccio, nell’acqua liquida e nel vapore, per esempio, sono tutte identiche. Al contrario, le proprietà macroscopiche di una sostanza dipendono fortemente dal suo stato fisico, che è determinato dalle forze intermolecolari e dalle condizioni come la temperatura e la pressione.
La figura 10.1.2 mostra le posizioni nella tavola periodica di quegli elementi che si trovano comunemente negli stati gassoso, liquido e solido. Eccetto l’idrogeno, gli elementi che si trovano naturalmente come gas sono sul lato destro della tavola periodica. Di questi, tutti i gas nobili (gruppo 18) sono gas monoatomici, mentre gli altri elementi gassosi sono molecole biatomiche (H2, N2, O2, F2 e Cl2). L’ossigeno può anche formare un secondo allotropo, la molecola triatomica altamente reattiva dell’ozono (O3), che è anche un gas. Al contrario, il bromo (come Br2) e il mercurio (Hg) sono liquidi in condizioni normali (25°C e 1,0 atm, comunemente chiamati “temperatura e pressione ambiente”). Il gallio (Ga), che fonde a soli 29,76°C, può essere convertito in un liquido semplicemente tenendone un contenitore in mano o tenendolo in una stanza non climatizzata in una calda giornata estiva. Il resto degli elementi sono tutti solidi in condizioni normali.
Figura 10.1.2 Elementi che si presentano naturalmente come gas, liquidi e solidi a 25°C e 1 atm
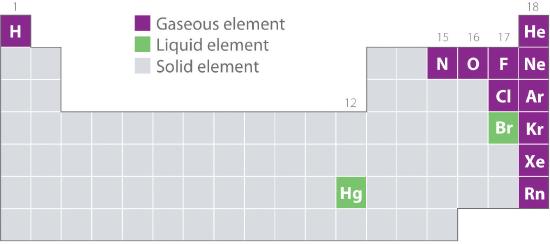
I gas nobili e il mercurio si presentano come specie monoatomiche, mentre tutti gli altri gas e il bromo sono molecole biatomiche.
Molti degli elementi e dei composti che abbiamo incontrato finora si trovano tipicamente come gas; alcuni dei più comuni sono elencati nella Tabella 10.1.2 . Le sostanze gassose includono molti idruri binari, come gli alogenuri di idrogeno (HX); idruri dei calcogeni; idruri degli elementi del gruppo 15 N, P, e As; idruri degli elementi del gruppo 14 C, Si, e Ge; e diborano (B2H6). Inoltre, molti degli ossidi covalenti semplici dei non metalli sono gas, come CO, CO2, NO, NO2, SO2, SO3, e ClO2. Anche molti composti organici a bassa massa molecolare sono gas, compresi tutti gli idrocarburi con quattro o meno atomi di carbonio e molecole semplici come l’etere dimetilico, il cloruro di metile (CH3Cl), la formaldeide (CH2O) e l’acetaldeide (CH3CHO). Infine, i refrigeranti, come i clorofluorocarburi (CFC) e gli idroclorofluorocarburi (HCFC) sono gas che possono essere facilmente liquefatti per compressione e a loro volta i liquidi possono essere trasformati in gas diminuendo la pressione sui liquidi. Il cambiamento di fase da liquido a gas nei tubi all’interno del frigorifero raffredda, mentre la compressione nelle bobine sul fondo o sul retro del frigorifero riscalda la stanza. L’ammoniaca e la SO2 sono altri gas comprimibili che sono stati usati come refrigeranti ma non possono essere usati nelle case a causa della loro natura velenosa. L’ammoniaca è ancora usata come refrigerante in grandi ambienti commerciali a causa della sua efficienza e del suo basso costo.
Tutte le sostanze gassose menzionate in precedenza (a parte i gas nobili monoatomici) contengono legami covalenti o polari e sono molecole non polari o polari. Al contrario, le forti attrazioni elettrostatiche nei composti ionici, come NaBr (punto di ebollizione = 1390°C) o LiF (punto di ebollizione = 1673°C), impediscono loro di esistere come gas a temperatura e pressione ambiente. Inoltre, i membri più leggeri di qualsiasi famiglia di composti sono molto probabilmente dei gas, e i punti di ebollizione dei composti polari sono generalmente maggiori di quelli dei composti non polari di massa molecolare simile. Pertanto, in una data serie di composti, i membri più leggeri e meno polari sono quelli che più probabilmente sono gas. Con relativamente poche eccezioni, tuttavia, i composti con più di circa cinque atomi del periodo 2 o inferiore sono troppo pesanti per esistere come gas in condizioni normali.
Nota lo schema
Le sostanze gassose spesso contengono legami covalenti o polari, esistono come molecole non polari o leggermente polari, hanno masse molecolari relativamente basse, e contengono cinque o meno atomi dei periodi 1 o 2.
Mentre i gas hanno una vasta gamma di usi, si ritiene che un uso particolarmente truce di una sostanza gassosa sia stato impiegato dai persiani sulla città romana di Dura nella Siria orientale nel terzo secolo d.C. I persiani scavarono un tunnel sotto le mura della città per entrare e conquistare la città. Le prove archeologiche suggeriscono che quando i romani risposero con contro-tunnel per fermare l’assedio, i persiani accesero cristalli di bitume e zolfo per produrre un gas denso e velenoso. È probabile che mantici o camini abbiano distribuito i fumi tossici. I resti di circa 20 soldati romani sono stati scoperti alla base delle mura della città all’ingresso di un tunnel alto meno di 2 m e lungo 11 m. Poiché è altamente improbabile che i persiani abbiano potuto massacrare così tanti romani all’ingresso di uno spazio così ristretto, gli archeologi ipotizzano che gli antichi persiani abbiano usato la guerra chimica per conquistare con successo la città.
Esempio 10.1.1
Quali composti si prevede siano gas a temperatura e pressione ambiente?
- cicloesene
- carbonato di litio
- clobutano
- ossido di vanadio (III)
- acido benzoico (C6H5CO2H)
Dati: composti
Chiesto: stato fisico
Strategia:
A Decidi se ogni composto è ionico o covalente. Un composto ionico è molto probabilmente un solido a temperatura e pressione ambiente, mentre un composto covalente può essere un solido, un liquido o un gas.
B Tra i composti covalenti, quelli che sono relativamente non polari e hanno basse masse molecolari sono molto probabilmente gas a temperatura e pressione ambiente.
Soluzione:
A Il carbonato di litio è Li2CO3, contenente ioni Li+ e CO32-, e l’ossido di vanadio (III) è V2O3, contenente ioni V3+ e O2-. Entrambi sono principalmente composti ionici che dovrebbero essere solidi. Gli altri tre composti sono tutti covalenti.
B L’acido benzoico ha più di quattro atomi di carbonio ed è polare, quindi non è probabile che sia un gas. Sia il cicloesene che il ciclobutano sono essenzialmente molecole non polari, ma il ciclobutano (C4H8) ha una massa molecolare significativamente più bassa del cicloesene (C6H10), che ha di nuovo più di quattro atomi di carbonio. Prevediamo quindi che il ciclobutano è molto probabilmente un gas a temperatura e pressione ambiente, mentre il cicloesene è un liquido. Infatti, con un punto di ebollizione di soli 12°C, rispetto agli 83°C del cicloesene, il ciclobutano è effettivamente un gas a temperatura e pressione ambiente.
Esercizio
Quali composti diresti che sono gas a temperatura e pressione ambiente?
- n-butanolo
- fluoruro di ammonio (NH4F)
- ClF
-
ossido di etilene
- HClO4
Risposta: c; d
Sommario
La materia volatile può esistere in tre stati: gas, liquido e solido. I gas hanno la densità più bassa dei tre, sono altamente comprimibili e riempiono completamente i loro contenitori. Gli elementi che esistono come gas a temperatura e pressione ambiente sono raggruppati sul lato destro della tavola periodica; si presentano come gas monoatomici (i gas nobili) o molecole biatomiche (alcuni alogeni, N2, O2). Molti composti inorganici e organici con quattro o meno atomi non idrogeno sono anche gas a temperatura e pressione ambiente. Tutte le sostanze gassose sono caratterizzate da deboli interazioni tra le molecole o gli atomi costituenti.
Presa di coscienza
- Le molecole delle sostanze gassose spesso contengono legami covalenti o polari, sono molecole non polari o leggermente polari, e hanno masse molecolari relativamente basse.
Problemi concettuali
-
Spiega le differenze tra le proprietà microscopiche e macroscopiche della materia. Il punto di ebollizione di un composto è una proprietà microscopica o macroscopica? massa molecolare? Perché?
-
Determina se il punto di fusione, il momento di dipolo e la conducibilità elettrica sono proprietà macroscopiche o microscopiche della materia e spiega il tuo ragionamento.
-
Come le proprietà microscopiche della materia influenzano le proprietà macroscopiche? Puoi mettere in relazione la massa molecolare con il punto di ebollizione? Perché o perché no? La polarità può essere collegata al punto di ebollizione?
-
Per una sostanza che ha fasi gassose, liquide e solide, disponi queste fasi in ordine di crescente
- densità.
- forza delle interazioni intermolecolari.
- compressibilità.
- movimento molecolare.
- ordine nella disposizione delle molecole o degli atomi.
-
Spiega cosa c’è di sbagliato in questa affermazione: “Lo stato della materia determina in gran parte le proprietà molecolari di una sostanza.”
-
Descrivi i fattori più importanti che determinano lo stato di un dato composto. Quali condizioni esterne influenzano l’esistenza di una sostanza in uno dei tre stati della materia?
-
Quali elementi della tavola periodica esistono come gas a temperatura e pressione ambiente? Di questi, quali sono molecole biatomiche e quali monoatomiche? Quali elementi sono liquidi a temperatura e pressione ambiente? Quale porzione della tavola periodica contiene elementi i cui idruri binari sono più probabilmente gas a temperatura ambiente?
-
È corretta la seguente osservazione? “Quasi tutti gli idruri binari non metallici sono gas a temperatura ambiente, ma gli idruri metallici sono tutti solidi”. Spiega il tuo ragionamento.
-
È corretta la seguente osservazione? “Tutti gli idruri dei calcogeni sono gas a temperatura e pressione ambiente, tranne l’idruro binario di ossigeno, che è un liquido”. Spiega il tuo ragionamento. Ti aspetteresti che l’1-cloropropano sia un gas? Lo iodopropano? Perché?
-
Spiega perché i composti ionici non sono gas in condizioni normali.
Risposte
-
-
-
-
-
-
Le proprietà molecolari di una sostanza controllano il suo stato di materia in un dato insieme di condizioni, non il contrario. La presenza di forti forze intermolecolari favorisce uno stato condensato della materia (liquido o solido), mentre un’interazione intermolecolare molto debole favorisce lo stato gassoso. Inoltre, la forma delle molecole detta se una fase condensata è un liquido o un solido.
-
-
Gli elementi che esistono come gas si trovano principalmente nell’angolo superiore destro e sul lato destro della tavola periodica. I seguenti elementi esistono come gas: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, e Rn. Così, la metà degli alogeni, tutti i gas nobili e i calcogeni e i picnogeni più leggeri sono gas. Di questi, tutti tranne i gas nobili esistono come molecole biatomiche. Solo due elementi esistono come liquidi ad una temperatura ambiente normale di 20°C-25°C: il mercurio e il bromo. La parte superiore destra della tavola periodica include anche la maggior parte degli elementi i cui idruri binari sono gas. Inoltre, gli idruri binari degli elementi del gruppo 14-16 sono gas.
-
-
-
-