Instabilità strutturale degli enzimi
Il fatto che i siti attivi siano così adatti a fornire condizioni ambientali specifiche significa anche che sono soggetti alle influenze dell’ambiente locale. È vero che l’aumento della temperatura ambientale generalmente aumenta i tassi di reazione, catalizzati dall’enzima o altro. Tuttavia, aumentare o diminuire la temperatura al di fuori di un intervallo ottimale può influenzare i legami chimici all’interno del sito attivo in modo tale che siano meno adatti a legare i substrati. Le alte temperature finiranno per far denaturare gli enzimi, come altre molecole biologiche, un processo che cambia le proprietà naturali di una sostanza. Allo stesso modo, anche il pH dell’ambiente locale può influenzare la funzione dell’enzima. I residui di aminoacidi del sito attivo hanno le loro proprietà acide o basiche che sono ottimali per la catalisi. Questi residui sono sensibili ai cambiamenti di pH che possono compromettere il modo in cui le molecole di substrato si legano. Gli enzimi sono adatti a funzionare al meglio entro un certo intervallo di pH e, come per la temperatura, valori estremi di pH (acido o basico) dell’ambiente possono causare la denaturazione degli enzimi.
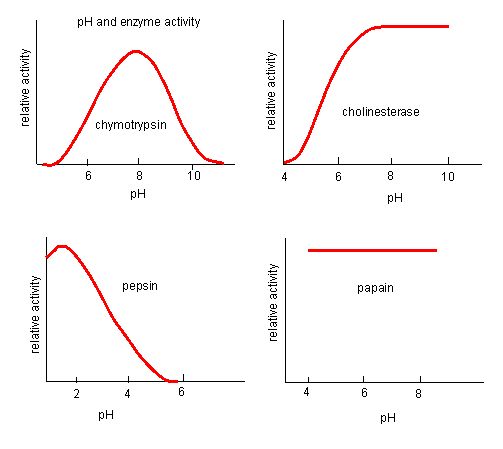
Figura 4. Gli enzimi hanno un pH ottimale. Il pH a cui l’enzima è più attivo sarà il pH in cui i gruppi R del sito attivo sono protonati/deprotonati in modo che il substrato possa entrare nel sito attivo e possa iniziare la fase iniziale della reazione. Alcuni enzimi richiedono un pH molto basso (acido) per essere completamente attivi. Nel corpo umano, questi enzimi si trovano molto probabilmente nella parte inferiore dello stomaco, o si trovano nei lisosomi (un organello cellulare usato per digerire grandi composti all’interno della cellula).
Fonte: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Il processo in cui gli enzimi si denaturano di solito inizia con lo svolgimento della struttura terziaria attraverso la destabilizzazione dei legami che tengono insieme la struttura terziaria. I legami idrogeno, i legami ionici e i legami covalenti (ponti disolfuro e legami peptidici) possono essere tutti interrotti da grandi cambiamenti di temperatura e pH. Usando il grafico dell’attività enzimatica e della temperatura qui sotto, fate una storia energetica per l’enzima rosso. Spiega cosa potrebbe accadere da 37 °C a 95 °C.
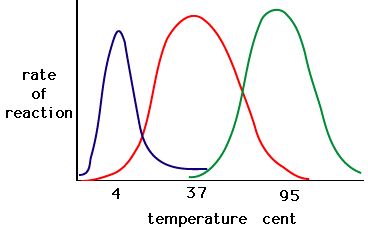
Figura 5. Gli enzimi hanno una temperatura ottimale. La temperatura alla quale l’enzima è più attivo sarà di solito la temperatura alla quale la struttura dell’enzima è stabile o non compromessa. Alcuni enzimi richiedono una temperatura specifica per rimanere attivi e non denaturarsi. Fonte: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Adattamento indotto e funzione dell’enzima
Per molti anni, gli scienziati hanno pensato che il legame enzima-substrato avesse luogo in un semplice modo “lock-and-key”. Questo modello affermava che l’enzima e il substrato si incastrano perfettamente in un unico passaggio istantaneo. Tuttavia, la ricerca attuale sostiene una visione più raffinata chiamata fit indotto. Il modello di adattamento indotto espande il modello lock-and-key descrivendo un’interazione più dinamica tra enzima e substrato. Quando l’enzima e il substrato si incontrano, la loro interazione provoca un leggero spostamento nella struttura dell’enzima che conferma un accordo di legame più produttivo tra l’enzima e lo stato di transizione del substrato. Questo legame energeticamente favorevole massimizza la capacità dell’enzima di catalizzare la sua reazione.
Quando un enzima lega il suo substrato, si forma un complesso enzima-substrato. Questo complesso abbassa l’energia di attivazione della reazione e promuove la sua rapida progressione in uno dei tanti modi. A un livello di base, gli enzimi promuovono le reazioni chimiche che coinvolgono più di un substrato riunendo i substrati in un orientamento ottimale. La regione appropriata (atomi e legami) di una molecola è giustapposta alla regione appropriata dell’altra molecola con cui deve reagire. Un altro modo in cui gli enzimi promuovono la reazione dei loro substrati è creando un ambiente energeticamente favorevole all’interno del sito attivo affinché la reazione avvenga. Alcune reazioni chimiche potrebbero procedere meglio in un ambiente leggermente acido o non polare. Le proprietà chimiche che emergono dalla particolare disposizione dei residui di aminoacidi all’interno di un sito attivo creano l’ambiente energeticamente favorevole alla reazione dei substrati specifici di un enzima.
L’energia di attivazione richiesta per molte reazioni include l’energia coinvolta nel contorcere leggermente i legami chimici in modo che possano reagire più facilmente. L’azione enzimatica può aiutare questo processo. Il complesso enzima-substrato può abbassare l’energia di attivazione contorcendo le molecole del substrato in modo tale da facilitare la rottura del legame. Infine, gli enzimi possono anche abbassare le energie di attivazione prendendo parte alla reazione chimica stessa. I residui aminoacidici possono fornire certi ioni o gruppi chimici che formano effettivamente legami covalenti con le molecole di substrato come passo necessario del processo di reazione. In questi casi, è importante ricordare che l’enzima tornerà sempre al suo stato originale al completamento della reazione. Una delle proprietà distintive degli enzimi è che rimangono in ultima analisi immutati dalle reazioni che catalizzano. Dopo che un enzima ha finito di catalizzare una reazione, rilascia il suo prodotto(i).
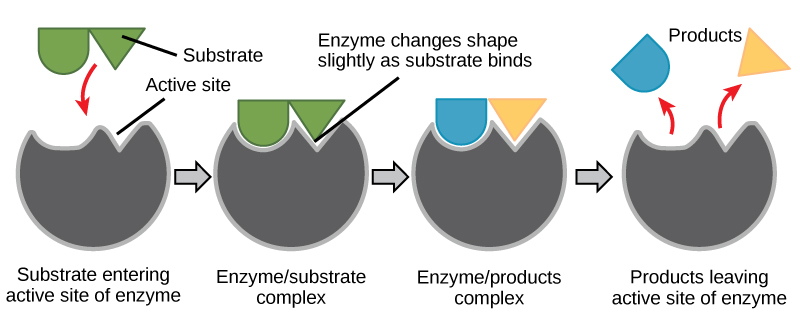
Figura 6. Secondo il modello induced-fit, sia l’enzima che il substrato subiscono cambiamenti conformazionali dinamici al momento del legame. L’enzima contorce il substrato nel suo stato di transizione, aumentando così la velocità della reazione.
Creare una storia energetica per la reazione di cui sopra
Utilizzando la figura 6, rispondere alle domande poste nella storia energetica.
1. Quali sono i reagenti? Quali sono i prodotti?
2. Quale lavoro è stato compiuto dall’enzima?
3. In quale stato si trova l’energia inizialmente? In quale stato si trasforma l’energia nello stato finale? Questo potrebbe essere ancora difficile, ma cercate di identificare dove si trova l’energia nello stato iniziale e nello stato finale.