Avendo stabilito l’esistenza del nucleo, potete ora considerare l’evidenza sperimentale della sua dimensione, partendo dall’esperimento di Rutherford.
Sommario della lezione
- Discussione ed esempio lavorato: Dimensione del nucleo (15 minuti)
- Discussione: Dimensioni dell’atomo e del nucleo (10 minuti)
- Domande degli studenti: Forze e avvicinamento (30 minuti)
- Discussione: Numero atomico e carica di un nucleo (5 minuti)
- Discussione: Limite superiore della dimensione nucleare (30 minuti)
- Discussione: Un puzzle per una lezione futura (5 minuti)
Discussione ed esempio lavorato: Dimensione del nucleo
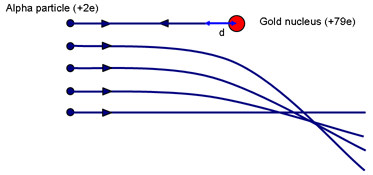
Puoi farti un’idea della possibile dimensione del nucleo pensando all’esperimento di Rutherford. Chiedete: Quale parametro di impatto farà sì che una particella si avvicini di più al nucleo? (Una collisione frontale con p = 0.)
Il principio della conservazione dell’energia è usato per calcolare la distanza di massimo avvicinamento come misura della dimensione di un nucleo. La comprensione del calcolo che segue dipende dal fatto che gli studenti abbiano trattato il potenziale elettrico e i campi. In alternativa serve come buon ripasso.
Episodio 522-1: Diffusione di particelle alfa – distanza di avvicinamento più vicina (Word, 29 KB)
Episodio 522-2: Distanza di avvicinamento più vicina (Word, 107 KB)
Quando l’α è portata momentaneamente a riposo (dopo essere salita il più lontano possibile sulla collina elettrostatica) sarà stato fatto lavoro contro la forza repulsiva dal nucleo. L’energia cinetica di α è immagazzinata nel campo intorno al nucleo. Quando la velocità è zero, tutta l’energia è ora immagazzinata nel campo.
Se l’α si ferma momentaneamente ad una distanza d dal (centro del) nucleo di carica Ze, l’energia nel campo è:
Eα = 14πε0 2e Zed
Questo è uguale all’energia cinetica iniziale della particella α. Rutherford usò una sorgente α datagli da Madame Curie. L’energia α era ~ 7,7 MeV.
Per l’oro, Z = 79. Risolvendo si ottiene d ~ 3 × 10-14 m. Confronta questo con il diametro degli atomi d’oro ~ 3 × 10-10 m. Quindi un nucleo è almeno 10 000 volte più piccolo di un atomo. È importante sottolineare che questo calcolo dà un limite superiore alla dimensione del nucleo d’oro; non possiamo dire che la particella alfa tocca il nucleo; un α più energico potrebbe avvicinarsi ancora di più.
Un atomo è per lo più vuoto (che è il motivo per cui la maggior parte come è passato attraverso – eventuali elettroni difficilmente ostacolerebbero il relativamente massiccio α ad alta velocità).
Discussione: Dimensioni dell’atomo e del nucleo
Chiedete ai vostri studenti di suggerire un modello in scala dell’atomo nucleare. Per esempio: se un nucleo avesse un diametro di 1 mm, un atomo sarebbe 10 000 volte più grande o 10 m di diametro. Scegliete una posizione adatta per un nucleo di 1 mm (un piccolo cuscinetto a sfera o una pallina di Blu-tac). Percorrete 5 m (cinque grandi passi) fino al bordo dell’atomo dove si trovano gli elettroni. NB: gli schemi del libro di testo di un atomo con un nucleo non sono disegnati in scala.
Rafforzare un’immagine accurata facendo alzare uno studente come nucleo, stimare la sua circonferenza (40 cm?) e chiedere dove un altro studente dovrebbe stare per essere sul bordo dell’atomo. 104 × 40 cm = 4000 m}, quindi il raggio di questo atomo è di 2 km! Controlla con una mappa locale per trovare una località che gli studenti riconosceranno e che sia a 2 km di distanza.
Ulteriore rinforzo: in un solido dove gli atomi sono molto vicini, la distanza tra nuclei adiacenti ~ la dimensione di un atomo, cioè equivalente a due studenti che stanno a 4 km di distanza! Entrambi sono di dimensioni simili. Sezione trasversale presentata da un nucleo ~raggio2, quindi ~1 × 10-28 m2}.
Chiedete: Come vi aspettate che il numero di riflessi dipenda dallo spessore della lamina metallica che contiene i nuclei bersaglio? (Immaginate gli atomi d’oro in strati, la possibilità di una deflessione aumenta con lo spessore, ma l’assorbimento all’entrata o all’uscita dalla lamina sempre più spessa alla fine impedirà qualsiasi ulteriore aumento del numero riflesso e rilevato.
È di grande aiuto se i vostri studenti possono ricordare i seguenti ordini di grandezza:
Raggio del nucleo atomico ~ 10 -14m
Raggio dell’atomo ~ 10 -10m
Domande degli studenti: Forze e avvicinamento più vicino
Episodio 522-3: Scattering di Rutherford: Direzioni delle forze (Word, 82 KB)
Episodio 522-4: Scattering di Rutherford: Energia e avvicinamento (Word, 83 KB)
Discussione: Il numero atomico e la carica di un nucleo
Rutherford usò i suoi dati per trovare la carica del nucleo di un bersaglio d’oro. Ulteriori esperimenti per trovare la carica delle lamine di Cu, Ag e Pt diedero:
| Numero atomico | Un esperimento di dispersione | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77.4 × e |
Quindi la carica elettrica di un nucleo è data dal numero atomico × e, cioè Z e. Con una sola eccezione (idrogeno, H-1), Z è sempre inferiore al numero di massa atomica. Cosa spiega allora la differenza? L’atomo deve essere elettricamente neutro. Rutherford propose il neutrone.
Discussione: Limite superiore della dimensione nucleare
Ricordiamo che l’analisi di Rutherford dà un limite superiore alla dimensione del nucleo (d ~ 1 α energia delle particelle). La dimensione che si misura dipende dall’energia della particella α che si usa. Quindi abbiamo bisogno di un altro approccio per trovare la dimensione di un nucleo d’oro. Puoi pensare a una particella migliore per sondare le dimensioni di un nucleo? (Il neutrone – essendo privo di carica si avvicinerà di più.)
Un’altra tecnica è lo scattering anelastico profondo degli elettroni. Fate riferimento indietro se avete già trattato la natura ondulatoria delle particelle (onde di de Broglie λ = hp), o questo argomento può essere inserito qui se lo desiderate. L’apparato di diffrazione degli elettroni ha una somiglianza di base con lo scattering di particelle. Gli elettroni sono sparati su un film sottile – in questo caso di grafite.
Rutherford fu fortunato che la lunghezza d’onda di de Broglie delle particelle α (a lui sconosciute) era abbastanza piccola, e la repulsione coulombiana si ferma avvicinandosi troppo – altrimenti gli effetti di diffrazione avrebbero confuso i dati! (Prova il calcolo se hai già coperto λ = hp.)
Episodio 506-2: Interpretare i modelli di diffrazione degli elettroni (Word, 30 KB)
Episodio 522-5: Deep inelastic scattering (Word, 56 KB)
Episodio 522-6: Gli elettroni misurano le dimensioni dei nuclei (Word, 42 KB)
Discussione: Un puzzle per una lezione futura
C’è un problema fondamentale con il modello di Rutherford. Chiedete alla vostra classe: Come può un atomo con un nucleo centrale essere stabile – perché non collassa? Secondo l’elettrodinamica classica, gli elettroni dovrebbero emettere radiazioni mentre orbitano, e spiraleggiare verso l’interno.
(E’ bene lasciare una classe con un puzzle per una lezione futura.)