Introduzione
La malattia renale cronica (CKD) è molto diffusa nel mondo. In Cina, quasi 1 persona su 10 ha un certo grado di disfunzione renale, per un totale di quasi 150 milioni di pazienti (1). L’anemia e l’iperparatiroidismo secondario sono le due complicazioni più comuni associate alla CKD (2, 3). Infatti, è stato riportato che quasi il 90% dei pazienti con CKD avanzata (classificata come stadio 4 e 5 CKD) soffre di anemia (4). È stato dimostrato che l’insorgenza e la gravità dell’anemia sono ben correlate al declino della velocità di filtrazione glomerulare (4). L’identificazione precoce, la valutazione e il trattamento dell’anemia possono diminuire la morbilità e la mortalità, nonché migliorare la qualità della vita nei pazienti CKD.
L’iperparatiroidismo secondario è caratterizzato da livelli elevati di ormone paratiroideo (PTH) nel siero. L’eccesso di PTH può compromettere l’eritropoiesi esercitando un effetto tossico diretto sulle cellule progenitrici eritroidi e un effetto indiretto attraverso l’induzione di fibrosi del midollo osseo (5, 6). Inoltre, la bassa concentrazione di emoglobina nei pazienti uremici può essere il risultato di un aumento della fragilità osmotica degli eritrociti dovuto all’alta concentrazione di PTH (7). È stata stabilita una correlazione inversa tra PTH e livelli di emoglobina (8-10). Meytes et al. hanno trovato che le concentrazioni di PTH entro 7,5-30 U/mL, che è paragonabile ai livelli sierici di PTH nei pazienti uremici, hanno indotto l’inibizione significativa della crescita delle unità formanti burst-eritroidi (BFU-E) nelle colture di midollo osseo murino, suggerendo un possibile percorso per il coinvolgimento dell’eccesso di PTH nella genesi dell’anemia dell’uremia (11).
Gli agenti stimolanti l’eritropoiesi (ESA) sono diventati un segno distintivo della terapia dell’anemia nei pazienti con CKD e sono il farmaco più comunemente prescritto nei pazienti in dialisi, con >95% di utilizzo in Cina (1). La prima eritropoietina umana ricombinante, epoetina-alfa, è stata autorizzata negli Stati Uniti nel 1988 (12). L’epoetina-alfa e l’epoetina-beta sono agenti terapeutici a breve durata d’azione e convenienti e vengono somministrati da una a tre volte alla settimana nella maggior parte dei pazienti con CKD. Tuttavia, il suo dosaggio aumenta con un intervallo di dosaggio prolungato per raggiungere o mantenere un livello target di emoglobina. Epiao®(3.000 μ/tubo) è un tipo di Epoetina-alfa ampiamente usato in Cina, mentre Recormon®(2.000 μ/tubo) è un tipo di Epoetina-beta più comunemente usato in Europa, ed è stato usato in Cina per circa 4 anni.
I risultati di recenti studi clinici hanno dimostrato che le dosi che raggiungono elevati obiettivi di emoglobina sollevano preoccupazioni per un aumento del rischio di morte o di esiti avversi come eventi tromboembolici e ictus (13-16). Andrews et al. hanno scoperto che una maggiore frequenza di dosaggio a un livello di dose elevata ha aumentato l’incidenza di tossicità trombotiche rispetto agli animali dosati meno frequentemente in gruppi di dose inferiore, nonostante un ematocrito altrettanto elevato in tutti i gruppi (17), suggerendo che un ematocrito elevato non è l’unico fattore causale che porta a tossicità legate agli ESA, ma è anche associato al livello di dose, alla frequenza di dosaggio e alla durata del dosaggio. Pertanto, le tossicità legate agli ESA indipendenti da un ematocrito elevato dovrebbero essere oggetto di grande attenzione.
Al momento, sono disponibili dati limitati riguardo alla possibile relazione tra la dose di ESA e il PTH in pazienti uremici mantenuti in emodialisi regolare. Questo studio retrospettivo aveva lo scopo di indagare l’associazione tra la dose di ESA e i livelli di PTH intatto (iPTH) nei pazienti in emodialisi sulla base dei dati clinici nel nostro sistema di database informatico ospedaliero.
Materiali e metodi
Pazienti e procedure
Questo studio retrospettivo di coorte è stato condotto da febbraio 2015 a maggio 2015 nello Xiamen Zhongshan Hospital, Xiamen University, Cina. Questo studio ha incluso pazienti uremici in emodialisi mantenuta per almeno 3 mesi, che hanno usato ESA per il trattamento dell’anemia. I pazienti che rispondevano ai seguenti criteri sono stati esclusi dallo studio: (1) età <18 anni; (2) pazienti con infezione attiva, malignità, anemia da carenza di ferro (definita come ferritina <100 ng/mL e saturazione <20%), o sanguinamento attivo entro 3 mesi; (3) pazienti con dati incompleti. I pazienti eleggibili sono stati classificati in due gruppi, in base all’ESA utilizzato: Gruppo Recormon e gruppo Epiao.
Raccolta dati
I dati sono stati ottenuti da Jinshida, il sistema di database del Xiamen Zhongshan Hospital, che ha ricodificato i dati clinici di 376 pazienti in emodialisi. Sono stati raccolti i seguenti dati: età, sesso, peso secco, diagnosi di malattie primarie, azoto ureico nel sangue (BUN), creatinina nel siero (Scr), emoglobina, calcio, fosforo, albumina, iPTH, ferritina nel siero, saturazione della transferrina e dosaggio degli ESA. Questi dati sono stati misurati la mattina del giorno dell’emodialisi (prima della dialisi). In conformità con le linee guida Kidney Disease Improving Global Outcomes (KDIGO), il livello di emoglobina normale è stato definito come livelli tra 110 e 130 g/L in pazienti uremici con emodialisi mantenuta (8). I valori di riferimento per il calcio e il fosforo sierici sono stati definiti come valori compresi tra 2,1-2,54 e 1,1-1,78 mmol/L, rispettivamente (18). I pazienti sono stati ulteriormente classificati in base ai livelli di iPTH: 150, 300, 600 e 1.500 pg/mL (19, 20).
Etica dello studio
Questo studio è stato condotto analizzando i dati retrospettivi ottenuti dal sistema di registrazione elettronica dei pazienti del nostro ospedale. Il protocollo di studio sulla ricerca umana è stato approvato dal comitato etico dell’ospedale Zhongshan, Xiamen University. Il consenso informato scritto è stato ottenuto da tutti i soggetti.
Analisi statistica
L’analisi statistica è stata eseguita utilizzando il software SPSS per Windows versione 17.0. I dati sono stati espressi come percentuali o media ± errore standard della media (SEM). I dati demografici e le misure di laboratorio tra i gruppi sono stati confrontati con il test del chi-quadrato di Pearson, il test esatto di Fisher o la correzione di Yate per la continuità. Un valore P <0,05 è stato considerato statisticamente significativo.
Risultati
Caratteristiche dei pazienti uremici mantenuti in emodialisi regolare
Un totale di 240 pazienti uremici mantenuti in emodialisi regolare sono stati inclusi in questo studio. Le caratteristiche di base dei pazienti sono mostrate nella tabella 1. Non c’erano differenze significative in età, sesso, peso secco, malattie primarie, BUN, Scr, emoglobina, fosfato sierico, calcio, albumina, ferritina sierica e saturazione della transferrina tra i gruppi Recormon ed Epiao (Tabella 1, P > 0.05).

Tabella 1. Caratteristiche di base dei pazienti.
Il livello medio di emoglobina di tutti i soggetti era 103,15 ± 1,07 g/L. I pazienti con un livello di emoglobina tra 110 e 130 g/L rappresentavano il 30,4% (n = 84). L’anemia è stata divisa in cinque classi in base al livello di emoglobina, secondo la gravità dell’anemia (21, 22): livello di emoglobina <60 g/L (2,1%, n = 5), livello di emoglobina ≥60 e <90 g/L (21,7%, n = 52), livello di emoglobina ≥90 e <110 g/L (38.7%, n = 93), livello di emoglobina ≥110 e <130 g/L (30,4%, n = 73), e livello di emoglobina ≥130 g/L (7,1%, n = 17).
Relazioni tra il grado di anemia e iPTH
La relazione tra diversi gradi di anemia e iPTH è stata analizzata. I risultati hanno rivelato che il livello di emoglobina era associato negativamente con iPTH (Figura 1A; Tabella 2; P < 0.05). Tuttavia, non è stata trovata alcuna associazione significativa tra anemia e calcio sierico o livello di fosforo (Figura 1B; Tabella 2; P > 0.05 per entrambi).
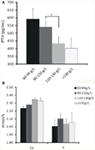
Figura 1. La relazione tra le concentrazioni di emoglobina e iPTH, calcio sierico o livelli di fosforo. (A) La concentrazione di emoglobina è aumentata al diminuire del livello di iPTH per stratificazione. (B) Non è stata trovata alcuna associazione significativa tra la concentrazione di emoglobina e il livello di calcio o fosforo nel siero. I dati sono stati calcolati con il t-test. *P < 0.05.

Tabella 2. Misurazioni dei livelli sierici di calcio, fosforo e iPTH in base ai valori di emoglobina per stratificazione.
I pazienti con 150-300 pg/mL di iPTH avevano i più alti livelli di emoglobina, ferritina sierica e saturazione di transferrina
Quando il livello di iPTH era compreso tra 150-300 pg/mL, i pazienti in emodialisi avevano i più alti livelli medi di emoglobina, ferritina sierica e saturazione di transferrina; che erano 106.25 g/L, 248.98 μg/L, e 30.97%, rispettivamente (Figura 2).
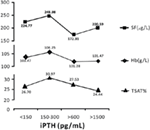
Figura 2. I pazienti con livelli di iPTH entro 150-300 pg/mL avevano i più alti livelli di emoglobina, ferritina sierica e saturazione della transferrina. I dati sono espressi come percentuali o media ± SEM.
Confronto di Recormon vs. Epiao nel trattamento dell’anemia
I pazienti trattati con Recormon ed Epiao avevano livelli di emoglobina simili (103.54 ± 1.72 g/L, n = 98 vs. 102.59 ± 1.38 g/L, n = 142, P > 0.05; Figura 3A). Tuttavia, il dosaggio di Recormon (3,853.66 ± 225.13 μ/settimana, n = 98) per il trattamento di anemia era significativamente inferiore a Epiao (7,083.33 ± 264.93 μ/settimana, n = 142, P < 0.05; Figura 3B, Tabella 1).
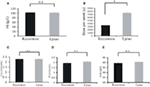
Figura 3. Confronto di Recormon vs. Epiao nel trattamento dell’anemia. (A) I pazienti trattati con Recormon e Epiao avevano livelli di emoglobina simili (103.54 ± 1.72 g/L, n = 98 vs. 102.59 ± 1.38 g/L, n = 142, P > 0.05). (B) Il dosaggio di Recormon per il trattamento dell’anemia era significativamente inferiore a Epiao, 3,853.66 ± 225.13 μ/settimana, n = 98 vs. 7,083.33 ± 264.93 μ/settimana, n = 142. (C-E) Non c’erano differenze significative nei livelli di calcio (C), fosforo (D) e albumina (E) tra i gruppi Recormon ed Epiao. I dati sono stati calcolati dal t-test; P > 0.05.
I livelli sierici di calcio, fosforo e albumina non erano significativamente diversi tra i gruppi Recormon ed Epiao (rispettivamente, 2.27 ± 0.47 vs. 2.29 ± 0.01 mmol/L, P > 0.05; 1.94 ± 0.10 vs. 2.06 ± 0.04 mmol/L, P > 0.05; 39.5 ± 0.44 vs. 40.2 ± 0.35 g/L, P > 0,05; Figure 3C-E; Tabella 1).
La relazione tra le dosi di ESA e i livelli di iPTH
Per tutti i pazienti in emodialisi, i livelli di iPTH nel gruppo Recormon erano inferiori al gruppo Epiao (336.66 ± 57.76 pg/mL, n = 98 vs. 531.05 ± 39.57 pg/mL, n = 142; P < 0.05; Figura 4A; Tabella 1). Una tendenza simile è stata trovata nei pazienti in emodialisi con livelli di emoglobina tra 110 e 130 g/L (319,50 ± 74,9 pg/mL nel gruppo Recormon, n = 28 vs 499,5 ± 64,38 pg/mL nel gruppo Epiao, n = 45; P < 0,05; Figura 4A).
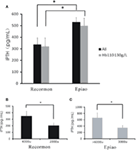
Figura 4. L’associazione tra la dose di ESA e i livelli di iPTH. (A) Il livello di iPTH nei gruppi Recormon e Epiao. (B) Nel gruppo Recormon, i livelli di iPTH nei pazienti trattati con Recormon a 2.000 vs. 4.000 μ/settimana. (C) Nel gruppo Epiao, livelli di iPTH nei pazienti trattati con Epiao a 3.000 e >6.000 μ/settimana. I dati sono stati calcolati mediante t-test; *P < 0,05.
Tra i pazienti con livelli di emoglobina tra 110 e 130 g/L, il livello di iPTH era 201,54 ± 42.67 pg/mL (n = 10) in pazienti trattati con Recormon a 2.000 μ/settimana, che era significativamente inferiore a pazienti trattati con Recormon a 4.000 μ/settimana (348,16 ± 117,9 pg/mL, n = 13; P < 0,05, Figura 4B). Allo stesso modo, il livello medio di iPTH nei pazienti trattati con Epiao a 3.000 μ/settimana era significativamente inferiore ai pazienti trattati con Epiao >6.000 μ/settimana (347,15 ± 75,94 pg/mL, n = 12 vs. 661,01 ± 198,45 pg/mL, n = 27; P < 0,05, Figura 4C).
Discussione
Questo studio retrospettivo è il primo a fornire la prova che dosi più elevate di ESA (Epoetina-alfa e -beta) potrebbero essere associate a livelli più elevati di iPTH in pazienti uremici mantenuti in emodialisi regolare. Inoltre, abbiamo trovato che i pazienti con livelli di iPTH entro 150-300 pg/mL avevano i più alti livelli di emoglobina, ferritina sierica e saturazione della transferrina, che era coerente con il livello raccomandato di iPTH basato sulle linee guida KDIGO (9).
L’anemia è una delle complicazioni più comuni della CKD. L’Organizzazione Mondiale della Sanità ha definito l’anemia come una concentrazione di emoglobina inferiore a 13,0 g/dl negli uomini e nelle donne in post-menopausa, o una concentrazione di emoglobina <12,0 g/dl nelle altre donne. L’uso degli ESA ha notevolmente migliorato la vita di molti pazienti anemici con CKD. Tuttavia, alte dosi di ESA hanno dimostrato di essere associate a un aumento del rischio di esiti negativi negli adulti e nei bambini con CKD. I pazienti trattati con alte dosi di ESA hanno un rischio di mortalità aumentato di 1,2-1,5 (23). In questo studio, abbiamo trovato una significativa associazione inversa tra i livelli di iPTH e le concentrazioni di emoglobina nei pazienti in emodialisi trattati con ESA, che è coerente con i risultati di studi precedenti (8-10).
In questo studio, i pazienti nei gruppi Recormon ed Epiao hanno presentato concentrazioni di emoglobina simili; tuttavia, il dosaggio utilizzato per Recormon era significativamente inferiore a Epiao. Abbiamo anche scoperto che il livello di iPTH nel gruppo Recormon era significativamente inferiore a quello del gruppo Epiao. Per determinare ulteriormente l’associazione tra la dose di ESA e i livelli di iPTH, abbiamo analizzato separatamente i dati clinici dei pazienti trattati con Recormon o Epiao. Il livello di iPTH era notevolmente inferiore nei pazienti trattati con Recormon a 2.000 μ/settimana rispetto ai pazienti trattati con Recormon a 4.000 μ/settimana. Una tendenza simile è stata riscontrata nei pazienti trattati con Epiao a un dosaggio di 3.000 o 6.000 μ/settimana, suggerendo che alte dosi di ESA possono essere correlate ad alti livelli di iPTH. Questi risultati indicano che le tossicità degli ESA non possono essere spiegate esclusivamente dall’ematocrito elevato. Dato che alte dosi di ESA possono essere associate ad alti livelli di iPTH in pazienti mantenuti in dialisi, i pazienti con malattia renale allo stadio finale possono essere gestiti al meglio riducendo al minimo o sospendendo la dose di ESA, soprattutto nei pazienti con recenti eventi cardiovascolari o cerebrovascolari, emergenze ipertensive o eventi tromboembolici acuti. Infatti, considerando l’aumento del rischio di eventi cardiovascolari a concentrazioni di emoglobina quasi normali e alte dosi di ESA nella CKD, non è raccomandato a Taiwan di usare dosaggi sproporzionati di ESA per raggiungere un livello di emoglobina entro 100-110 g/L (24).
Anche se la patogenesi dell’anemia nella CKD è multifattoriale, la mancanza di eritropoietina è la causa principale di anemia nei pazienti CKD (25). Altri fattori che contribuiscono all’anemia associata alla CKD includono la carenza di ferro, l’anemia da infiammazione, la soppressione dell’eritropoiesi, l’accorciamento della sopravvivenza dei globuli rossi da parte delle tossine uremiche e la perdita di sangue come l’emorragia gastrointestinale. Poiché la carenza di ferro è anche un fattore causale comune per l’anemia, la supplementazione di ferro per via endovenosa è stata incoraggiata prima a Taiwan nel 1996. Sulla base dell’esperienza della gestione dell’anemia CKD a Taiwan, un obiettivo di emoglobina ragionevole può essere raggiunto utilizzando la dose più bassa possibile di ESA e la supplementazione di ferro per via endovenosa (24).
Il nostro studio ha diversi limiti. In primo luogo, questo studio osservazionale è uno studio di un solo centro. In secondo luogo, dato il potenziale confondimento e bias di selezione per indicazione, è necessaria un’interpretazione cauta di questi dati. Infatti, la nostra osservazione sull’associazione tra iPTH e ESA richiede un’ulteriore esplorazione con studi prospettici longitudinali. In terzo luogo, c’è una predominanza nel numero di pazienti trattati con Epiao (142 per Epiao contro 98 per Rocormon), il che è probabilmente dovuto al prezzo relativamente economico di Epiao rispetto a Recormon (tabella 1). Quarto, gli interventi farmacologici come gli agenti antipertensivi potrebbero aver provocato fluttuazioni transitorie o persino interferenze nei livelli di iPTH o di emoglobina.
In conclusione, questo studio dimostra che dosi più elevate di ESA potrebbero essere associate a livelli più elevati di iPTH nei pazienti uremici mantenuti in emodialisi regolare. Il coinvolgimento di dosi più elevate di ESA nella patogenesi dell’iperparatiroidismo secondario rimane poco chiaro e può richiedere ulteriori indagini. I nostri risultati suggeriscono che l’utilizzo della più bassa dose possibile di ESA può minimizzare i rischi potenziali, pur raggiungendo un obiettivo ragionevole di emoglobina.
Contributi degli autori
Il manoscritto è stato rivisto e approvato da tutti gli autori, e non è in considerazione per la pubblicazione altrove in una forma simile e in qualsiasi lingua.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Finanziamento
Questa ricerca è stata sostenuta dal Medical Innovation Program Fund della provincia di Fujian (No. 2011027).
Abbreviazioni
BUN, azoto ureico nel sangue; CKD, malattia renale cronica; ESA, agente stimolante l’eritropoiesi; Hb, emoglobina; iPTH, ormone paratiroideo intatto; Scr, creatinina sierica.
1. Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Prevalenza della malattia renale cronica in Cina: un’indagine trasversale. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Martin KJ, Gonzalez EA. Malattia ossea metabolica nella malattia renale cronica. J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. Il recettore del calcio-sensing: un fattore chiave nella patogenesi del iperparatiroidismo secondario. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Levin A, Thompson CR, Ethier J, Carlisle EJ, Tobe S, Mendelssohn D, et al. Aumento dell’indice di massa ventricolare sinistra nella malattia renale iniziale: impatto del declino dell’emoglobina. Am J Kidney Dis (1999) 34:125-34. doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kwack C, Balakrishnan VS. Gestire l’iporesponsività dell’eritropoietina. Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gallieni M, Corsi C, Brancaccio D. Iperparatiroidismo e anemia nell’insufficienza renale. Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Fragilità osmotica dei globuli rossi in pazienti cronicamente emodializzati. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Baradaran A, Nasri H. Intensificazione di anemia da iperparatiroidismo secondario in pazienti in emodialisi. Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Sliem H, Tawfik G, Moustafa F, Zaki H. Relazione di iperparatiroidismo secondario associato al fattore di crescita dei fibroblasti-23 del siero nella malattia renale allo stadio finale: uno studio caso-controllo. Indian J Endocrinol Metab (2011) 15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Iperparatiroidismo, anemia ed eritropoietina: effetti sulla funzione sistolica dei pazienti in dialisi. Abstracts of 31 st Congress of European Renal Association/European dialysis ND Transplantation Association, September 5-8, 1999 Madrid. Nephrol Dial Transpl (1999) 14:190.
Google Scholar
11. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. Effetto dell’ormone paratiroideo sull’eritropoiesi. J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Eschbach JW, Abdulhadi MH, Browne JK, Delano BG, Downing MR, Egrie JC, et al. Eritropoietina umana ricombinante in pazienti anemici con malattia renale allo stadio terminale. Risultati di uno studio clinico multicentrico di fase III. Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, et al. Gli effetti di valori di ematocrito normali rispetto a quelli bassi in pazienti con malattia cardiaca che ricevono emodialisi ed epoetina. N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Singh AK. Dovremmo mantenere i livelli di emoglobina come una valida misura di risultato? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15. Phrommintikul A, Haas SJ, Elsik M, Krum H. Mortalità e concentrazioni di emoglobina target in pazienti anemici con malattia renale cronica trattati con eritropoietina: una meta-analisi. Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. Cambiamenti nel dosaggio dell’agente stimolante l’eritropoiesi (ESA) e nei livelli di emoglobina nei pazienti americani non in dialisi con malattia renale cronica tra il 2005 e il 2009. Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. Ematocrito elevato derivante dalla somministrazione di agenti stimolanti l’eritropoiesi non è completamente predittivo di mortalità o tossicità in specie precliniche. Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Malattia renale: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19. Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Rischio di mortalità per i pazienti in dialisi con diversi livelli di calcio, fosforo e PTH: il Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Fondazione Nazionale del Rene. Linee guida di pratica clinica K/DOQI per la malattia renale cronica: valutazione, classificazione e stratificazione. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Gestione dell’anemia e risultati da 12 paesi nel Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Malattia renale: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO linea guida di pratica clinica per l’anemia nella malattia renale cronica. Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23. Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Trattamento con alte dosi di agenti stimolanti l’eritropoiesi e mortalità: analisi con un approccio Cox sequenziale e un modello strutturale marginale. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. Gestione dell’anemia nei pazienti con malattia renale cronica: Linee guida per la pratica di Taiwan. Nephrology (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. Efficacia clinica e sicurezza dell’eritropoietina ricombinante canina in cani con anemia da insufficienza renale cronica e cani con aplasia dei globuli rossi indotta da eritropoietina umana ricombinante. J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar