Anche se un tempo la dengue era una malattia periodica che causava epidemie di lunga durata, oggi è considerata la più importante malattia virale trasmessa dalle zanzare nel mondo. Ogni anno, circa cinquanta a cento milioni di casi di febbre dengue sono registrati in tutto il mondo. Mezzo milione di questi casi sfocia nella forma più grave di febbre di dengue (DF) conosciuta come febbre emorragica di dengue (DHF). La DHF è una malattia che colpisce prevalentemente i bambini sotto i 15 anni di età ed è caratterizzata dall’improvvisa comparsa di febbre, trombocitopenia e sindrome da perdita vascolare. DHF si verifica a causa di un’infezione da parte del virus dengue, che fa parte della famiglia Flaviviridae . Il virus è icosaedra, avvolto, a singolo filamento, RNA a senso positivo. Il nucleo icosaedra è quaranta a cinquanta nanometri di diametro e contiene la proteina C che incapsula il genoma virale. Due proteine virali, M ed E, che compongono l’involucro lipidico, circondano il nucleo. L’infezione è causata da uno dei quattro sierotipi del virus della dengue (DENV): DENV-1, DENV-2, DENV-3 e DENV-4. L’infezione da uno dei sierotipi non fornisce l’immunità contro l’infezione con gli altri sierotipi.
Se qualcuno che è stato precedentemente infettato viene infettato di nuovo, ha un rischio maggiore di sviluppare la sindrome da shock dengue (DSS) e DHF, che si traduce in indebolimento e rottura dei vasi e sanguinamento interno. Gli anticorpi non neutralizzanti possono aumentare l’assorbimento del virus da parte delle cellule che esprimono i recettori Fc, permettendo così il potenziamento anticorpo-dipendente nel DHF. Varie specie di Aedesmosquitoes sono vettori del virus della dengue e trasmettono il virus mordendo un ospite umano. Aedes aegypti; una piccola zanzara bianca e nera, tropicale e subtropicale che si trova in America Centrale, America Latina, Sud-Est asiatico e nel Pacifico occidentale, è il principale vettore.
Epidemiologia
Oggi la DHF è considerata a livello internazionale come la più importante malattia virale trasmessa dalle zanzare. È endemica in più di 100 paesi in tutto il mondo, soprattutto nelle regioni tropicali e sub-tropicali. Negli Stati Uniti, la DHF che causa la Aedes aegyptispecies può essere trovata stagionalmente in Louisiana, Florida meridionale, New Mexico, Arizona, Texas, Georgia, Alabama, Mississippi, North e South Carolina, Kentucky, Oklahoma e Tennessee. Negli ultimi 50 anni, l’incidenza della dengue è aumentata di 30 volte.
Secondo l’Organizzazione Mondiale della Sanità (OMS), si stima che da 50 a 100 milioni di infezioni di febbre dengue si verificano ogni anno. Di questi casi, 500.000 si trasformano in DHF e provocano 22.000 morti, soprattutto bambini. In base ai dati ufficiali presentati all’OMS, i casi di dengue nelle Americhe, nel Sud-Est asiatico e nel Pacifico occidentale hanno superato 1,2 milioni nel 2008 e oltre 3 milioni nel 2013. Nel 2013, 2,35 milioni di casi di dengue sono stati riportati solo nelle Americhe, di cui 37, 687 casi erano di DHF. Dopo la prima epidemia nota di DHF nel 1953 al 1954 nelle Filippine, la malattia ha continuato a diffondersi in tutto il sud-est asiatico.
Durante gli anni ’50, ’60 e la maggior parte degli anni ’70, l’epidemia di dengue era rara nella maggior parte del Sud e Centro America perché la zanzara vettore principale, Aedes aegypti, era stata sradicata. Tuttavia, una volta che l’e-sterminazione è stata interrotta, Aedes aegypti ha cominciato a reinvadere quelle regioni. Nel 1997, Aedes aegypti e il virus della dengue si sono nuovamente distribuiti in tutto il mondo (Figure 1 e 2). Secondo l’OMS, oggi ci sono oltre 2,5 miliardi di persone che vivono in zone in cui la dengue/DHF è endemica e sono a rischio di essere infettati dal virus della dengue. Diversi fattori contribuiscono alla trasmissione virale da parte di Aedes aegypti, tra cui la temperatura, le precipitazioni, la migrazione rurale-urbana, la crescita della popolazione, l’acqua immagazzinata, l’aumento dei rifiuti solidi che permette di creare habitat larvali per il vettore. Ci possono essere anche focolai di DHF associati ai viaggi. La febbre dengue è l’infezione da arbovirus più diffusa in tutto il mondo.
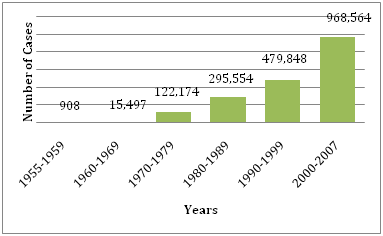
Figura 1: Numero medio di DF/DHF riportato all’OMS negli anni forniti.
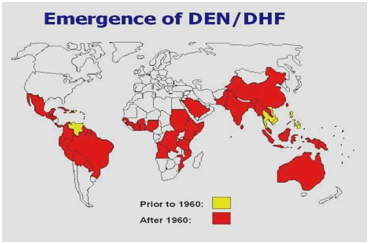
Figura 2: Distribuzione della dengue/ febbre emorragica dengue nelle Americhe, Caraibi, Africa e Medio Oriente.
Fattori di rischio per DF e trasmissione del virus dengue
La febbre dengue è un’importante malattia virale trasmessa da artropodi . La ricerca mostra che il genere Aedes, principalmente le zanzare Aedes aegypti e Aedes albopictus, si sono adattate a vivere vicino alle zone abitate dall’uomo e sono responsabili della trasmissione della febbre dengue. Le zanzare si nutrono durante il giorno e preferiscono gli esseri umani ad altri animali. Aedes aegyptiihas il più alto modello di alimentazione umana a 76,9%, seguita da Aedes albopictus e Aedes vittatus zanzare, con 75% e 33,3% rispettivamente . L’incidenza della DF è stata associata alla quantità di vegetazione, alla copertura arborea, alla qualità delle abitazioni e all’area di terreno circostante.
Oltre ai luoghi di riproduzione artificiali, è stato dimostrato che il clima influenza l’ecologia della dengue influenzando le dinamiche del vettore, lo sviluppo dell’agente e l’interazione zanzara/uomo.13 La temperatura contribuisce a influenzare i tassi di sviluppo del vettore, la mortalità, il comportamento e controlla la replicazione virale nel vettore. I climi caldi permettono lo sviluppo larvale e una maggiore velocità di replicazione del virus, mentre i climi freddi rallentano lo sviluppo virale e diminuiscono il tempo di sopravvivenza delle zanzare, diminuendo così la possibilità di un vettore infettivo e diminuendo la trasmissione della febbre dengue. La temperatura interagisce anche con le precipitazioni come principale regolatore dell’evaporazione, influenzando così direttamente la disponibilità di habitat idrici e indirettamente la copertura e l’uso del suolo, che possono promuovere o impedire la crescita delle popolazioni di vettori.
I cambiamenti demografici e sociali come la crescita della popolazione, l’urbanizzazione e il trasporto moderno contribuiscono notevolmente all’aumento dell’incidenza e alla diffusione geografica dell’attività della dengue. Quando i viaggiatori si spostano dalle aree endemiche, tendono a servire come veicoli per un’ulteriore diffusione. La virulenza del ceppo virale e la variazione genetica del virus della dengue si prestano anche a un maggiore potenziale di trasmissione epidemica della DHF.
Patogenesi della febbre emorragica di dengue
Quando la zanzara si nutre dell’ospite umano, inietta il virus della dengue (DENV) nel flusso sanguigno e nell’epidermide e derma circostanti. Questo risulta nell’infezione delle cellule di Langerhans immature e dei cheratinociti attraverso l’endocitosi mediata dal recettore. La proteina E, la proteina di superficie, viene riconfigurata e permette la fusione della membrana e il rilascio dell’RNA virale nella cellula infettata. Le proteine non strutturali NS1 e NS2A controllano la replicazione dell’RNA virale e NS1 può anche essere implicata nell’attivazione della cascata del complemento. Le cellule infettate possono poi morire per apoptosi o necrosi o migrare verso i linfonodi dove vengono reclutati i macrofagi (Figura 3). L’infezione da uno qualsiasi dei quattro sierotipi di dengue (da DENV-1 a DENV-4) potrebbe essere asintomatica nella maggior parte dei casi perché il sistema immunitario dell’ospite è in grado di neutralizzarla localmente, ma può anche causare uno spettro di manifestazioni cliniche, la forma più grave è la DHF, che può progredire fino alla DSS e alla morte. Il DHF è clinicamente definito come una febbre continua da 2 a 7 giorni con manifestazioni emorragiche delle mucose o della pelle associate a trombocitopenia (<100.000 cellule/mm3) e un ematocrito superiore al 20% rispetto alla linea di base del paziente o della popolazione della stessa età. Le caratteristiche patologiche del DHF sono la perdita di plasma dalle superfici pleuriche o peritoneali e la coagulopatia intrinseca, che è clinicamente misurata da un test del laccio emostatico positivo, o da prove di sanguinamento spontaneo come petecchie o ecchimosi, sanguinamento gengivale o epistassi, o emorragia gastrointestinale.

Figura 3: Dopo essere stati morsi dalla zanzara Aedes aegypti, le cellule di Langerhans immature e i cheratinociti vengono infettati dal DENV. Le cellule infette scendono poi nella linfa dove vengono reclutati i macrofagi. Da qui l’infezione si diffonde in vari organi, tra cui il fegato, la milza e il midollo osseo. La necrosi del midollo osseo da DENV può portare alla soppressione dell’emopoiesi e alla diminuzione della trombogenesi nel sangue. La risposta infiammatoria, causata dal rilascio di chemochine e citochine da mastociti, macrofagi e linfociti, causa un aumento della permeabilità vascolare, disfunzione piastrinica, trombocitopenia e perdita di plasma. Anche se il meccanismo non è ben compreso, questa cascata sembra anche causare sanguinamento spontaneo, portando alle manifestazioni cliniche di petecchie, sanguinamento gengivale, ed emorragia gastrointestinale.
Questa forma grave della malattia è spesso il risultato di un’infezione secondaria in cui l’ospite viene infettato con un secondo sierotipo e ne deriva una complessa interazione tra il virus e la risposta immunitaria dell’ospite. Anche se il meccanismo che causa questa reazione non è ben compreso, l’evidenza suggerisce che l’infezione precedente può creare anticorpi cross-reattivi che legano il nuovo sierotipo, ma non sono in grado di neutralizzarlo. Questa è chiamata la teoria del potenziamento anticorpo-dipendente (ADE). Si pensa che gli anticorpi formati durante le precedenti infezioni contro le proteine strutturali del DENV, come la proteina E o la prM, non siano in grado di neutralizzare il nuovo patogeno e portino invece a un maggiore legame con le cellule positive al recettore Fcγ, permettendo la replicazione amplificata del virus. In risposta, il sistema immunitario rilascia una risposta esagerata di citochine, con conseguente aumento della permeabilità vascolare e della coagulopatia.
Anche i mastociti sono stati implicati nella patogenesi della DHF. In alcuni casi, i mastociti sembrano fornire una funzione protettiva in cui le molecole antivirali vengono rilasciate dalla de granulazione e altre cellule immunitarie, come i linfociti T e le cellule natural killer (NK) vengono reclutate, che aiutano a neutralizzare il virus. Tuttavia, in altri casi, i meccanismi di controllo locali non possono contenere il virus, ed esso viaggia attraverso il flusso sanguigno o il sistema linfatico per attivare i mastociti in altri organi come il fegato, la milza e i linfonodi. Quando si verifica la de granulazione in questi organi, vengono rilasciate proteasi e vengono sintetizzati mediatori infiammatori, come i leucotrieni e il fattore di crescita endoteliale vascolare (VEGF), aumentando la permeabilità dei capillari e portando alla perdita di plasma. Questo è importante perché diversi gruppi di mastociti rilasciano mediatori distinti durante il processo di de granulazione. Il complesso virus-anticorpo, forse attraverso l’antigene NS1 del virus della dengue, e la produzione di citochine portano anche all’attivazione del complemento. Il rilascio di frammenti C3a e C5a è noto per aumentare la permeabilità vascolare e quindi contribuire alla perdita di plasma.
Il tipo e la quantità di citochine rilasciate gioca un ruolo importante nel dettare la gravità della malattia. La proteina infiammatoria macrofagica 1β (MIP-1β) sembra essere un indicatore di una malattia meno grave, poiché viene rilasciata dalle cellule mononucleate infette e dalle cellule NK attivate. Agisce come un attrattore chemio per più cellule NK, attirandole nel sito infiammatorio, limitando la replicazione virale e l’effetto delle citochine a valle. L’interferone γ (IFN-γ), d’altra parte, ha dimostrato di indurre la perdita di plasma e di aumentare l’assorbimento delle particelle di dengue attraverso l’aumento dei recettori Fc sulle cellule bersaglio ed è quindi associato a manifestazioni cliniche più gravi e una prognosi sfavorevole. Altre citochine trovate per essere aumentate in DHF che sono state implicate nell’induzione della perdita di plasma includono l’interleuchina 2 (IL-2), il fattore di necrosi tumorale α (TNF- α), il fattore inibitorio della migrazione dei macrofagi (MIF), la proteina chemo-tattica monocitaria-1 (MCP-1), l’interleuchina-8 (IL-8), e il gruppo ad alta mobilità box-1 (HMGB-1) . Gli effetti del rilascio di citochine non si limitano alla permeabilità vascolare e alla perdita di plasma, ma sono anche implicati nelle manifestazioni emorragiche della DHF. Tuttavia, il meccanismo sottostante che causa il sanguinamento nel DHF è poco compreso. Sebbene la maggior parte delle cellule infette sia soggetta a morte per apoptosi, si verifica una certa necrosi, con conseguente rilascio di tossine, che attivano i sistemi di coagulazione e fibrinolisi. Quando si verificano alti livelli di necrosi nel midollo osseo a causa di un’elevata carica virale, l’ematopoietica viene soppressa, con conseguente tromboliticapenia. La conseguente diminuzione della trombogenesi e la disfunzione piastrinica possono causare la fragilità capillare e le conseguenti manifestazioni cliniche viste nella DHF. Alcuni studi indicano che il coinvolgimento del fegato nell’infezione da DENV può essere implicato nella tendenza al sanguinamento spontaneo, con una correlazione tra elevati livelli di enzimi epatici e una maggiore tendenza all’emorragia.
Segni e sintomi clinici
La manifestazione clinica della malattia comprende l’infezione asintomatica, la febbre dengue lieve (DF), la febbre emorragica dengue (DHF), o la sindrome da shock dengue (DSS), che è spesso grave a causa della permeabilità capillare anormale e la perdita di plasma . La dengue grave di solito si verifica tra i pazienti che sono stati infettati in precedenza con un virus dengue (cioè, infezione secondaria). Alti tassi di infezione grave dengue sono stati segnalati anche nei bambini con infezione primaria da virus dengue che sono nati da madri che sono state infettate in precedenza con un virus dengue.
La fase iniziale della DHF appare come febbre dengue. La sintomatologia di questa fase iniziale dipende dall’età del paziente e comprende un’improvvisa febbre alta (a volte con due picchi a 2 spalle), forte mal di testa, diminuzione dell’appetito, forte mialgia e artralgia, un’eruzione cutanea maculopapulare che appare da tre a quattro giorni dopo l’inizio della febbre, dolore retro-orbitale, fotofobia, linfoadenopatia, emorragie lievi (epistassi, sanguinamento gengivale, sanguinamento gastrointestinale, ematuria e menorragia) e un test del laccio emostatico positivo. I casi di DHF sono caratterizzati da quattro manifestazioni cliniche principali: febbre alta, fenomeni emorragici e, spesso, epatomegalia e insufficienza circolatoria. La malattia febbrile acuta caratteristica della fase iniziale consiste in una temperatura superiore a 39°C e rimane tale per 2-7 giorni.
I suddetti sintomi della fase iniziale peggiorano progressivamente con febbre e mal di testa continui, forti dolori o tenerezze addominali, vomito persistente, ematemesi, melena, petecchie, lividi facili, irrequietezza, letargia, sonnolenza, irritabilità, sanguinamento o lividi sotto la pelle. Dopo 2-7 giorni di febbre, una rapida caduta della temperatura è spesso accompagnata da segni di disturbi circolatori di varia gravità. Il paziente può sudare, essere irrequieto, avere le estremità fredde e mostrare cambiamenti nella frequenza del polso e nella pressione sanguigna. Dopo 24-48 ore dall’inizio delle caratteristiche specifiche del DHF, l’emostasi anormale e la perdita di plasma sono i sintomi caratteristici.
Un buon indicatore di questi avanzamenti è un ingrandimento del fegato superiore a 2 cm, poiché l’epatomegalia tende a precedere la perdita di plasma. Molti pazienti si riprendono con o senza trattamento di fluidi ed elettroliti. In casi gravi, la perdita di plasma può progredire fino allo shock e alla morte se non trattata. La ricerca suggerisce che sia un’infezione secondaria di dengue che la ritorsione esagerata della risposta del sistema immunitario di citochine aumentano la predilezione per un paziente a sviluppare DHF.
Si ritiene che i prodotti virali come la glicoproteina NS1 influenzino l’attivazione del complemento e la permeabilità vascolare con conseguente perdita di plasma che si sviluppa in ascite o versamenti pleurici. La risposta delle citochine è anche responsabile dell’aumento della permeabilità vascolare, in conseguenza del quale la pressione oncotica intravascolare è ridotta e facilita la perdita di liquido nei compartimenti extravascolari (Figura 4). L’emostasi anormale consiste nella trombocitopenia in concomitanza con un aumento dell’ematocrito, tempo di tromboplastina parziale prolungato con ridotta concentrazione di fibrinogeno, insieme alle già citate petecchie, gravi emorragie gastrointestinali, ecchimosi ed epistassi.
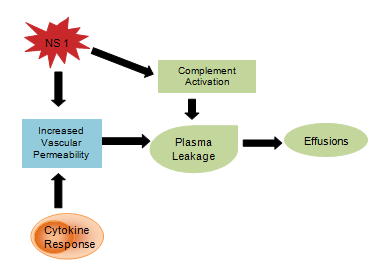
Figura 4: Risposta del sistema immunitario alle citochine.
Durante la fase febbrile viremica della DHF, si ritiene che la trombocitopenia e le successive manifestazioni avvengano a causa della soppressione del midollo osseo. Come menzionato in precedenza, la soppressione del midollo osseo è il risultato del fatto che è un sito di replicazione del virus e che attacca specificamente le cellule progenitrici ematopoietiche. Tuttavia, la distruzione immunomediata delle piastrine è stata suggerita anche dalla scoperta di complessi virus-anticorpo trovati sulla superficie delle piastrine dei pazienti DHF.
Le manifestazioni cliniche non comuni includono epatite acuta, insufficienza epatica, insufficienza renale acuta, encefalopatia o cardiomiopatia (miocardite acuta). Uno studio sulla DHF fatale nell’adulto ha esaminato le cause di mortalità diverse dalla sindrome da shock dengue (DSS) in pazienti con dengue grave e ha concluso che l’ipotermia, la leucocitosi e la bandemia potrebbero essere segni di attivazione della dengue grave. Lo studio consiglia inoltre ai medici di essere consapevoli del possibile sviluppo di una massiccia emorragia gastrointestinale, soprattutto nei pazienti che hanno una coscienza alterata precoce, una profonda trombocitopenia, un PT prolungato e/o leucocitosi. Ci sono molti metodi in cui la diagnosi di dengue può essere fatta. La diagnosi può essere effettuata attraverso l’isolamento del virus, l’acido nucleico virale, gli anticorpi e gli antigeni, o una combinazione di tutte queste tecniche. L’individuazione del virus della dengue tramite coltura è il test diagnostico definitivo, ma la considerazione pratica ne limita l’uso. La rilevazione dell’RNA virale è più veloce, ma la contaminazione può portare a risultati falsi positivi. Inoltre, il test sierologico può produrre un risultato falso positivo a causa di anticorpi cross-reattivi.
Le infezioni acute vengono rilevate nel siero, nel plasma e nelle cellule ematiche circolanti durante la fase iniziale di convalescenza, ovvero i primi 5-8 giorni dei sintomi. In questo periodo, la carica virale primaria può essere pari a 103 particelle di RNA/ml o superiore a 106 particelle di RNA/ml nelle infezioni secondarie. Attualmente, la combinazione dei test dell’antigene NS1 e degli anticorpi, così come i metodi molecolari, come la reazione a catena della polimerasi con trascrizione inversa in tempo reale (RT-PCR), vengono utilizzati più spesso per la diagnosi, poiché possono fornire risultati più rapidi e possono essere più sensibili. Anche l’analisi immunoistochimica e l’immunofluorescenza confermano la presenza del virus attraverso gli antigeni virali. Gli anticorpi IgM sono i primi a comparire entro i primi 3-5 giorni di infezione.
Sono a livelli di picco 2 settimane dopo la comparsa dei sintomi poi diminuiscono generalmente a livelli non rilevabili dopo 30-60 giorni. Gli anticorpi IgG, che sono più cross-reattivi, sono rilevati a bassi livelli dopo i primi 7-9 giorni di sintomi, aumentano lentamente fino a quattro volte, e rimangono rilevabili dopo diversi mesi e forse anche la vita. L’antigene umano e la risposta anticorpale dipendono dallo stato immunitario dell’ospite e sono presenti solo durante l’infezione primaria o secondaria. Non ci sono trattamenti specifici o farmaci antivirali per la dengue. La fisiopatologia della dengue aumenta la permeabilità vascolare, che porta a una significativa perdita di plasma dal compartimento intravascolare nello spazio extravascolare.
Questa perdita di liquido può portare allo shock e senza un’adeguata correzione porterà all’ipossia, all’acidosi metabolica e infine alla morte. Pertanto, la gestione primaria richiede una cura di supporto al ricovero con equilibrio di fluidi ed elettroliti. Il volume delle cellule imballate dovrebbe essere monitorato ogni ora, ogni 4-6 ore. Una perdita significativa di plasma è definita come un aumento >20% del volume delle cellule imballate o dell’ematocrito. Una volta che un paziente raggiunge questi livelli, è necessaria una sostituzione rapida e aggressiva del volume.
Il tasso di sostituzione del fluido in infusione dipende dal volume delle cellule imballate e dalla produzione di urina. Ci sono molteplici fluidi utilizzati per la sostituzione della perdita di plasma tra cui la soluzione fisiologica, il lattato di Ringer o l’acetato di Ringer, la soluzione di glucosio diluito al 5%, il plasma o i sostituti del plasma come la destrina 40 e il sangue fresco intero. Oltre alla sostituzione dei fluidi per via endovenosa, gli elettroliti possono essere introdotti per via orale per alleviare parte della sete e della disidratazione dovute alla febbre. Analgesici di supporto come l’acetaminofene possono essere usati per trattare la febbre e altri sintomi. I FANS e l’aspirina dovrebbero essere evitati perché potrebbero precipitare la sindrome di Reye.
Al recupero del DHF i pazienti devono soddisfare i seguenti criteri prima della dimissione dall’ospedale: miglioramento clinico visibile, afebrile senza l’uso di antipiretici per >24 ore, aumento dell’appetito, ematocrito stabile, produzione di urina adeguata, tre giorni dopo il recupero da una grave acidosi metabolica, conta delle piastrine >50.000/mm3, e nessuna sofferenza respiratoria da versamento pleurico o ascite.
Prevenzione ed eradicazione di aedes aegypti
Aedes aegypti, il vettore più diffuso del virus della dengue, è il principale obiettivo delle attività di sorveglianza e controllo. Altri vettori, come Aedes albopictus, possono produrre la febbre dengue, ma le attività di sorveglianza e controllo per i diversi vettori dovrebbero essere prese in considerazione solo se ci sono prove affidabili che quei vettori hanno giocato un ruolo epidemiologicamente significativo nella trasmissione delle infezioni da dengue . La prima iniziativa per eliminare Aedes aegypti fu a Cuba nel 1901. La fumigazione e l’eliminazione dei focolai di zanzara attraverso la distruzione dei contenitori abbandonati furono i primi passi per sradicare il vettore. Dopo le epidemie di febbre gialla verificatesi in Brasile nel 1928 e nel 1932, fu evidente che la protezione completa delle popolazioni urbane dipendeva dall’eliminazione assoluta della zanzara Aedes aegyptimosquito; questo portò all’approvazione da parte dell’Organizzazione Panamericana della Sanità (PAHO) del piano continentale di Aedes aegyptieradication nel 1947 per combattere la febbre gialla urbana. Dal 1947, il Pan American Sanitary Bureau (PASB) promosse intensamente campagne in tutti i paesi colpiti, e il loro successo fu dimostrato nel 1962, quando 18 paesi continentali e alcune isole dei Caraibi avevano raggiunto l’eradicazione. Come risultato di questi sforzi, il genotipo V del DENV-2 americano è l’unico virus della dengue che rimane oggi.
Nonostante gli sforzi per eradicare il vettore, Aedes aegypti non è stato eradicato a Cuba, negli Stati Uniti, in Venezuela e in diversi paesi dei Caraibi. Decenni di sforzi umani senza precedenti per sradicare l’Aedes aegyptifell sono andati in pezzi molto rapidamente e hanno portato rapidamente all’infestazione. La mancanza di sorveglianza e il deterioramento della struttura del programma di eradicazione, l’insufficiente igiene ambientale e l’insufficiente partecipazione della comunità sono stati alcuni dei fattori che hanno portato al declino degli sforzi per eradicare il vettore. Ad oggi, non esiste un vaccino disponibile per prevenire le infezioni da dengue. Takeda Vaccines Inc. sta sviluppando un candidato vaccino vivo e attenuato noto come vaccino tetravalente contro la dengue (TDV) che è composto da un ceppo attenuato di DENV-2 (TDV-2) e da tre virus chimerici contenenti i geni della proteina prM ed E di DENV-1, -3 e -4 che sono stati espressi nel contesto del backbone del genoma attenuato TDV-2 (TDV-1, TDV-3, e TDV-4, rispettivamente). Il vaccino ha dimostrato di essere ben tollerato e immunogenico in uno studio clinico di fase 2 in paesi endemici di dengue tra adulti e bambini.
Il vaccino è in fase 3 di sviluppo. Inoltre, Sanofi Pasteur ha sviluppato un vaccino dengue ricombinante, vivo-attenuato, tetravalente (CYD-TDV) che ha mostrato sicurezza ed efficacia coerenti in individui ≥9 anni in paesi endemici; è in fase avanzata di sviluppo. Dengvaxia (CYD-TDV) di Sanofi Pasteur è stato registrato per la prima volta in Messico nel dicembre 2015 ed è stato valutato come una serie di 3 dosi su un programma 0/6/12 mesi in studi clinici di fase III. Ci sono circa cinque ulteriori candidati vaccinali in fase di valutazione negli studi clinici. I viaggiatori in aree endemiche di dengue sono a rischio di contrarre la dengue; quindi, per la prevenzione, dovrebbero essere incoraggiati a scegliere alloggi con finestre e porte ben schermate, utilizzare repellenti per insetti, indossare abbigliamento adeguato, e svuotare e coprire qualsiasi acqua stagnante che può diventare siti di riproduzione delle zanzare.
Situazione globale attuale
Attualmente, si prevede che l’incidenza della dengue continuerà ad aumentare a causa di molti fattori tra cui lo stato socioeconomico, i continui cambiamenti climatici, i viaggi e la globalizzazione. I vaccini sono ancora in fase di sviluppo e attualmente non esiste una terapia antivirale specifica per affrontare la crescente minaccia della dengue. La stima globale dell’incidenza della dengue è compresa tra 50 e 200 milioni. Tuttavia, l’uso di approcci cartografici suggerisce recentemente che il numero dell’incidenza è più vicino a 400 milioni. Nel 2012, l’OMS ha classificato la dengue come una delle malattie virali vitali trasmesse dalle zanzare. Questa classificazione è giustificata dalla significativa diffusione geografica del virus insieme al suo vettore in aree che non erano precedentemente colpite (Figura 5).
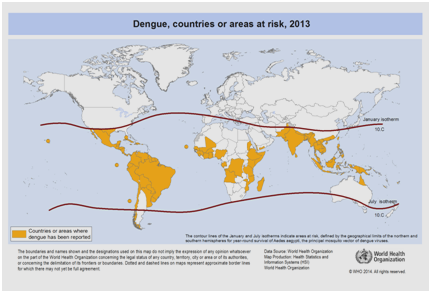
Figura 5: Paesi o aree del mondo in cui la dengue è stata segnalata nel 2013, secondo i dati raccolti dall’Organizzazione Mondiale della Sanità
È anche supportata dal costo che la malattia porta con sé. Confrontando l’onere della dengue e di altre malattie trasmissibili nella regione colpita, la dengue causa molta più sofferenza umana ed è più di un peso rispetto alle altre malattie trasmesse da vettori. Secondo l’OMS, la dengue è la principale causa di ricovero e di morte nei bambini del sud-est asiatico. Uno studio di Hammond et al. ha riportato che la maggior parte della morbilità e della mortalità legate a questa malattia è associata ai bambini piuttosto che a qualsiasi altro gruppo di età. I neonati tra i 4 e i 9 mesi di età e i bambini tra i 5 e i 9 anni sono i più colpiti dalla dengue (Figura 6). La gravità della malattia in questi bambini è spesso dovuta all’infezione secondaria da DENV. Uno studio ecologico condotto da Dıaz-Quijano e Waldman in America Latina e nei Caraibi ha scoperto che i determinanti del tasso di mortalità per dengue in queste popolazioni includevano la durata dell’endemicità riconosciuta, la densità della popolazione e le precipitazioni.
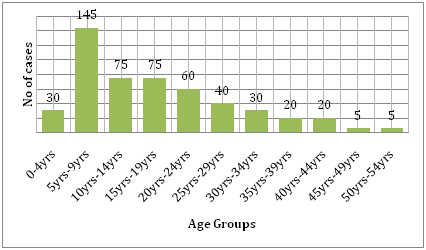
Figura 6: Distribuzione per fasce d’età della coorte di studio a León
Oltre all’impatto della morbilità e della mortalità, il virus della dengue comporta un elevato onere finanziario per le regioni colpite, molte delle quali sono mal equipaggiate per sostenere questi costi. Nel 2010, l’onere finanziario del virus della dengue è stato stimato a 2,1 miliardi di dollari all’anno in media nelle Americhe (in dollari USA 2010), con una gamma di 1-4 miliardi di dollari nelle analisi di sensibilità e una sostanziale variazione da un anno all’altro. Secondo l’OMS, la dengue è ora vista come una preoccupazione mondiale con l’Asia-Pacifico che favorisce la più alta (75%) popolazione globale con esposizione al virus della dengue. Il Pacifico occidentale ha anche sperimentato un continuo aumento del numero di casi segnalati di DF negli ultimi dieci anni.
Anche con l’assenza di trasmissione di DF nella metà del 20 ° secolo, vi è ora la presenza di un aumento endemico di DF indigena nelle Americhe. Solo nelle Americhe, nel 2010, ci sono stati oltre 1,6 milioni di casi segnalati di dengue e 49.000 di questi sono stati gravi dengue . In Africa, i focolai di DF stanno aumentando in dimensioni e frequenza, ma non sono stati segnalati in modo coerente all’OMS. Tra il 1960 e il 2010, casi sporadici sono stati segnalati da 22 paesi africani, come suggerito dai dati disponibili sui focolai. In Europa, nessuna epidemia di DF è stata riportata da un’epidemia in Grecia nel 1928. Ci sono ora minacce di epidemia in Europa, che è stata attribuita a Aedes albopictus a causa di viaggi da paesi in cui la malattia è endemica. Si stima che ci sarà un aumento dell’incidenza della malattia negli anni a venire a causa di fattori di rischio multifattoriali.