Cellen bevatten veel water. Een van de functies van het water is het oplossen van verschillende materialen. Zo zijn er bijvoorbeeld veel verschillende ionische verbindingen (zouten) in cellen. Ionen worden gebruikt om de celpotentiaal op peil te houden en zijn belangrijk bij celsignalering en spiersamentrekking.
Hoe kun je zien of een verbinding ionisch of covalent is?
Er is geen eenvoudig antwoord op deze vraag. Veel verbindingen zitten ergens tussenin. In een polaire covalente binding wordt een elektronenpaar gedeeld tussen twee atomen om hun octetten te vervullen, maar de elektronen liggen dichter bij het ene uiteinde van de binding dan bij het andere. Er is meer negatieve lading naar het ene uiteinde van de binding, en dat laat meer positieve lading over aan het andere uiteinde.
Kijkend naar de elektronegativiteitswaarden van verschillende atomen helpt ons om te bepalen hoe gelijkmatig een elektronenpaar in een binding wordt gedeeld. De elektronegativiteit neemt toe naar de rechterbovenhoek van het periodiek systeem door een combinatie van kernlading en afschermingsfactoren. Atomen in de rechterbovenhoek van het periodiek systeem hebben een grotere aantrekkingskracht op hun gedeelde bindingselektronen, terwijl die in de linkerbenedenhoek een zwakkere aantrekkingskracht hebben op de elektronen in covalente bindingen.
In een koolstof-zuurstofbinding zouden meer elektronen worden aangetrokken tot de zuurstof, omdat die rechts van de koolstof staat in zijn rij in het periodiek systeem. Verbindingen als , dimethyl ether, CH3OCH3, zijn een beetje polair. Formaldehyde, CH2O, is nog polairder. Elektronen in pi bindingen worden losser gehouden dan elektronen in sigma bindingen, om redenen die te maken hebben met kwantummechanica. Daardoor kan de zuurstof de elektronen gemakkelijker naar zich toe trekken in een meervoudige binding dan in een sigma binding.

Niet alle polariteiten zijn eenvoudig te bepalen door een blik op het periodiek systeem te werpen. De richting van de dipool in een boor-waterstofverbinding is moeilijk te voorspellen zonder de elektronegativiteitswaarden op te zoeken, aangezien boor verder naar rechts ligt en waterstof hoger. Een binding is ionisch als het verschil in elektronegativiteit tussen de atomen groot genoeg is dat het ene atoom een elektron volledig van het andere atoom kan wegtrekken. Die situatie komt vaak voor bij verbindingen die elementen uit de linkerrand van het periodiek systeem (natrium, kalium, calcium, enz.) combineren met elementen in de uiterste rechterbovenhoek van het periodiek systeem (meestal zuurstof, fluor, chloor). Natriumchloride is een ionische verbinding.
Vele bindingen kunnen covalent zijn in de ene situatie en ionisch in een andere. Bijvoorbeeld, waterstofchloride, HCl, is een gas waarin de waterstof en chloor covalent gebonden zijn, maar als HCl in water borrelt, ioniseert het volledig om de H+ en Cl- van een zoutzuuroplossing te geven. Zelfs in gasvormig HCl is de lading niet gelijkmatig verdeeld. Het chloor is gedeeltelijk negatief en de waterstof gedeeltelijk positief.
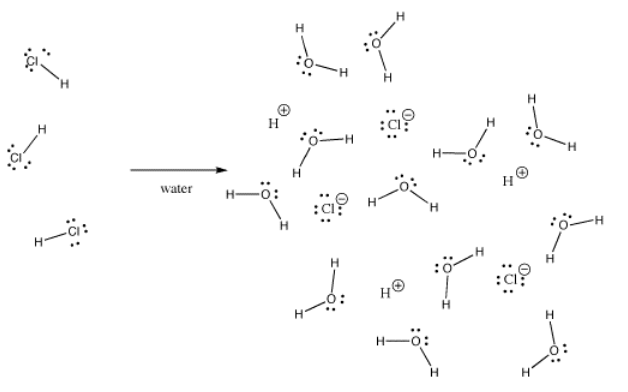
Kaliumhydroxide, KOH, bevat één binding die covalent is (O-H) en één die ionisch is (K-O). Waterstof is lastig omdat het zowel aan de bovenkant als aan de linkerkant van het periodiek systeem staat. Het is net elektropositief genoeg om in sommige gevallen ionische bindingen te vormen. In KOH is de K-O binding ionisch omdat het verschil in elektronegativiteit tussen kalium en zuurstof groot is. Het verschil in elektronegativiteit tussen zuurstof en waterstof is niet klein. Een O-H binding kan soms ioniseren, maar niet in alle gevallen.
Soms hangt ionisatie af van wat er nog meer aan de hand is in een molecuul. Omdat de K-O binding in kaliumhydroxide ionisch is, is het niet erg waarschijnlijk dat de O-H binding ioniseert. Er is al een negatieve lading op zuurstof. Laadscheiding kost energie, dus is het moeilijker om een tweede negatieve lading op de zuurstof te zetten door ook de O-H binding te ioniseren. Vaak zijn eerste ionisaties in moleculen veel gemakkelijker dan tweede ionisaties.
Oefening
Voorspel de richting van de polariteit in een binding tussen de atomen in de volgende paren:
a) zwavel-zuurstof b) silicium-fluor
c) waterstof-natrium d) chloor-aluminium
Antwoord
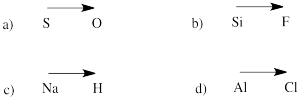
Omdat het zo gewoon is dat een element uit de uiterste linkerhand van het periodiek systeem als kation aanwezig is, en dat elementen uiterst rechts een negatieve lading hebben, kunnen we vaak aannemen dat een verbinding die een voorbeeld van elk bevat ten minste één ionische binding zal hebben.
Oefening:
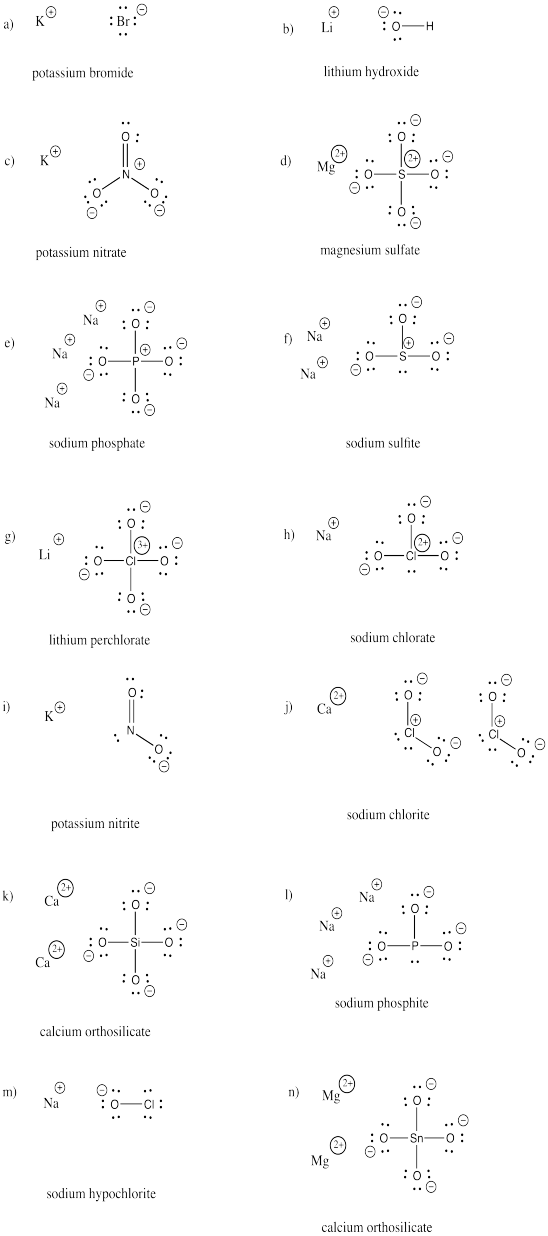
Teken de structuren van de volgende verbindingen. Elke verbinding bevat ten minste een anion en een kation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Antwoord
Oefening: (Pagina-index{3})
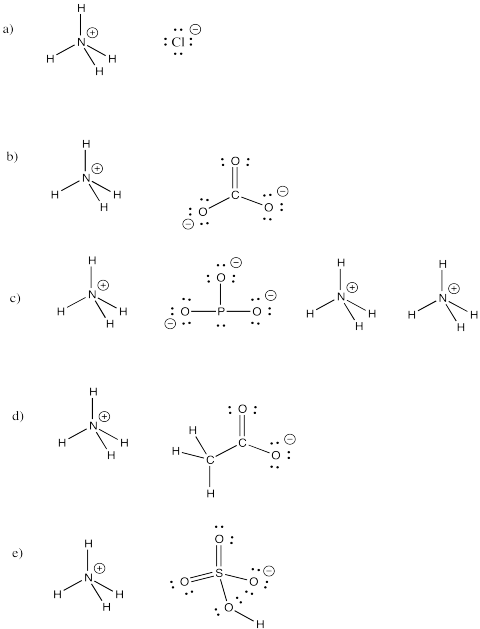
Ammonium ion, NH4+, is een veel voorkomend molecuulion. Teken de structuren van de volgende verbindingen waarin dit ion voorkomt.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Antwoord
Oefening
Veel anionen hebben namen die je iets vertellen over hun structuur.
| prefix- of -suffix |
gemeenschappelijke betekenis |
voorbeeldnaam | voorbeeldformule |
| -ide | -atoom is aanwezig als anion | chloride | Cl – |
| -ate | -atoom is aanwezig als oxyanion; meestal een veel voorkomende vorm | chloraat | ClO3- |
| -iet | -atoom is aanwezig als een oxyanion, maar met minder oxygenen (of lagere “oxidatietoestand”) dan een andere veel voorkomende vorm | chloriet | ClO2- |
| per- | atoom aanwezig is als een oxyanion, maar met nog meer oxygenen dan de “-ate” vorm | perchloraat | ClO4- |
| hypo- | atoom is aanwezig als een oxyanion, maar met nog minder oxygenen dan de “-iet”-vorm | hypochloriet | ClO- |
Stel, gebruikmakend van de tabel als leidraad, namen voor de volgende anionen voor:
a) Br- b) O2- c) F- d) CO32- (gewoon oxyanion) e) NO3- (gewoon oxyanion) f) NO2-
g) S2- h) SO42- (gewoon oxyanion) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (gewoon oxyanion) o) PO33- p) I- q) IO3- (gewoon oxyanion) r) IO4-
Antwoord a)
bromide
Antwoord b)
oxide
Antwoord c)
fluoride
Antwoord d)
carbonaat
Antwoord e)
nitraat
Antwoord f)
nitriet
Antwoord g)
sulfide
Antwoord h)
sulfaat
Antwoord i)
sulfiet
Antwoord j)
persulfaat
Antwoord k)
carbide
Antwoord l)
nitride
Antwoord m)
arsenide
Antwoord n)
fosfaat
Antwoord o)
fosfiet
Antwoord p)
iodide
Antwoord q)
iodaat
Antwoord r)
periodaat
Attributie
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)