Atoomemissiespectra
De elektronen in een atoom hebben de neiging zo gerangschikt te zijn dat de energie van het atoom zo laag mogelijk is. De grondtoestand van een atoom is de toestand met de laagste energie van het atoom. Wanneer die atomen energie krijgen, absorberen de elektronen de energie en gaan ze naar een hoger energieniveau. Deze energieniveaus van de elektronen in atomen zijn gekwantiseerd, wat opnieuw betekent dat het elektron van het ene energieniveau naar het andere moet gaan in discrete stappen, in plaats van continu. Een aangeslagen toestand van een atoom is een toestand waarin zijn potentiële energie hoger is dan de grondtoestand. Een atoom in de aangeslagen toestand is niet stabiel. Wanneer het terugkeert naar de grondtoestand, geeft het de energie vrij die het eerder had opgedaan in de vorm van elektromagnetische straling.
Hoe winnen atomen dan energie? Eén manier is een elektrische stroom te laten lopen door een gasmonster onder lage druk. Aangezien de elektronen-energieniveaus voor elk element uniek zijn, zal elke gasontladingsbuis gloeien met een kenmerkende kleur, afhankelijk van de identiteit van het gas (zie hieronder).

“Neon”-borden zijn bekende voorbeelden van gasontladingsbuizen. Alleen borden die gloeien met de rood-oranje kleur uit de figuur zijn echter daadwerkelijk gevuld met neon. Borden met andere kleuren bevatten andere gassen of mengsels van gassen.
Wetenschappers bestudeerden de kenmerkende roze kleur van de gasontlading die door waterstofgas wordt gecreëerd. Wanneer een smalle bundel van dit licht door een prisma werd bekeken, werd het licht gescheiden in vier lijnen met zeer specifieke golflengten (en frequenties, aangezien de golflengten omgekeerd evenredig zijn met de frequenties). Een atomair emissiespectrum is het lijnenpatroon dat ontstaat wanneer licht door een prisma gaat om het te scheiden in de verschillende frequenties van het licht dat het bevat. De onderstaande figuur toont het atomaire emissiespectrum van waterstof.
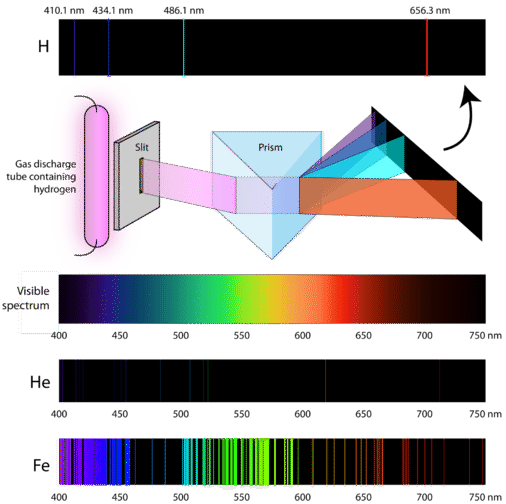
De klassieke theorie was niet in staat om het bestaan van atomaire emissiespectra, ook wel lijnemissiespectra genoemd, te verklaren. Volgens de klassieke natuurkunde zou een atoom in de grondtoestand elke hoeveelheid energie kunnen absorberen in plaats van alleen discrete hoeveelheden. Evenzo zou, wanneer de atomen zich weer ontspannen naar een lagere energietoestand, elke hoeveelheid energie kunnen vrijkomen. Dit zou resulteren in wat bekend staat als een continu spectrum, waarin alle golflengtes en frequenties vertegenwoordigd zijn. Wit licht gezien door een prisma en een regenboog zijn voorbeelden van continue spectra. Atomaire emissiespectra waren meer bewijs voor de gekwantiseerde aard van licht en leidden tot een nieuw model van het atoom gebaseerd op de kwantumtheorie.