Periodieke tendensen
Eerst zullen we ons concentreren op individuele atomen, en nadenken over tendensen die samenhangen met de positie van een element op het periodiek systeem. We gebruiken als eerste modellen de eenvoudige organische verbindingen ethaan, methylamine en ethanol, maar de concepten zijn evenzeer van toepassing op complexere biomoleculen met dezelfde functionaliteiten, bijvoorbeeld de zijketens van de aminozuren alanine (alkaan), lysine (amine), en serine (alcohol).
Horizontale periodieke trend in zuurtegraad en basen:
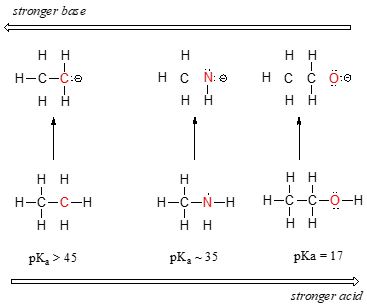
We kunnen een duidelijke trend in zuurtegraad zien als we van links naar rechts langs de tweede rij van het periodiek systeem gaan, van koolstof naar stikstof naar zuurstof. De sleutel tot het begrijpen van deze trend is de hypothetische geconjugeerde base in elk geval te beschouwen: hoe stabieler (zwakker) de geconjugeerde base, hoe sterker het zuur. Kijk naar waar de negatieve lading terechtkomt in elke geconjugeerde base. In de geconjugeerde base van ethaan wordt de negatieve lading gedragen door een koolstofatoom, terwijl in de geconjugeerde base van methylamine en ethanol de negatieve lading zich bevindt op respectievelijk een stikstof en een zuurstof. Herinner je uit paragraaf 2.4A dat de elektronegativiteit ook toeneemt naarmate we van links naar rechts langs een rij van het periodiek systeem gaan, wat betekent dat zuurstof het meest elektronegatief is van de drie atomen, en koolstof het minst.
Noot
Hoe elektronegatiever een atoom, hoe beter het in staat is een negatieve lading te dragen. Zwakkere basen hebben negatieve ladingen op meer elektronegatieve atomen; sterkere basen hebben negatieve ladingen op minder elektronegatieve atomen.
Dus is het methoxide-anion het meest stabiele (laagste energie, minst basisch) van de drie geconjugeerde basen, en het ethylcarbanion-anion het minst stabiele (hoogste energie, meest basisch). Omgekeerd is ethanol het sterkste zuur, en ethaan het zwakste zuur.
Wanneer we verticaal binnen een bepaalde kolom van het periodiek systeem bewegen, zien we opnieuw een duidelijke periodieke trend in zuurgraad. Dit wordt het best geïllustreerd met de halozuren en halogeniden: de basische waarde neemt, net als de elektronegativiteit, toe naarmate men hoger in de kolom komt.
Verticale periodieke trend in zuurgraad en basen:

Omgekeerd neemt de zuurgraad in de halozuren toe naarmate we ons in de kolom naar beneden begeven.
Om deze trend te kunnen begrijpen, zullen we nogmaals kijken naar de stabiliteit van de geconjugeerde basen. Omdat fluor het meest elektronegatieve halogeenelement is, zou men kunnen verwachten dat fluoride ook het minst basische halogeenion is. Maar in feite is het het minst stabiele, en het meest basische! Het blijkt dat bij verticale verschuivingen in het periodiek systeem, de grootte van het atoom belangrijker is dan de elektronegativiteit met betrekking tot de basische eigenschappen. De atoomstraal van jodium is ongeveer twee keer zo groot als die van fluor, dus in een jodide-ion wordt de negatieve lading over een aanzienlijk groter volume verdeeld:

Dit illustreert een fundamenteel concept in de organische chemie:
Elektrostatische ladingen, of ze nu positief of negatief zijn, zijn stabieler wanneer ze over een groter oppervlak worden ‘uitgespreid’.
Dit idee zullen we tijdens onze studie van organische reactiviteit steeds weer terugzien, in allerlei verschillende contexten. Voor nu passen we het concept alleen toe op de invloed van de atomaire straal op de basissterkte. Omdat fluoride de minst stabiele (meest basische) van de halogenideconjugaatbasen is, is HF de minst zure van de halozuren, slechts iets sterker dan een carboxylzuur. HI, met een pK van ongeveer -9, is bijna even sterk als zwavelzuur.
Meer belangrijk voor de studie van de biologische organische chemie is dat deze trend ons vertelt dat thiolen zuurder zijn dan alcoholen. Zo is de thiolgroep op de cysteïneketen ongeveer 8,3, terwijl de alcoholgroep op de serineketen in de orde van grootte van 17 is.
Herinnert u zich het begrip ‘drijvende kracht’ dat in paragraaf 6.2 werd geïntroduceerd? Herinner je dat de drijvende kracht voor een reactie gewoonlijk gebaseerd is op twee factoren: relatieve ladingsstabiliteit, en relatieve totale bindingsenergie. Laten we eens kijken hoe dit van toepassing is op een eenvoudige zuur-base reactie tussen zoutzuur en fluoride-ion:
We weten dat HCl (pK_a) -7) een sterker zuur is dan HF (pK_a) 3.2), dus het evenwicht voor de reactie ligt aan de productzijde: de reactie is exergetisch, en een ‘drijvende kracht’ duwt reactant naar product.
Wat verklaart deze drijvende kracht? Beschouw eerst de ladingsfactor: zoals we zojuist hebben geleerd, is het chloride-ion (aan de kant van het product) stabieler dan het fluoride-ion (aan de kant van de reactant). Dit verklaart voor een deel de drijvende kracht van reactant naar product in deze reactie: we gaan van een minder stabiel ion naar een stabieler ion.
Hoe zit het met de totale bindingsenergie, de andere factor in de drijvende kracht? Als je een tabel met bindingsenergieën raadpleegt, zul je zien dat de H-F binding aan de productzijde energieker (sterker) is dan de H-Cl binding aan de reactantzijde: respectievelijk 570 kJ/mol vs 432 kJ/mol). Dit draagt ook bij aan de drijvende kracht: we gaan van een zwakkere (minder stabiele) binding naar een sterkere (stabielere) binding.