Structurele instabiliteit van enzymen
Het feit dat actieve sites zo goed geschikt zijn om specifieke omgevingscondities te bieden, betekent ook dat ze onderhevig zijn aan invloeden van de lokale omgeving. Het is waar dat verhoging van de omgevingstemperatuur over het algemeen de reactiesnelheid verhoogt, al dan niet door enzymen gekatalyseerd. Verhoging of verlaging van de temperatuur buiten een optimaal bereik kan echter de chemische bindingen in de actieve zone zodanig beïnvloeden dat zij minder geschikt zijn om substraten te binden. Hoge temperaturen zullen er uiteindelijk toe leiden dat enzymen, net als andere biologische moleculen, denatureren, een proces dat de natuurlijke eigenschappen van een stof verandert. Ook de pH van de plaatselijke omgeving kan van invloed zijn op de werking van enzymen. Aminozuurresiduen op de actieve plaats hebben hun eigen zure of basische eigenschappen die optimaal zijn voor katalyse. Deze residuen zijn gevoelig voor veranderingen in de pH-waarde die afbreuk kunnen doen aan de manier waarop substraatmoleculen zich binden. Enzymen functioneren het best binnen een bepaald pH-bereik, en net als bij temperatuur kunnen extreme pH-waarden (zuur of basisch) van de omgeving ertoe leiden dat enzymen denatureren.
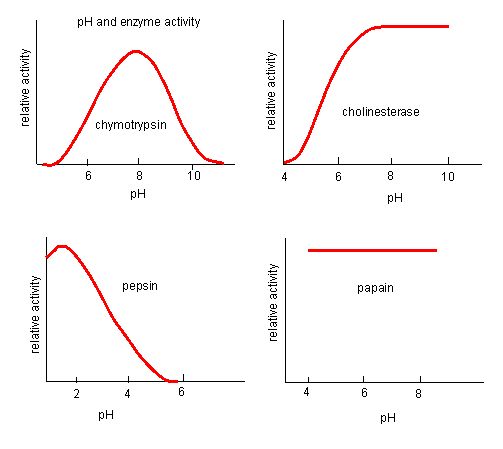
Figuur 4. Enzymen hebben een optimale pH. De pH-waarde waarbij het enzym het actiefst is, is de pH-waarde waarbij de R-groepen op de actieve site worden geprotoneerd/deprotoneerd, zodat het substraat de actieve site kan binnendringen en de eerste stap in de reactie kan beginnen. Sommige enzymen hebben een zeer lage pH (zuur) nodig om volledig actief te zijn. In het menselijk lichaam bevinden deze enzymen zich hoogstwaarschijnlijk in de ondermaag, of in lysosomen (een cellulair organel dat wordt gebruikt om grote verbindingen in de cel te verteren).
Bron: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Het proces waarbij enzymen denatureren begint meestal met het afwikkelen van de tertiaire structuur door destabilisatie van de bindingen die de tertiaire structuur bijeenhouden. Waterstofbruggen, ionische bindingen en covalente bindingen (disulfidebruggen en peptidebindingen) kunnen allemaal worden verbroken door grote veranderingen in temperatuur en pH. Maak met behulp van de grafiek van enzymactiviteit en temperatuur hieronder een energieverhaal voor het rode enzym. Leg uit wat er zou kunnen gebeuren van 37 °C tot 95 °C.
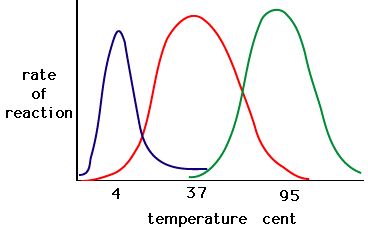
Figuur 5. Enzymen hebben een optimale temperatuur. De temperatuur waarbij het enzym het actiefst is, is meestal de temperatuur waarbij de structuur van het enzym stabiel is of niet wordt aangetast. Sommige enzymen hebben een specifieke temperatuur nodig om actief te blijven en niet te denatureren. Bron: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Induced fit and enzyme function
Voor vele jaren dachten wetenschappers dat enzym-substraat binding plaatsvond op een eenvoudige “lock-and-key” manier. Dit model ging ervan uit dat het enzym en het substraat perfect op elkaar aansloten in één momentane stap. Het huidige onderzoek ondersteunt echter een meer verfijnde zienswijze die geïnduceerde fit wordt genoemd. Het geïnduceerde-fit-model breidt het “lock-and-key”-model uit door een meer dynamische interactie tussen enzym en substraat te beschrijven. Wanneer het enzym en het substraat samenkomen, veroorzaakt hun interactie een lichte verschuiving in de structuur van het enzym die een meer productieve bindingsregeling tussen het enzym en de overgangstoestand van het substraat bevestigt. Deze energetisch gunstige binding maximaliseert het vermogen van het enzym om zijn reactie te katalyseren.
Wanneer een enzym zijn substraat bindt, wordt een enzym-substraatcomplex gevormd. Dit complex verlaagt de activeringsenergie van de reactie en bevordert het snelle verloop ervan op een van de vele manieren. Op een basaal niveau bevorderen enzymen chemische reacties waarbij meer dan één substraat betrokken is, door de substraten in een optimale oriëntatie bij elkaar te brengen. De juiste regio (atomen en bindingen) van het ene molecuul wordt naast de juiste regio van het andere molecuul geplaatst waarmee het moet reageren. Een andere manier waarop enzymen de reactie van hun substraten bevorderen is door binnen de actieve site een energetisch gunstige omgeving te creëren waarin de reactie kan plaatsvinden. Bepaalde chemische reacties verlopen wellicht het beste in een licht zure of apolaire omgeving. De chemische eigenschappen die voortvloeien uit de bijzondere rangschikking van aminozuurresiduen binnen een actieve site creëren de energetisch gunstige omgeving voor de specifieke substraten van een enzym om te reageren.
De activeringsenergie die nodig is voor veel reacties omvat de energie die betrokken is bij het enigszins vervormen van chemische bindingen, zodat ze gemakkelijker kunnen reageren. Enzymatische werking kan dit proces helpen. Het enzym-substraatcomplex kan de activeringsenergie verlagen door de substraatmoleculen zodanig te vervormen dat de bindingen gemakkelijker worden verbroken. Tenslotte kunnen enzymen ook de activeringsenergie verlagen door aan de chemische reactie zelf deel te nemen. De aminozuurresiduen kunnen bepaalde ionen of chemische groepen leveren die daadwerkelijk covalente bindingen vormen met substraatmoleculen als een noodzakelijke stap in het reactieproces. In deze gevallen is het belangrijk te onthouden dat het enzym na voltooiing van de reactie altijd naar zijn oorspronkelijke toestand terugkeert. Een van de kenmerkende eigenschappen van enzymen is dat zij uiteindelijk onveranderd blijven door de reacties die zij katalyseren. Nadat een enzym klaar is met het katalyseren van een reactie, geeft het zijn product(en) vrij.
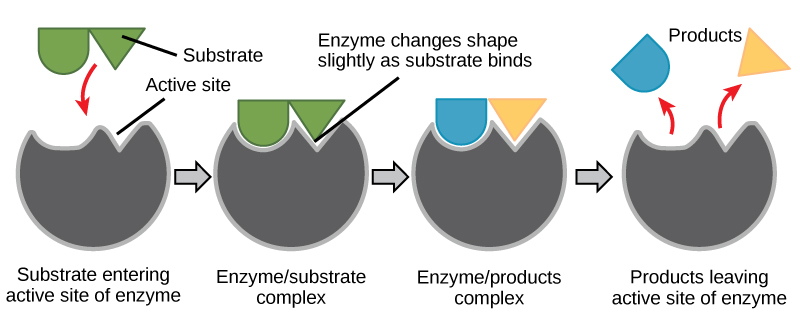
Figuur 6. Volgens het geïnduceerde-fit-model ondergaan zowel het enzym als het substraat dynamische conformatieveranderingen bij binding. Het enzym vervormt het substraat in zijn overgangstoestand, waardoor de snelheid van de reactie toeneemt.
Een energieverhaal maken voor de reactie hierboven
Beantwoord met behulp van figuur 6 de vragen die in het energieverhaal worden gesteld.
1. Wat zijn de reactanten? Wat zijn de producten?
2. Welke arbeid is door het enzym verricht?
3. In welke toestand bevindt de energie zich aanvankelijk? In welke toestand is de energie in de eindtoestand getransformeerd? Dit kan nog lastig worden, maar probeer te bepalen waar de energie zich in de begintoestand en in de eindtoestand bevindt.