Wanneer u het bestaan van de atoomkern hebt vastgesteld, kunt u nu de experimentele bewijzen voor de grootte ervan bekijken, te beginnen met het Rutherford-experiment.
Samenvatting van de les
- Discussie en uitgewerkt voorbeeld: Grootte van de atoomkern (15 minuten)
- Discussie: Grootte van atoom en kern (10 minuten)
- Studentenvragen: Krachten en dichtste nadering (30 minuten)
- Discussie: Atoomnummer en de lading van een atoomkern (5 minuten)
- Discussie: Bovengrens van de grootte van een kern (30 minuten)
- Discussie: Een puzzel voor een volgende les (5 minuten)
Discussie en uitgewerkt voorbeeld: Grootte van de atoomkern
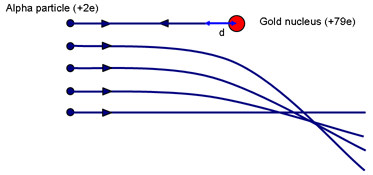
U kunt een idee krijgen van de mogelijke grootte van de atoomkern door na te denken over het experiment van Rutherford. Vraag: Welke botsingsparameter zal ertoe leiden dat een deeltje het dichtst bij de kern komt? (Een frontale botsing met p = 0.)
Het principe van behoud van energie wordt gebruikt om de afstand van de dichtste nadering te berekenen als maat voor de grootte van een atoomkern. Het begrip van de berekening die volgt hangt af van de vraag of de leerlingen de elektrische potentiaal en de velden hebben behandeld. Als alternatief is het een goede revisie.
Aflevering 522-1: Verstrooiing van alfadeeltjes – naderingsafstand (Word, 29 KB)
Aflevering 522-2: naderingsafstand (Word, 107 KB)
Wanneer de α even tot rust wordt gebracht (nadat hij zo ver mogelijk de elektrostatische heuvel is opgeklommen), is er arbeid verricht tegen de afstotende kracht van de kern. De kinetische energie van de α is opgeslagen in het veld rond de kern. Als de snelheid nul is, is alle energie nu in het veld opgeslagen.
Als de α even stilstaat op een afstand d van (het centrum van) de kern van lading Ze, is de energie in het veld:
Eα = 14πε0 2e Zed
Dit is gelijk aan de aanvankelijke kinetische energie van het α-deeltje. Rutherford gebruikte een α-bron die hij van Madame Curie had gekregen. De α-energie was ~ 7,7 MeV.
Voor goud is Z = 79. Oplossen geeft d ~ 3 × 10-14 m. Vergelijk dit met de diameter van goudatomen ~ 3 × 10-10 m. Een atoomkern is dus minstens 10 000 keer kleiner dan een atoom. Het is belangrijk te benadrukken dat deze berekening een bovengrens geeft voor de grootte van de goudkern; we kunnen niet zeggen dat het alfadeeltje de kern raakt; een energiekere α zou nog dichterbij kunnen komen.
Een atoom is voor het grootste deel leeg (daarom gingen de meeste as er dwars doorheen – eventuele elektronen zouden de relatief massieve α met hoge snelheid nauwelijks hinderen).
Discussie: Grootte van atoom en kern
Vraag uw leerlingen om een schaalmodel van het atoom voor te stellen. Bijvoorbeeld: als een atoomkern een diameter had van 1 mm, dan zou een atoom 10 000 keer groter zijn of 10 m in diameter. Kies een geschikte plaats voor een kern van 1 mm (een klein kogellagertje of een bolletje Blu-tac). Loop 5 m (vijf grote stappen) naar de rand van het atoom waar de elektronen zijn. NB: De diagrammen van een atoom met een atoomkern zijn niet op schaal getekend.
Een nauwkeurig beeld versterken door een leerling als atoomkern te laten staan, zijn omtrek te schatten (40 cm?) en te vragen waar een andere leerling zou moeten staan om aan de rand van het atoom te komen. 104 × 40 cm = 4000 m}, dus de straal van dit atoom is 2 km! Zoek met behulp van een plaatselijke kaart een plaats die de leerlingen herkennen en die 2 km ver is.
Verder: in een vaste stof met dicht opeengepakte atomen is de afstand tussen aangrenzende kernen even groot als een atoom, d.w.z. gelijk aan twee leerlingen die 4 km van elkaar staan.
Het is dus verbazingwekkend dat er überhaupt een kern is geraakt. Beiden zijn even groot. De doorsnede van een kern ~straal 2, dus ~1 × 10-28 m2}.
Vraag: Hoe zou je verwachten dat het aantal weerkaatste assen afhangt van de dikte van het metaalfolie dat de doelkernen bevat? (Stel je de gouden atomen in lagen voor, de kans op afbuiging neemt toe met de dikte, maar absorptie op de weg naar binnen of terug uit de steeds dikkere folie zal uiteindelijk een verdere toename van het aantal gereflecteerde en gedetecteerde voorkomen.
Het is van groot nut als uw leerlingen zich de volgende orden van grootte kunnen herinneren:
Radius van atoomkern ~ 10 -14m
Radius van atoom ~ 10 -10m
Studentenvragen: Krachten en nadering
Episode 522-3: Rutherford verstrooiing: Richtingen van krachten (Word, 82 KB)
Episode 522-4: Rutherford verstrooiing: Energie en dichtste nadering (Word, 83 KB)
Discussie: Atoomnummer en de lading van een kern
Rutherford gebruikte zijn gegevens om de lading van de gouddoelkern te vinden. Verdere experimenten om de lading van Cu, Ag en Pt folies te vinden gaven:
| Atoomnummer | Een verstrooiingsexperiment | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
De elektrische lading op een atoomkern wordt dus gegeven door het atoomnummer × e, dus Z e. Op één uitzondering na (waterstof, H-1) is Z altijd kleiner dan het atoomgewichtsgetal. Wat verklaart dan het verschil? Het atoom moet elektrisch neutraal zijn. Rutherford stelde het neutron voor.
Discussie: Bovengrens van de kerngrootte
Bedenk dat Rutherfords analyse een bovengrens geeft van de grootte van de kern (d ~ 1 α deeltjesenergie). De grootte die je meet hangt af van de energie van het α-deeltje dat je gebruikt. We hebben dus een andere benadering nodig om de grootte van een goudkern te vinden. Kun jij een beter deeltje bedenken om de grootte van een atoomkern te bepalen? (Het neutron – dat ongeladen is, komt dichterbij.)
Een andere techniek is de diepe inelastische verstrooiing van elektronen. Verwijs terug als je het golfkarakter van deeltjes al hebt behandeld (de Broglie golven λ = hp), of dit onderwerp kan desgewenst hier worden ingevoegd. Het apparaat voor elektronendiffractie vertoont een fundamentele gelijkenis met een deeltjesverstrooiing. De elektronen worden afgevuurd op een dunne film – in dit geval van grafiet.
Rutherford had het geluk dat de de Broglie-golflengte van de α-deeltjes (bij hem onbekend) vrij klein was, en de coulomb-afstoting stopt als ze te dichtbij komen – anders zouden diffractie-effecten de gegevens in de war hebben gestuurd! (Probeer de berekening als je λ = hp al hebt behandeld.)
Episode 506-2: Interpretatie van elektronendiffractiepatronen (Word, 30 KB)
Episode 522-5: Diepe inelastische verstrooiing (Word, 56 KB)
Episode 522-6: Elektronen meten de grootte van kernen (Word, 42 KB)
Discussie: Een puzzel voor een volgende les
Er is een fundamenteel probleem met Rutherfords model. Vraag uw klas: Hoe kan een atoom met een centrale kern stabiel zijn – waarom stort het niet in? Volgens de klassieke elektrodynamica zouden de elektronen straling moeten uitzenden als ze ronddraaien, en naar binnen spiraliseren.
(Het is goed om een klas te verlaten met een puzzel voor een volgende les.)