Morbillivirussen zijn zeer besmettelijke ziekteverwekkers en zijn verantwoordelijk voor verschillende uitbraken in niet-blootgestelde populaties (Pfeffermann et al., 2018). Ze behoren tot de orde Mononegavirales en familie Paramyxoviridae en worden gekenmerkt door een niet-gesegmenteerd, lineair, negatief-strengs RNA-genoom (Lamb en Parks, 2013). Morbillivirussen onderscheiden zich door het veroorzaken van matige tot ernstige respiratoire, gastro-intestinale, immunosuppressieve en/of neurologische ziekten in een breed scala van gastheren, waaronder mensen (mazelenvirus), carnivoren (canine morbillivirus voorheen canine distempervirus), vee (runderpestvirus), dolfijnen en bruinvissen, en andere in het wild levende bedreigde diersoorten (Lamb en Parks, 2013; Martinez-Gutierrez en Ruiz-Saenz, 2016).
Measlesvirus (MeV) en canine morbillivirus (CDV) worden beschouwd als de meest besmettelijke virussen onder deze familie (De Vries et al., 2015), en vanwege het hoge transmissiepotentieel van CDV, evenals zijn transmissiepotentieel over de soorten heen, zijn de autoriteiten op het gebied van wereldwijde gezondheid en natuurbehoud zeer bezorgd over de rol van CDV op het behoud van bedreigde diersoorten en de mogelijke “sprong” van dier naar mens (Terio en Craft, 2013; Ohishi et al., 2014). Gedomesticeerde honden zijn de belangrijkste gastheer voor CDV en kunnen ook worden beschouwd als een reservoir voor andere zoogdieren (Suzuki et al., 2015; Duque-valencia et al., 2019); op basis van de biologie van CDV zouden mensen echter ook een potentieel doelwit kunnen worden (Cosby en Weir, 2018; Rendon-Marin et al, 2019).
Teneinde het potentiële risico van overdracht van CDV op mensen te begrijpen, is het noodzakelijk om al het bestaande bewijsmateriaal te verzamelen; en de studie van de oorsprong en verspreiding van dit agens in de hondenpopulatie zou een belangrijke sleutel kunnen vormen om dit proces te begrijpen. Een onlangs in het International Journal of Paleopathology gepubliceerd artikel nodigde uit tot een discussie over de evolutionaire oorsprong van CDV. Daarin wordt geconcludeerd dat CDV als een pandemische ziekteverwekker is ontstaan in Zuid-Amerika na de besmetting en aanpassing van MeV aan honden tijdens de Zuid-Amerikaanse kolonisatieperiode. Dit resultaat werd verkregen via een interdisciplinaire aanpak die werd aangenomen door een paleopathologische analyse van 96 precolumbiaanse honden (750-1470 CE) van de Weyanoke Old Town, Virginia site, te synthetiseren met historische rapporten, moleculaire analyse, en morbillivirale epidemiologie (Uhl et al, 2019).
Notably, inheemse hondenpopulaties uit Amerika verdwenen bijna na de kolonisatieperiode, en Europese en Euraziatische honden werden geïntroduceerd op het continent, waardoor er weinig genetische achtergrond van zijn Amerikaanse voorgangers overbleef (Ni Leathlobhair et al., 2018). Een andere belangrijke factor die het overwegen waard is, is dat er ook “onbekende” ziekten geïntroduceerd kunnen zijn, waardoor het moeilijker is om de oorsprong van nieuwe ziekteverwekkers te traceren. Bovendien zou kunstmatige selectiedruk over gedomesticeerde honden en zelfs menselijke populaties, met name tijdens de kolonisatieperiode, de ziekte-incidentie kunnen hebben versterkt, waardoor de genetische variatie werd beperkt (Ostrander et al, 2017), wat op zijn beurt een minder effectieve reactie tegen ziekteverwekkers zou kunnen betekenen.
Onder deze “nieuwe” pathogenen/ziekten, werd CDV voor het eerst beschreven door Antonio de Ulloa y de la Torre-Giral in 1746 als een ziekte die honden in de regio Quito en de andere delen van Zuid-Amerika trof, en het werd kort daarna in Europa gemeld. CDV werd in 1760 in Spanje geregistreerd, met 900 doden op één dag in Madrid, en 3 jaar later, in 1764 en 1770, had de ziekte respectievelijk Groot-Brittannië en Italië bereikt (Blancou, 2004). De overdraagbaarheid van het virus en de grotere vatbaarheid van puppy’s in vergelijking met volwassen honden werden later gerapporteerd door Edward Jenner in het begin van de jaren 1800. Hij vergeleek hun overdraagbaarheid met die van MeV en ontdekte dat overlevenden beschermd waren tegen latere infectie (Jenner, 1809; Nambulli et al., 2016).
Na de komst van Europese pioniers in de vijftiende eeuw werden nieuwe infectieziekten aantoonbaar het meest verwoestende gevolg van kolonisatie, omdat de inheemse Amerikaanse populaties geen voorafgaande blootstelling hadden aan ziekteverwekkers die in Europa algemeen waren geworden (Walker et al., 2015). Meerdere mazelenepidemieën richtten dan ook verwoestingen aan onder de inheemse Amerikaanse populaties (Walker et al., 2015; Nambulli et al., 2016). Uhl et al. rapporteerden via een gemengde benadering van paleopathologisch, historisch, moleculair en epidemiologisch bewijs dat ernstige mazelenepidemieën in de inheemse Amerikaanse populaties de sprong van mazelen naar grote huishondenpopulaties van stedelijke omgevingen in Zuid-Amerika en de aanpassing van het virus als endemisch CDV vergemakkelijkten (Uhl et al., 2019). Ook zouden historische verslagen kunnen aantonen dat enkele jaren na die aanpassing aan Zuid-Amerikaanse honden, CDV in 1760 naar Europa werd getransporteerd, waar het aanvankelijk wijdverspreide epidemieën veroorzaakte met een hoge mortaliteit voordat het endemisch werd (Jenner, 1809).
Hoewel moleculaire fylogeografie gerelateerd aan evolutionaire voorspellingen en de tijd tot de meest recente gemeenschappelijke voorouder (tMRCA) werden berekend voor de oorsprong van CDV in de Verenigde Staten in de jaren 1880 (95% hoogste posterior dichtheid, 1858-1913) (Panzera et al, 2015), wat duidelijk in tegenspraak is met de beschrijving van het virus in Europa in de achttiende eeuw. Sequentieanalyses die tot deze hypothese hebben geleid, moeten zorgvuldig worden onderzocht vanwege de bias en de beperkte beschikbaarheid van sequenties die in deze moleculaire fylogeografiereconstructie werden gebruikt. Bovendien zijn vele oorspronkelijke vooroudersequenties verloren gegaan ten gevolge van de labiliteit van het virale RNA-genoom van het CDV en andere morbillivirussen. Deze factoren hebben aanleiding gegeven tot het in twijfel trekken van de bruikbaarheid van de huidige tMRCA-berekeningen voor RNA-virussen (Sharp en Simmonds, 2011; Nambulli et al., 2016).
Volgens Uhl et al, zou het morbillivirus rond 376 v.Chr. in het “oude continent” van runderen afkomstig kunnen zijn (Figuur 1), en dierlijke domesticatie kan een belangrijke invloed hebben gehad op de gebeurtenissen tussen soorten, waardoor een beginpunt in het ontstaan van MeV waarschijnlijk tot ongeveer 900 AC kan worden herleid (Uhl et al., 2019). In tegenstelling tot de huidige CDV fylogenetische reconstructies, wordt de divergentie van MeV sterk ondersteund door de ontspannen klok Bayesiaanse fylogenetische analyse. Het tijdstip van divergentie tussen MeV en het runderpestvirus was aangetoond in ongeveer de elfde tot twaalfde eeuw (Furuse et al., 2010). Andere moleculaire gegevens, zoals de aanwezigheid van een nieuw morbillivirus (nauw verwant aan CDV en PDV) dat circuleert in vleermuizen uit Brazilië (DrMV), maakt de speculatie mogelijk dat CDV en DrMV een gemeenschappelijke Zuid-Amerikaanse voorouder zouden kunnen delen (Drexler et al., 2012), waardoor indirect het idee van de vroege Zuid-Amerikaanse oorsprong van CDV wordt ondersteund.
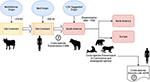
Figuur 1. Schematische weergave van de mogelijke evolutionaire transmissieroute van het canine morbillivirus (CDV). Zie de tekst voor referenties.
Naast de epistemologische en/of wetenschappelijke betekenis van de geografische oorsprong en de datum van CDV-divergentie, zijn er belangrijke aanwijzingen die moeten worden opgehelderd om de huidige impact van CDV’s op de overdracht tussen soorten, de instandhouding van dieren en het zoönotische potentieel beter te begrijpen (figuur 1). Het is duidelijk dat in tegenstelling tot de MeV-infectie, die in stand wordt gehouden door een enkele gastheer (de mens), CDV op grote schaal is bewezen een promiscue ziekteverwekker te zijn die infectie/ziekte veroorzaakt in een breed scala van carnivore en niet-carnivore diersoorten (Martinez-Gutierrez en Ruiz-Saenz, 2016). Deze promiscuïteit wordt niet alleen toegeschreven aan het vermogen van het CDV hemagglutinine (H) om te interageren met gastheercelreceptoren, zoals SLAM in mononucleaire cellen en nectin-4 in epitheelcellen, maar ook aan de gelijkenis tussen de soortsequenties van de hierboven genoemde receptoren (Rendon-Marin et al., 2019). De aminozuurovereenkomst tussen zoogdier SLAM receptoren, met inbegrip van zeezoogdieren, is >80% (Ohishi et al., 2014), waardoor de resultaten van cross-species overdracht worden ondersteund. Bovendien is er een gebrek aan soortgerelateerde variatie in de nectin-4-sequenties tussen mensen, muizen en honden, omdat menselijke nectin-4 zou kunnen functioneren als een in vitro receptor voor CDV (Noyce et al., 2011).
Natuurlijke CDV-uitbraken bij verschillende niet-menselijke primaten hebben bezorgdheid gewekt over de mogelijke overdracht van CDV op mensen (Yoshikawa et al., 1989; Sun et al., 2010; Qiu et al., 2011; Sakai et al., 2013a). Er zijn meldingen dat CDV-apenstammen het intrinsieke vermogen hebben om menselijke nectin-4 te gebruiken voor virusingang en dat die apen-CDV’s zich gemakkelijk aanpassen om de menselijke CD150 (SLAM)-receptor te gebruiken na minimale aminozuurveranderingen aan het virale H-eiwit (Bieringer et al., 2013; Sakai et al., 2013b). Echter, op basis van de in vivo experimentele CDV infectie van Cynomolgus makaken (Macaca fascicularis) in aanwezigheid van MeV immuniteit, waren makaken gedeeltelijk kruislings beschermd tegen de CDV uitdaging (De Vries et al., 2014). Dit suggereert dat, hoewel CDV gemakkelijk primaten kan infecteren, MeV-immuniteit beschermend is en dat CDV-infectie zelflimiterend zou kunnen zijn. Als we dit resultaat overbrengen naar de mens, bestaat er een potentieel risico van CDV-infectie bij mensen die geen kruisbeschermende MeV-immuniteit hebben als gevolg van niet-vaccinatie en vaccinfalen (Haralambieva et al., 2015) of als gevolg van het ontbreken van vaccinatie in het mogelijke post-eradicatietijdperk (Holzmann et al., 2016).
“Opkomende virussen” zouden naar verluidt kunnen ontstaan via de soortsoverschrijdende overdracht van virussen van dieren naar mensen (Wolfe et al., 2007). Nieuwe studies, zowel structureel als bioinformatisch, suggereren dat slechts één aminozuurverandering in een eiwitsequentie voldoende zou kunnen zijn om de beperking in het gebruik van cellulaire receptoren tussen twee verschillende gastheren, zoals mensen en herkauwers, te overwinnen (Abdullah et al., 2018). Een unieke mutatie in het CDV H-eiwit in vitro stelt deze ziekteverwekker in staat cellen te infecteren die de menselijke SLAM-receptor tot expressie brengen (Otsuki et al., 2013). Bovendien, als we de hypothese omarmen dat CDV is geëvolueerd uit MeV, zou het mogelijk kunnen zijn dat een CDV-afstammeling in staat zou zijn om mensen opnieuw te infecteren vanwege de continue evolutie van zowel het virus als de mens, zoals eerder is gesuggereerd in andere modellen, ook al was het voorouderlijke “springervirus” al lang geleden van de aarde verdwenen (Emerman en Malik, 2010).
Verder is een van de meest interessante resultaten gepresenteerd door Uhl et al. de optimalisatie van zowel de CDV- als de MeV-genen aan menselijke codongebruiksbias (CUB), wat suggereert dat CDV codongebruik dichter bij menselijke CUB ligt dan canine CUB omdat het virus of zijn voorloper, meest waarschijnlijk MeV, aanvankelijk werd aangepast aan de mens (Uhl et al, 2019). CUB verwijst naar het fenomeen waarin sommige synonieme codons vaker worden gebruikt dan andere en hoe deze voorkeur varieert binnen en tussen soorten (Behura en Severson, 2013). In RNA-virussen is het codongebruik onderhevig aan selectie omdat de virussen volledig afhankelijk zijn van tRNA’s van de gastheer en de bias het gevolg is van het feit dat virussen het codongebruik van hun gastheer evenaren (Jenkins en Holmes, 2003). Evolutie kan soms virussen bevoordelen die overeenkomen met het codongebruik van hun gastheer om de replicatiesnelheid en aanpassing aan de gastheer te bevorderen, zoals is gerapporteerd bij andere RNA-virussen (Goni et al., 2012; Lauring et al., 2012; Di Paola et al., 2018; Freire et al., 2018).
Ten slotte willen we betogen dat enkele andere factoren moeten worden overwogen in het mogelijke zoönotische scenario van CDV. Kruisneutralisatie tussen MeV en CDV wordt al sinds vele jaren erkend (Brown en Mccarthy, 1974), en deze vooronderstelling bestaat al meer dan een halve eeuw toen het MeV-vaccin werd gebruikt om pups tegen CDV te beschermen op een leeftijd waarop passieve maternale immuniteit vaak interfereerde met CDV-vaccinatie (Baker et al., 1966; Brown et al., 1972). Niettemin wordt het gebruik van een commercieel dubbel CDV/MeV-vaccin nog steeds aanbevolen voor vaccinatie in aanwezigheid van maternale immuniteit, en het vaccin is nuttig gebleken tegen klinische mazelenziekte bij niet-menselijke primaten (Christe et al., 2019). Vandaar dat men kan speculeren dat MeV kudde-immuniteit CDV-sprong en mogelijke readaptatie naar mensen via transmissie door honden of wilde dieren vermijdt.
Conclusieve opmerkingen
De evolutie en oorsprong van virale pathogenen kan niet gemakkelijk worden bestudeerd; hierna is een multidisciplinaire aanpak nodig om nieuwe mogelijke virale bedreigingen voor mensen te begrijpen en misschien te voorspellen. Door hun eigenaardige biologie vormen virale pathogenen zoals CDV een uniek model voor het begrijpen van het overspringen tussen soorten en het zoönotisch potentieel van virale agentia zeer dicht bij de menselijke populatie. Naast de traditionele moleculaire fylogenetische studies en de paleopathologische werken, moeten onderzoekers verschillende benaderingen toepassen om de oorsprong van CDV en de huidige virale en gastheervereisten voor interspecies-springen te bestuderen. De introductie van computationele methoden, zoals structurele bio-informatica en paleovirologiestudies, zou kunnen helpen bij de voorspelling en preventie of op zijn minst een beter begrip kunnen opleveren van deze opkomende, en wellicht zoönotische ziekte vanuit een ander perspectief, waarbij niet alleen sequentiegegevens maar ook structuren en functies als sleutelinformatie voor dit doel worden beschouwd.
Author Contributions
Alle vermelde auteurs hebben een substantiële, directe en intellectuele bijdrage geleverd aan het werk, en hebben het goedgekeurd voor publicatie.
Financiering
Dit werk werd financieel ondersteund door het Departamento Administrativo de Ciencia, Tecnología e Innovación-COLCIENCIAS Grant No. 123171249669 aan JR-S.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Brown, A. L., and Mccarthy, R. E. (1974). Relationship between measles and canine distemper viruses determined by delayed type hypersensitivity reactions in dogs. Nature 248, 344-345. doi: 10.1038/248344a0
PubMed Abstract | CrossRef Full Text | Google Scholar