Leerdoelen
- De eigenschappen van een gas beschrijven.
De drie gangbare fasen (of toestanden) van materie zijn gassen, vloeistoffen, en vaste stoffen. Gassen hebben de laagste dichtheid van de drie, zijn zeer samendrukbaar, en vullen elke houder waarin ze worden geplaatst volledig. Gassen gedragen zich zo omdat hun intermoleculaire krachten relatief zwak zijn, zodat hun moleculen voortdurend bewegen, onafhankelijk van de andere aanwezige moleculen. Vaste stoffen daarentegen zijn relatief dicht, stijf en onsamendrukbaar omdat hun intermoleculaire krachten zo sterk zijn dat de moleculen in wezen op hun plaats zijn opgesloten. Vloeistoffen zijn relatief dicht en onsamendrukbaar, zoals vaste stoffen, maar zij vloeien gemakkelijk om zich aan te passen aan de vorm van hun houder, zoals gassen. We kunnen daarom concluderen dat de som van de intermoleculaire krachten in vloeistoffen tussen die van gassen en vaste stoffen ligt. Figuur 10.1.1 vergelijkt de drie toestanden van materie en illustreert de verschillen op moleculair niveau.
Figuur 10.1.1 Een diatomische stof (O2) in de vaste, vloeibare en gasvormige toestand
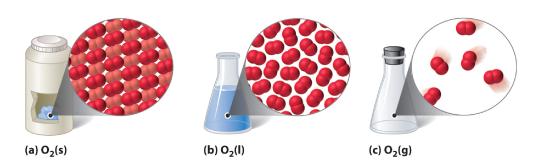
(a) Vaste O2 heeft een vast volume en een vaste vorm, en de moleculen zijn dicht opeengepakt. (b) Vloeibaar O2 volgt de vorm van zijn houder, maar heeft een vast volume; het bevat relatief dicht opeengepakte moleculen. (c) Gasvormig O2 vult zijn houder volledig – ongeacht de grootte of de vorm van de houder – en bestaat uit ver van elkaar verwijderde moleculen.
De toestand van een bepaalde stof hangt sterk af van de omstandigheden. H2O bijvoorbeeld wordt gewoonlijk aangetroffen in alle drie de toestanden: vast ijs, vloeibaar water, en waterdamp (zijn gasvorm). Onder de meeste omstandigheden komen we water tegen als de vloeistof die essentieel is voor het leven; we drinken het, koken ermee, en baden erin. Als de temperatuur koud genoeg is om de vloeistof in ijs om te zetten, kunnen we erop skiën of schaatsen, het in een sneeuwbal of sneeuwkegel verpakken, en er zelfs woningen mee bouwen. WaterdampHet onderscheid tussen een gas en een damp is subtiel: de term damp verwijst naar de gasvorm van een stof die onder normale omstandigheden (25°C, 1,0 atm) een vloeistof of een vaste stof is. Stikstof (N2) en zuurstof (O2) worden dus gassen genoemd, maar gasvormig water in de atmosfeer wordt waterdamp genoemd. is een bestanddeel van de lucht die we inademen, en het wordt geproduceerd telkens we water verhitten om voedsel te koken of koffie of thee te zetten. Waterdamp met een temperatuur van meer dan 100°C wordt stoom genoemd. Stoom wordt gebruikt om grote machines aan te drijven, waaronder turbines die elektriciteit opwekken. De eigenschappen van de drie toestanden van water zijn samengevat in Tabel 10.1.1
De geometrische structuur en de fysische en chemische eigenschappen van atomen, ionen en moleculen hangen gewoonlijk niet af van hun fysische toestand; de individuele watermoleculen in ijs, vloeibaar water en stoom, bijvoorbeeld, zijn allemaal identiek. De macroscopische eigenschappen van een stof hangen daarentegen sterk af van de fysische toestand, die wordt bepaald door intermoleculaire krachten en omstandigheden zoals temperatuur en druk.
Figuur 10.1.2 toont de plaatsen in het periodiek systeem van die elementen die gewoonlijk worden aangetroffen in de gasvormige, vloeibare en vaste toestand. Met uitzondering van waterstof bevinden de elementen die van nature als gas voorkomen zich aan de rechterkant van het periodiek systeem. Daarvan zijn alle edelgassen (groep 18) mono-atomaire gassen, terwijl de andere gasvormige elementen diatomische moleculen zijn (H2, N2, O2, F2, en Cl2). Zuurstof kan ook een tweede allotroop vormen, het zeer reactieve triatomische molecuul ozon (O3), dat ook een gas is. Broom (als Br2) en kwik (Hg) daarentegen zijn vloeistoffen onder normale omstandigheden (25°C en 1,0 atm, gewoonlijk aangeduid als “kamertemperatuur en -druk”). Gallium (Ga), dat smelt bij slechts 29,76°C, kan vloeibaar worden gemaakt door er een vat van in de hand te houden of het op een warme zomerdag in een ruimte zonder airconditioning te bewaren. De rest van de elementen zijn onder normale omstandigheden allemaal vaste stoffen.
Figuur 10.1.2 Elementen die van nature voorkomen als gas, vloeistof en vaste stof bij 25°C en 1 atm
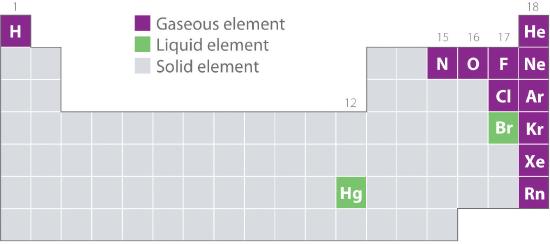
De edelgassen en kwik komen voor als mono-atomaire soorten, terwijl alle andere gassen en broom diatomische moleculen zijn.
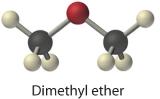
Veel van de elementen en verbindingen die we tot nu toe zijn tegengekomen, worden meestal als gas aangetroffen; enkele van de meest voorkomende staan vermeld in tabel 10.1.2 . Tot de gasvormige stoffen behoren vele binaire hydriden, zoals de waterstofhalogeniden (HX); hydriden van de chalcogenen; hydriden van de groep 15-elementen N, P, en As; hydriden van de groep 14-elementen C, Si, en Ge; en diboraan (B2H6). Bovendien zijn veel van de eenvoudige covalente oxiden van de niet-metalen gassen, zoals CO, CO2, NO, NO2, SO2, SO3, en ClO2. Veel organische verbindingen met een lage molecuulmassa zijn ook gassen, waaronder alle koolwaterstoffen met vier of minder koolstofatomen en eenvoudige moleculen zoals dimethylether , methylchloride (CH3Cl), formaldehyde (CH2O), en aceetaldehyde (CH3CHO). Tenslotte zijn koelmiddelen, zoals de chloorfluorkoolwaterstoffen (CFK’s) en de chloorfluorkoolwaterstoffen (HCFK’s) gassen die gemakkelijk vloeibaar kunnen worden gemaakt door compressie en op hun beurt kunnen de vloeistoffen in gassen worden omgezet door de druk op de vloeistoffen te verlagen. De faseverandering van vloeistof naar gas in buizen binnenin de koelkast koelt af, terwijl de compressie in spoelen onderin of achterin de koelkast de ruimte verwarmt. Ammoniak en SO2 zijn andere samendrukbare gassen die als koelmiddel zijn gebruikt, maar niet in huizen kunnen worden gebruikt vanwege hun giftige aard. Ammoniak wordt nog steeds gebruikt als koelmiddel in grote commerciële omgevingen vanwege zijn efficiëntie en lage kosten.
Alle eerder genoemde gasvormige stoffen (behalve de mono-atomaire edelgassen) bevatten covalente of polaire bindingen en zijn niet-polaire of polaire moleculen. Daarentegen verhinderen de sterke elektrostatische aantrekking in ionische verbindingen, zoals NaBr (kookpunt = 1390°C) of LiF (kookpunt = 1673°C), dat zij bij kamertemperatuur en -druk als gassen bestaan. Bovendien zijn de lichtste leden van een bepaalde familie van verbindingen hoogstwaarschijnlijk gassen, en de kookpunten van polaire verbindingen zijn over het algemeen groter dan die van apolaire verbindingen met een vergelijkbare molecuulmassa. Daarom zijn in een bepaalde reeks van verbindingen de lichtste en minst polaire leden het meest waarschijnlijk gassen. Op relatief weinig uitzonderingen na zijn verbindingen met meer dan ongeveer vijf atomen uit periode 2 of lager echter te zwaar om onder normale omstandigheden als gas te bestaan.
Note the Pattern
Gasvormige stoffen bevatten vaak covalente of polaire covalente bindingen, bestaan als apolaire of licht polaire moleculen, hebben een relatief lage molecuulmassa, en bevatten vijf of minder atomen uit periode 1 of 2.
Gassen kennen een breed scala aan toepassingen, maar een bijzonder grimmig gebruik van een gasvormige stof zou door de Perzen zijn toegepast op de Romeinse stad Dura in het oosten van Syrië in de derde eeuw na Christus. De Perzen groeven een tunnel onder de stadsmuur om de stad binnen te dringen en te veroveren. Archeologisch bewijs suggereert dat toen de Romeinen reageerden met tegen-tunnels om het beleg te stoppen, de Perzen bitumen en zwavelkristallen aanstaken om een dicht, giftig gas te produceren. Het is waarschijnlijk dat blaasbalgen of schoorstenen de giftige dampen verspreidden. De resten van ongeveer 20 Romeinse soldaten werden ontdekt aan de voet van de stadsmuur bij de ingang van een tunnel die minder dan 2 m hoog en 11 m lang was. Omdat het hoogst onwaarschijnlijk is dat de Perzen zoveel Romeinen bij de ingang van zo’n kleine ruimte hebben afgeslacht, speculeren archeologen dat de oude Perzen chemische oorlogsvoering hebben gebruikt om de stad met succes te veroveren.
Voorbeeld 10.1.1
Welke verbindingen zijn volgens u gassen bij kamertemperatuur en -druk?
- cyclohexeen
- lithiumcarbonaat
- cyclobutaan
- vanadium(III)oxide
- benzoëzuur (C6H5CO2H)
Gegeven: verbindingen
Vraag: fysische toestand
Strategie:
A Bepaal van elke verbinding of deze ionisch of covalent is. Een ionische verbinding is hoogstwaarschijnlijk een vaste stof bij kamertemperatuur en -druk, terwijl een covalente verbinding een vaste stof, een vloeistof of een gas kan zijn.
B Van de covalente verbindingen zijn die welke relatief apolair zijn en een lage molecuulmassa hebben, hoogstwaarschijnlijk gassen bij kamertemperatuur en -druk.
Oplossing:
A Lithiumcarbonaat is Li2CO3, dat Li+- en CO32-ionen bevat, en vanadium(III)oxide is V2O3, dat V3+- en O2-ionen bevat. Beide zijn voornamelijk ionische verbindingen waarvan verwacht wordt dat ze vaste stoffen zijn. De overige drie verbindingen zijn alle covalent.
B Benzoëzuur heeft meer dan vier koolstofatomen en is polair, dus het is niet waarschijnlijk dat het een gas is. Zowel cyclohexeen als cyclobutaan zijn in wezen apolaire moleculen, maar cyclobutaan (C4H8) heeft een aanzienlijk lagere molecuulmassa dan cyclohexeen (C6H10), dat weer meer dan vier koolstofatomen heeft. Wij voorspellen daarom dat cyclobutaan hoogstwaarschijnlijk een gas is bij kamertemperatuur en -druk, terwijl cyclohexeen een vloeistof is. Met een kookpunt van slechts 12°C, vergeleken met 83°C voor cyclohexeen, is cyclobutaan inderdaad een gas bij kamertemperatuur en druk.
Oefening
Van welke verbindingen voorspelt u dat ze gassen zijn bij kamertemperatuur en druk?
- n-butanol
- ammoniumfluoride (NH4F)
- ClF
-
ethyleenoxide
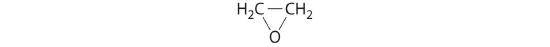
- HClO4
Antwoord: c; d
Samenvatting
Bulkse materie kan in drie toestanden bestaan: gas, vloeistof en vaste stof. Gassen hebben de laagste dichtheid van de drie, zijn zeer samendrukbaar, en vullen hun reservoir volledig. Elementen die bij kamertemperatuur en -druk als gas bestaan, zijn gegroepeerd aan de rechterkant van het periodiek systeem; ze komen voor als mono-atomair gas (de edelgassen) of als diatomische moleculen (sommige halogenen, N2, O2). Veel anorganische en organische verbindingen met vier of minder niet-waterstofatomen zijn ook gassen bij kamertemperatuur en -druk. Alle gasvormige stoffen worden gekenmerkt door zwakke interacties tussen de samenstellende moleculen of atomen.
Key Takeaway
- De moleculen in gasvormige stoffen bevatten vaak covalente of polaire bindingen, zijn niet polaire of licht polaire moleculen, en hebben relatief lage molecuulmassa’s.
Conceptuele problemen
-
Uitleg de verschillen tussen de microscopische en de macroscopische eigenschappen van materie. Is het kookpunt van een verbinding een microscopische of een macroscopische eigenschap? moleculaire massa? Waarom?
-
Bepaal of het smeltpunt, het dipoolmoment, en de elektrische geleiding macroscopische of microscopische eigenschappen van materie zijn en leg je redenering uit.
-
Hoe beïnvloeden de microscopische eigenschappen van materie de macroscopische eigenschappen? Kun je moleculaire massa relateren aan het kookpunt? Waarom wel of waarom niet? Kan polariteit gerelateerd worden aan het kookpunt?
-
Voor een stof die gas-, vloeibare- en vaste fasen heeft, rangschik deze fasen in volgorde van toenemende
- dichtheid.
- sterkte van intermoleculaire interacties.
- comprimeerbaarheid.
- moleculaire beweging.
- orde in de rangschikking van de moleculen of atomen.
-
Leg uit wat er mis is met deze uitspraak: “De toestand van de materie bepaalt grotendeels de moleculaire eigenschappen van een stof.”
-
Beschrijf de belangrijkste factoren die de toestand van een bepaalde verbinding bepalen. Welke externe omstandigheden beïnvloeden of een stof in een van de drie toestanden van de materie bestaat?
-
Welke elementen van het periodiek systeem bestaan als gassen bij kamertemperatuur en -druk? Welke daarvan zijn diatomische moleculen en welke monatomisch? Welke elementen zijn vloeistoffen bij kamertemperatuur en -druk? Welk deel van het periodiek systeem bevat elementen waarvan de binaire hydriden hoogstwaarschijnlijk gassen zijn bij kamertemperatuur?
-
Is de volgende observatie juist? “Bijna alle niet-metaal binaire hydriden zijn gassen bij kamertemperatuur, maar metaalhydriden zijn allemaal vaste stoffen.” Leg uw redenering uit.
-
Is de volgende waarneming juist? “Alle hydriden van de chalcogenen zijn gassen bij kamertemperatuur en -druk, behalve het binaire hydride van zuurstof, dat een vloeistof is.” Leg je redenering uit. Zou je verwachten dat 1-chloorpropaan een gas is? Joodpropaan? Waarom?
-
Leg uit waarom ionische verbindingen onder normale omstandigheden geen gassen zijn.
Antwoorden
-
-
-
-
-
De moleculaire eigenschappen van een stof bepalen zijn toestand van materie onder een gegeven set van omstandigheden, niet andersom. De aanwezigheid van sterke intermoleculaire krachten bevordert een gecondenseerde toestand van de materie (vloeibaar of vast), terwijl zeer zwakke intermoleculaire interactie de gasvormige toestand bevordert. Bovendien dicteert de vorm van de moleculen of een gecondenseerde fase een vloeistof of een vaste stof is.
-
-
Elementen die als gas bestaan, zijn vooral te vinden in de rechterbovenhoek en aan de rechterkant van het periodiek systeem. De volgende elementen bestaan als gas: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, en Rn. De helft van de halogenen, alle edelgassen, en de lichtste chalcogenen en picnogenen zijn dus gassen. Hiervan bestaan alle elementen, behalve de edelgassen, als diatomische moleculen. Slechts twee elementen bestaan als vloeistof bij een normale kamertemperatuur van 20°C-25°C: kwik en broom. Het gedeelte rechtsboven van het periodiek systeem bevat ook de meeste elementen waarvan de binaire hydriden gassen zijn. Bovendien zijn de binaire hydriden van de elementen van de groepen 14-16 gassen.
-
-
-