Hoewel dengue ooit een periodieke ziekte was die epidemieën met lange tussenpozen veroorzaakte, wordt ze vandaag beschouwd als de belangrijkste door muggen overgebrachte virale ziekte ter wereld. Per jaar worden wereldwijd ongeveer vijftig tot honderd miljoen gevallen van dengue koorts geregistreerd. Een half miljoen van deze gevallen leidt tot de ernstigste vorm van dengue koorts (DF), bekend als dengue hemorragische koorts (DHF) . DHF is een ziekte die voornamelijk kinderen onder de 15 jaar treft en wordt gekenmerkt door het plotseling optreden van koorts, trombocytopenie en vasculair leksyndroom . DHF ontstaat als gevolg van een infectie met het denguevirus, dat deel uitmaakt van de familie Flaviviridae . Het virus is een icosaëder, omhuld, enkelstrengs, positief-sens RNA . De kern van de icosaëder is veertig tot vijftig nanometer in diameter en bevat het C-eiwit dat het virale genoom inkapselt. Twee virale eiwitten, M en E, die de lipidenomhulling vormen, omgeven de kern . De infectie wordt veroorzaakt door een van de vier serotypes van het denguevirus (DENV): DENV-1, DENV-2, DENV-3, en DENV-4 . Infectie door een van de serotypes verschaft geen immuniteit tegen infectie met de andere serotypes .
Als iemand die eerder besmet is geweest opnieuw besmet wordt, heeft hij of zij een verhoogd risico op het ontwikkelen van het dengue shock syndroom (DSS) en DHF, wat resulteert in het verzwakken en scheuren van de vasculatuur en inwendige bloedingen . Niet-neutraliserende antilichamen kunnen de opname van het virus door cellen die Fc-receptoren tot expressie brengen, versterken, waardoor antilichaam-afhankelijke versterking in DHF mogelijk wordt . Verschillende soorten Aedes-muggen zijn vectoren voor het denguevirus en brengen het virus over door een menselijke gastheer te bijten . Aedes aegypti; een kleine, zwart-witte, tropische en subtropische mug die voorkomt in Midden-Amerika, Latijns-Amerika, Zuidoost-Azië, en het westelijk deel van de Stille Oceaan, is de belangrijkste vector .
Epidemiologie
Vandaag de dag wordt DHF internationaal beschouwd als de belangrijkste door muggen overgebrachte virale ziekte. Het is endemisch in meer dan 100 landen wereldwijd, vooral tropische en subtropische gebieden. In de Verenigde Staten kan de DHF veroorzakende Aedes aegyptispecies seizoensgebonden worden aangetroffen in Louisiana, het zuiden van Florida, New Mexico, Arizona, Texas, Georgia, Alabama, Mississippi, Noord- en Zuid-Carolina, Kentucky, Oklahoma, en Tennessee . In de laatste 50 jaar is de incidentie van dengue 30-voudig toegenomen .
Volgens de Wereldgezondheidsorganisatie (WHO) komen jaarlijks naar schatting 50 tot 100 miljoen besmettingen met dengue koorts voor. Van deze gevallen ontwikkelen zich er 500.000 tot DHF met 22.000 sterfgevallen, vooral onder kinderen. Volgens de officiële gegevens die bij de WHO zijn ingediend, zijn er in 2008 meer dan 1,2 miljoen en in 2013 meer dan 3 miljoen gevallen van dengue geweest in Noord- en Zuid-Amerika, Zuidoost-Azië en het westelijk deel van de Stille Oceaan. In 2013 werden alleen al in Noord- en Zuid-Amerika 2,35 miljoen gevallen van dengue gemeld, waarvan 37 687 gevallen van DHF . Na de eerste bekende epidemie van DHF in 1953 tot 1954 in de Filippijnen, bleef de ziekte zich verspreiden over Zuidoost-Azië .
Tijdens de jaren 1950, 1960, en het grootste deel van de jaren 1970, was dengue epidemie zeldzaam in het grootste deel van Zuid-en Midden-Amerika, omdat de primaire mug vector, Aedes aegypti, was uitgeroeid. Toen de uitroeiing echter werd gestopt, begon Aedes aegypti deze regio’s opnieuw te veroveren. In 1997 hebben Aedes aegypti en het denguevirus weer een wereldwijde verspreiding gekregen (figuren 1 en 2). Volgens de WHO leven nu meer dan 2,5 miljard mensen in gebieden waar dengue/DHF endemisch is en lopen zij het risico met het denguevirus te worden besmet. Verscheidene factoren dragen bij tot de overdracht van het virus door Aedes aegypti, waaronder temperatuur, regenval, migratie van stad naar platteland, bevolkingsgroei, opgeslagen water, toename van vast afval, waardoor de vector de habitat van larven krijgt. Er kunnen ook uitbraken zijn van reisgeassocieerde DHF. Knokkelkoorts is wereldwijd de meest verspreide arbovirusinfectie .
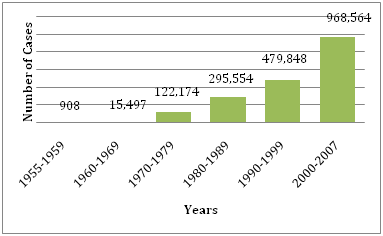
Figuur 1: Gemiddeld aantal DF/DHF gerapporteerd aan de WHO in de gegeven jaren .
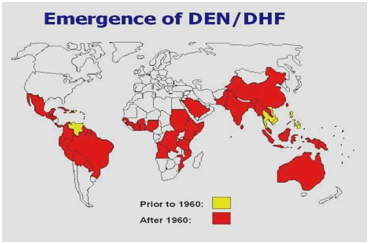
Figuur 2: Verspreiding van dengue/ knokkelkoorts in Amerika, het Caribisch gebied, Afrika en het Midden-Oosten.
Risicofactoren voor DF en overdracht van denguevirus
Dengue koorts is een belangrijke door geleedpotigen overgedragen virale ziekte . Uit onderzoek blijkt dat het geslacht Aedes, voornamelijk Aedes aegypti en Aedes albopictus muggen, zich hebben aangepast aan het leven in de buurt van gebieden met menselijke bewoning en verantwoordelijk zijn voor de overdracht van dengue koorts. De muggen voeden zich overdag en verkiezen de mens boven andere dieren. Aedes aegyptiiheeft met 76,9% het hoogste menselijke bloedvoedingspatroon, gevolgd door Aedes albopictus en Aedes vittatus muggen, met respectievelijk 75% en 33,3% . De incidentie van DF is in verband gebracht met de hoeveelheid vegetatie, boombedekking, kwaliteit van de huisvesting, en het omringende landoppervlak.
Naast door de mens gecreëerde broedplaatsen, is ook aangetoond dat het klimaat van invloed is op de dengue ecologie door invloed uit te oefenen op de dynamiek van de vectoren, de ontwikkeling van de agentia, en de interactie tussen muggen en mensen.13 De temperatuur beïnvloedt de ontwikkelingssnelheid van de vector, de sterfte, het gedrag, en controleert de virale replicatie binnen de vector. In een warm klimaat kunnen de larven zich ontwikkelen en kan het virus zich sneller vermenigvuldigen, terwijl in een koud klimaat de virale ontwikkeling wordt vertraagd en de overlevingstijd van de muggen afneemt, waardoor de kans op een besmettelijke vector afneemt en de overdracht van dengue koorts afneemt. Temperatuur heeft ook een wisselwerking met regenval als de belangrijkste regulator van verdamping, waardoor de beschikbaarheid van waterhabitats direct wordt beïnvloed en indirect de bodembedekking en het landgebruik, die de groei van vectorpopulaties kunnen bevorderen of belemmeren.
Demografische en sociale veranderingen zoals bevolkingsgroei, verstedelijking en modern vervoer dragen in hoge mate bij tot de toename van de incidentie en de geografische verspreiding van dengue-activiteit. Als reizigers zich verplaatsen uit endemische gebieden, hebben ze de neiging om te dienen als voertuigen voor verdere verspreiding . Virale stam virulentie en genetische variatie van het dengue virus lenen zich ook voor een groter epidemisch transmissie potentieel van DHF .
Pathogenese van dengue hemorragische koorts
Als de mug zich voedt met de menselijke gastheer, injecteert hij het dengue virus (DENV) in de bloedbaan en de omringende epidermis en dermis. Dit resulteert in de infectie van onrijpe Langerhanscellen en keratinocyten via receptor-gemedieerde endocytose . E proteïne, het oppervlakte-eiwit, wordt opnieuw geconfigureerd en maakt membraanfusie en het vrijkomen van het viraal RNA in de geïnfecteerde cel mogelijk. De niet-structurele eiwitten NS1 en NS2A controleren de virale RNA-replicatie en NS1 kan ook betrokken zijn bij de activering van de complementcascade. De geïnfecteerde cellen kunnen vervolgens sterven door apoptose of necrose, of migreren naar de lymfeklieren waar macrofagen worden gerekruteerd (figuur 3). Infectie met een van de vier serotypes van dengue (DENV-1 tot DENV-4) kan in de meeste gevallen asymptomatisch zijn omdat het immuunsysteem van de gastheer in staat is de infectie lokaal te neutraliseren, maar kan ook een spectrum van klinische manifestaties veroorzaken, waarvan DHF de ernstigste vorm is, die kan overgaan in DSS en de dood tot gevolg kan hebben. DHF wordt klinisch gedefinieerd als een aanhoudende koorts van 2 tot 7 dagen met hemorragische manifestaties van slijmvlies of huid die gepaard gaan met trombocytopenie (<100.000 cellen/mm3) en een hematocriet van meer dan 20% boven de uitgangswaarde van de patiënt of van dezelfde leeftijdsgroep. De pathologische kenmerken van DHF zijn plasma lekkage van pleurale of peritoneale oppervlakken en intrinsieke coagulopathie, die klinisch wordt gemeten door ofwel een positieve tourniquet test, of door bewijs van spontane bloedingen zoals petechiën of ecchymosen, gingivale bloeding of epistaxis, of gastro-intestinale bloeding .

Figuur 3: Na een beet door de drager Aedes aegypti mug worden onrijpe Langerhanscellen en keratinocyten geïnfecteerd met DENV. De geïnfecteerde cellen verplaatsen zich vervolgens naar de lymfe waar macrofagen worden gerekruteerd. Van hieruit verspreidt de infectie zich naar verschillende organen, waaronder de lever, de milt en het beenmerg. Necrose van het beenmerg door DENV kan leiden tot onderdrukking van hematopoëtische en verminderde trombogenese in het bloed. De ontstekingsreactie, veroorzaakt door het vrijkomen van chemokinen en cytokinen uit mestcellen, macrofagen en lymfocyten, veroorzaakt een verhoogde vasculaire permeabiliteit, disfunctie van de bloedplaatjes, en trombocytopenie en plasma lekkage . Hoewel het mechanisme niet goed wordt begrepen, lijkt deze cascade ook spontane bloedingen te veroorzaken, wat leidt tot de klinische manifestaties van petechiën, gingivale bloedingen en gastro-intestinale bloedingen.
Deze ernstige vorm van de ziekte is vaak het gevolg van een secundaire infectie waarbij de gastheer wordt geïnfecteerd met een tweede serotype en een complexe interactie tussen het virus en de immuunrespons van de gastheer optreedt. Hoewel het mechanisme dat deze reactie veroorzaakt niet goed wordt begrepen, zijn er aanwijzingen dat een eerdere infectie kruisreactieve antilichamen kan creëren die het nieuwe serotype binden, maar niet in staat zijn het te neutraliseren. Dit wordt de antilichaam-afhankelijke versterking (ADE) theorie genoemd. Men denkt dat antilichamen gevormd tijdens eerdere infecties tegen DENV structurele eiwitten, zoals E eiwit of prM, niet in staat zijn om de nieuwe ziekteverwekker te neutraliseren en in plaats daarvan leiden tot een versterkte binding aan Fcγ receptor-positieve cel waardoor de versterkte replicatie van het virus mogelijk wordt . In reactie hierop geeft het immuunsysteem een overdreven cytokinerespons af, wat leidt tot verhoogde vasculaire permeabiliteit en coagulopathie .
Mastcellen zijn ook betrokken bij de pathogenese van DHF. In sommige gevallen lijken mestcellen een beschermende functie te hebben waarbij anti-virale moleculen vrijkomen door de granulatie en andere immuuncellen, zoals T-lymfocyten en natural killer (NK) cellen worden gerekruteerd, die allen helpen het virus te neutraliseren . In andere gevallen kunnen de lokale bestrijdingsmechanismen het virus echter niet in toom houden en verplaatst het zich via de bloedbaan of het lymfestelsel om mestcellen te activeren in andere organen zoals de lever, de milt en de lymfeknopen. Wanneer de granulatie in deze organen optreedt, komen proteasen vrij en worden ontstekingsmediatoren, zoals leukotriënen en vasculaire endotheliale groeifactor (VEGF), gesynthetiseerd, waardoor de permeabiliteit van de haarvaten toeneemt en plasma gaat lekken. Dit is belangrijk omdat verschillende groepen mestcellen tijdens het de-granulatieproces verschillende mediatoren vrijgeven. Het virus-antilichaam complex, wellicht via het NS1 antigeen van het dengue virus, en de productie van cytokines leidt ook tot complement activatie. Het is bekend dat het vrijkomen van C3a- en C5a-fragmenten de vasculaire permeabiliteit verhoogt en zo bijdraagt tot de lekkage van plasma.
Het type en de hoeveelheid vrijkomende cytokinen speelt een belangrijke rol bij het dicteren van de ernst van de ziekte. Macrofaag inflammatoir proteïne 1β (MIP-1β) lijkt een indicator te zijn van minder ernstige ziekte, aangezien het wordt afgegeven door geïnfecteerde mononucleaire cellen en geactiveerde NK-cellen. Het werkt als een chemisch lokmiddel voor meer NK-cellen, die naar de ontstekingsplaats worden gelokt, waardoor de virale replicatie en het daaropvolgende cytokine-effect worden beperkt. Van interferon γ (IFN-γ) is daarentegen aangetoond dat het plasma lekt en de opname van dengue-deeltjes verhoogt door de Fc-receptoren op de doelcellen te verhogen, en het wordt daarom in verband gebracht met ernstiger klinische verschijnselen en een slechte prognose. Andere cytokinen die verhoogd blijken te zijn in DHF en betrokken zijn bij het veroorzaken van plasma lekkage zijn interleukine 2 (IL-2), tumor necrose factor α (TNF- α) macrofaag migratie remmende factor (MIF), monocyte chemo tactic protein-1 (MCP-1), interleukine-8 (IL-8), en high mobility group box-1 (HMGB-1) . Het effect van het vrijkomen van cytokinen is niet beperkt tot vasculaire permeabiliteit en plasma lekkage, maar is ook betrokken bij de hemorragische manifestaties van DHF. Het onderliggende mechanisme dat bloedingen veroorzaakt in DHF is echter slecht begrepen. Hoewel de meeste geïnfecteerde cellen doodgaan door apoptose, treedt er toch enige necrose op, waarbij toxinen vrijkomen die het stollings- en fibrinolyse systeem activeren. Wanneer er veel necrose optreedt in het beenmerg als gevolg van een hoge virale belasting, wordt de hematopoëtische werking onderdrukt, wat resulteert in trombolytischepenie. De resulterende afname van de trombogenese en de disfunctie van de bloedplaatjes kunnen leiden tot capillaire kwetsbaarheid en de daaruit voortvloeiende klinische verschijnselen die bij DHF worden gezien. Sommige studies geven aan dat de betrokkenheid van de lever bij DENV infectie een rol kan spelen bij spontane bloedingsneigingen, met een correlatie tussen verhoogde leverenzym niveaus en verhoogde neiging tot bloeding .
Klinische verschijnselen en symptomen
De klinische manifestatie van de ziekte omvat asymptomatische infectie, milde dengue koorts (DF), dengue hemorragische koorts (DHF), of dengue shock syndroom (DSS), dat vaak ernstig is als gevolg van abnormale capillaire permeabiliteit en plasma lekkage . Ernstige dengue komt meestal voor bij patiënten die al eerder met een dengue-virus besmet zijn geweest (d.w.z. secundaire infectie). Er zijn ook hoge percentages van ernstige dengue-infectie gemeld bij zuigelingen met primaire dengue-virusinfectie die geboren zijn uit moeders die eerder met een dengue-virus zijn geïnfecteerd.
De beginfase van DHF doet zich voor als denguekoorts. De symptomatologie van deze beginfase hangt af van de leeftijd van de patiënt en omvat een plotselinge hoge koorts (soms met twee pieken), ernstige hoofdpijn, verminderde eetlust, ernstige myalgie en gewrichtspijn, een maculopapuleuze huiduitslag die drie tot vier dagen na het begin van de koorts verschijnt, retro-orbitale pijn, fotofobie, lymfadenopathie, milde bloedingen (epistaxis, tandvleesbloedingen, gastro-intestinale bloedingen, hematurie, en menorragie), en een positieve tourniquet test . DHF-gevallen worden gekenmerkt door vier belangrijke klinische verschijnselen: hoge koorts, hemorragische verschijnselen, en vaak ook hepatomegalie en falen van de bloedsomloop. Acute koortsziekte kenmerkend voor de beginfase bestaat uit temperaturen hoger dan 39°C en blijven dat gedurende 2-7 dagen.
De bovengenoemde symptomen van de beginfase verergeren geleidelijk met aanhoudende koorts en hoofdpijn, hevige buikpijn of gevoeligheid, aanhoudend braken, hematemesis, melena, petechiën, gemakkelijk blauwe plekken krijgen, rusteloosheid, lethargie, slaperigheid, prikkelbaarheid, bloedingen of blauwe plekken onder de huid. Na 2-7 dagen koorts gaat een snelle daling van de temperatuur vaak gepaard met tekenen van stoornissen in de bloedsomloop van uiteenlopende ernst. De patiënt kan zweten, rusteloos zijn en koude extremiteiten hebben, en veranderingen in polsslag en bloeddruk vertonen. Na 24-48 uur van het begin van DHF specifieke kenmerken, abnormale hemostase en plasma lekkage worden waargenomen om de kenmerkende symptomen te zijn.
Een goede indicator voor deze verschijnselen is een vergroting van de lever met meer dan 2 cm, aangezien hepatomegalie meestal voorafgaat aan plasma lekkage . Veel patiënten herstellen met of zonder behandeling met vocht en elektrolyten. In ernstige gevallen kan het plasmaverlies, indien onbehandeld, tot shock en de dood leiden. Onderzoek suggereert dat zowel een secundaire infectie van dengue als de overdreven vergelding van de cytokine reactie van het immuunsysteem de predictie voor een patiënt om DHF te ontwikkelen verhogen.
Virale producten zoals NS1 glycoproteïne worden verondersteld de complement activering en de vasculaire permeabiliteit te beïnvloeden wat resulteert in plasma lekkage die zich ontwikkelt tot ascites of pleurale effusies . De cytokinerespons is ook verantwoordelijk voor de vergroting van de vasculaire permeabiliteit, waardoor de intravasculaire oncotische druk wordt verlaagd en het vochtverlies naar de extravasculaire compartimenten wordt vergemakkelijkt (figuur 4). De abnormale hemostase bestaat uit trombocytopenie die gepaard gaat met een verhoging van het hematocriet , verlengde partiële tromboplastinetijd met verlaagde fibrinogeenconcentratie, samen met de eerder genoemde petechiën, ernstige gastro-intestinale bloedingen, ecchymose en epistaxis .
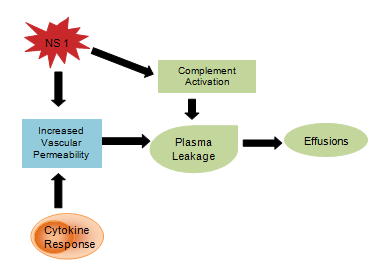
Figuur 4: Cytokine immuunsysteem respons.
Tijdens de febriele viremische fase van DHF, wordt verondersteld dat de trombocytopenie en de daaropvolgende manifestaties optreden als gevolg van beenmerg onderdrukking. Zoals eerder vermeld, is de onderdrukking van het beenmerg een gevolg van het feit dat het een plaats van replicatie voor het virus is, en specifiek hematopoietische progenitorcellen aanvalt. Echter, immuun-gemedieerde vernietiging van de bloedplaatjes werd ook gesuggereerd door de ontdekking van virus-antilichaam complexen gevonden op de bloedplaatjes oppervlakken van DHF patiënten.
Niet vaak voorkomende klinische verschijnselen zijn acute hepatitis, leverfalen, acuut nierfalen, encefalopathie, of cardiomyopathie (acute myocarditis) . In een studie over fatale DHF bij volwassenen werd gekeken naar andere oorzaken van fataliteit dan het Dengue shock syndroom (DSS) bij patiënten met ernstige dengue en werd geconcludeerd dat hypothermie, leukocytose en bandemie tekenen van ernstige dengue kunnen zijn. De studie adviseert verder clinici om zich bewust te zijn van de mogelijke ontwikkeling van massale gastro-intestinale bloedingen, vooral bij patiënten met een vroeg veranderd bewustzijn, diepe trombocytopenie, verlengde PT en/of leukocytose.
Diagnose, behandeling en beheer
Een vroege en nauwkeurige diagnose is van cruciaal belang voor een goede klinische zorg. Er zijn vele methoden waarmee de diagnose van dengue kan worden gesteld. De diagnose kan worden gesteld door isolatie van het virus, het virale nucleïnezuur, antilichamen en antigenen, of een combinatie van al deze technieken. Detectie van denguevirus door middel van kweek is de definitieve diagnostische test, maar praktische overwegingen beperken het gebruik ervan. Detectie van viraal RNA is sneller, maar contaminatie kan leiden tot een vals-positief resultaat. Ook serologische tests kunnen vals-positieve resultaten opleveren als gevolg van kruisreagerende antilichamen.
Acute infecties worden opgespoord in serum, plasma en circulerende bloedcellen tijdens de vroege herstelfase, die de eerste 5-8 dagen na de symptomen duurt. In deze periode kan de primaire virusbelasting oplopen tot 103 RNA-deeltjes/ml of meer dan 106 RNA-deeltjes/ml bij secundaire infecties. Momenteel wordt voor de diagnose vaker gebruik gemaakt van de combinatie van NS1-antigeen- en antistoftests, alsook van moleculaire methoden, zoals real time reverse transcription-polymerase chain reaction (RT-PCR), omdat die sneller resultaten kunnen opleveren en gevoeliger zijn. Immunohistochemische analyse en immunofluorescentie bevestigen ook de aanwezigheid van het virus via virale antigenen. IgM-antilichamen verschijnen het eerst in de eerste 3-5 dagen na infectie .
Ze bereiken een piekniveau 2 weken na het verschijnen van de symptomen en nemen dan over het algemeen af tot ondetecteerbare niveaus na 30-60 dagen. IgG antilichamen, die meer kruisreactief zijn, worden gedetecteerd op lage niveaus na de eerste 7-9 dagen van de symptomen, nemen langzaam toe tot vier keer, en blijven detecteerbaar na verscheidene maanden en mogelijk zelfs levenslang . De menselijke antigeen- en antilichaamrespons is afhankelijk van de immuunstatus van de gastheer en is alleen aanwezig tijdens een primaire of secundaire infectie. Er zijn geen specifieke behandelingen of antivirale geneesmiddelen voor dengue. De pathofysiologie van dengue verhoogt de vasculaire permeabiliteit, wat leidt tot een aanzienlijk verlies van plasma uit het intravasculaire compartiment naar de extra vasculaire ruimte.
Dit vochtverlies kan tot shock leiden en zal zonder de juiste correctie leiden tot hypoxie, metabole acidose en uiteindelijk de dood. Daarom vereist de primaire behandeling ondersteunende zorg in het ziekenhuis met vocht- en elektrolytenbalans. Het gepakte celvolume moet om het uur, om de 4-6 uur, worden gecontroleerd. Significant plasmaverlies wordt gedefinieerd als een >20% toename van het gepakte celvolume of hematocriet. Zodra een patiënt deze niveaus bereikt, is snelle en agressieve volumevervanging noodzakelijk.
De infusievloeistofvervangingssnelheid is afhankelijk van het gepakte celvolume en de urine-output. Er worden meerdere vloeistoffen gebruikt voor vervanging van plasmaverlies, waaronder fysiologische zoutoplossing, Ringer’s lactaat of Ringer’s acetaat, verdunde 5% glucoseoplossing, plasma of plasmasubstituten zoals dextrine 40 en vers volbloed . Naast intraveneuze vloeistofvervanging kunnen elektrolyten oraal worden toegediend om de dorst en de uitdroging als gevolg van de koorts enigszins te verlichten. Ondersteunende pijnstillers zoals acetaminofen kunnen worden gebruikt om koorts en andere symptomen te behandelen. NSAID’s en aspirine moeten worden vermeden omdat zij het syndroom van Reye kunnen versnellen.
Bij herstel van DHF moeten patiënten voor ontslag uit het ziekenhuis aan de volgende criteria voldoen: zichtbare klinische verbetering, afebrile zonder gebruik van antipyretica voor >24 uur, toegenomen eetlust, stabiele hematocriet, adequate urine-output, drie dagen na herstel van ernstige metabole acidose, aantal bloedplaatjes >50.000/mm3, en geen ademnood door pleurale effusie of Ascites .
Preventie en uitroeiing van aedes aegypti
Aedes aegypti, de meest voorkomende vector van het knokkelkoortsvirus, is het belangrijkste doelwit van surveillance- en controleactiviteiten. Andere vectoren, zoals Aedes albopictus, kunnen knokkelkoorts veroorzaken, maar bewakings- en bestrijdingsactiviteiten voor andere vectoren dienen alleen te worden overwogen indien er betrouwbare aanwijzingen zijn dat die vectoren een epidemiologisch significante rol hebben gespeeld bij de overdracht van dengue-infecties . Het eerste initiatief om Aedes aegyptiw uit te roeien werd in 1901 in Cuba genomen. Fumigatie en eliminatie van de muggenhaarden door het vernietigen van verlaten containers waren de eerste stappen om de vector uit te roeien. Na uitbraken van gele koorts in Brazilië in 1928 en 1932 werd het duidelijk dat volledige bescherming van de stedelijke bevolking afhing van de absolute uitroeiing van de Aedes aegyptimug; dit leidde tot de goedkeuring door de Pan-Amerikaanse Gezondheidsorganisatie (PAHO) van het Continentaal Plan voor de uitroeiing van Aedes aegyptierug in 1947 ter bestrijding van gele koorts in de steden . Sinds 1947 heeft het Pan-Amerikaans Sanitair Bureau (PASB) in alle getroffen landen intensieve campagnes gevoerd, en het succes daarvan werd bewezen in 1962, toen 18 landen van het continent en een aantal Caribische eilanden de uitroeiing hadden bereikt. Als resultaat van deze inspanningen is het Amerikaanse DENV-2 genotype V het enige dengue-virus dat vandaag de dag nog bestaat.
Ondanks de inspanningen om de vector uit te roeien, werd Aedes aegypti niet uitgeroeid in Cuba, de Verenigde Staten, Venezuela, en verscheidene Caribische landen . Tientallen jaren van ongekende menselijke inspanningen om Aedes aegyptif uit te roeien vielen zeer snel uiteen en leidden snel tot een infestatie. Gebrek aan toezicht en verslechtering van de structuur van het uitroeiingsprogramma, ontoereikende milieuhygiëne en onvoldoende participatie van de gemeenschap waren enkele van de factoren die hebben geleid tot de achteruitgang van de inspanningen om de vector uit te roeien . Tot op heden is er geen vaccin beschikbaar om dengue-infecties te voorkomen. Takeda Vaccines Inc. ontwikkelt een levend, verzwakt kandidaat-vaccin dat bekend staat als tetravalent dengue-vaccin (TDV) dat bestaat uit een verzwakte DENV-2-stam (TDV-2) en drie chimere virussen die de prM- en E-proteïnegenen van DENV-1, -3 en -4 bevatten die tot expressie zijn gebracht in de context van de verzwakte TDV-2-genoomruggengraat (TDV-1, TDV-3, en TDV-4, respectievelijk). Het vaccin bleek goed te worden verdragen en immunogeen te zijn in een klinische proef van fase 2 in dengue-endemische landen bij volwassenen en kinderen.
Het vaccin bevindt zich in fase 3 van de ontwikkeling. Bovendien heeft Sanofi Pasteur een recombinant, levend gematigd, tetravalent dengue-vaccin (CYD-TDV) ontwikkeld dat consistente veiligheid en werkzaamheid heeft laten zien bij personen van ≥ 9 jaar in endemische landen; het bevindt zich in de late ontwikkelingsfase . Dengvaxia (CYD-TDV) van Sanofi Pasteur werd voor het eerst geregistreerd in Mexico in december 2015 en is geëvalueerd als een serie van 3 doses op een schema van 0/6/12 maanden in klinische fase III-studies . Er zijn ongeveer vijf extra kandidaat-vaccins die in klinische studies worden geëvalueerd . Reizigers naar dengue-endemische gebieden lopen het risico dengue op te lopen; dus voor preventie moeten ze worden aangemoedigd om accommodaties met goed afgeschermde ramen en deuren te kiezen, insectenspray te gebruiken, de juiste kleding te dragen, en al het stilstaande water dat mogelijk muggenbroedplaatsen kan worden, te legen en te bedekken .
De huidige situatie in de wereld
De huidige verwachtingen zijn dat de incidentie van dengue zal blijven stijgen als gevolg van vele factoren, waaronder sociaal-economische status, voortdurende klimaatverandering, reizen, en globalisering. Vaccins zijn nog in ontwikkeling en er bestaat momenteel geen specifieke antivirale therapie om de groeiende dreiging van dengue aan te pakken. De wereldwijde schatting van de incidentie van dengue ligt tussen 50 en 200 miljoen. Het gebruik van cartografische benaderingen suggereert recentelijk echter dat de incidentie dichter bij 400 miljoen ligt. In 2012 heeft de WHO dengue geclassificeerd als een van de belangrijkste door muggen overgebrachte virale ziekten. Deze classificatie is gerechtvaardigd door de aanzienlijke geografische verspreiding van het virus samen met zijn vector naar gebieden die voorheen niet getroffen waren (figuur 5).
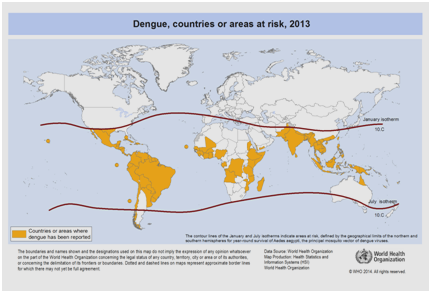
Figuur 5: Landen of gebieden in de wereld waar dengue in 2013 werd gemeld, volgens gegevens verzameld door de Wereldgezondheidsorganisatie .
Het wordt ook ondersteund door de kosten die de ziekte met zich meebrengt. Uit een vergelijking van de last van dengue en andere besmettelijke ziekten in de getroffen regio blijkt dat dengue veel meer menselijk leed veroorzaakt en een grotere belasting vormt dan de andere door vectoren overgebrachte ziekten. Volgens de WHO is dengue de belangrijkste oorzaak van ziekenhuisopname en overlijden bij kinderen in Zuidoost-Azië. Een studie van Hammond et al. meldde dat het merendeel van de morbiditeit en mortaliteit in verband met deze ziekte eerder bij kinderen dan bij andere leeftijdsgroepen voorkomt. Zuigelingen tussen 4-9 maanden en kinderen tussen 5-9 jaar dragen de grootste last van dengue (figuur 6). De ernst van de ziekte bij deze kinderen is vaak te wijten aan secundaire DENV-infectie. Een ecologische studie uitgevoerd door Dıaz-Quijano en Waldman in Latijns Amerika en het Caribisch gebied ontdekte dat de determinanten van het dengue sterftecijfer in deze populaties de lengte van erkende endemiciteit, bevolkingsdichtheid, en regenval omvatten .
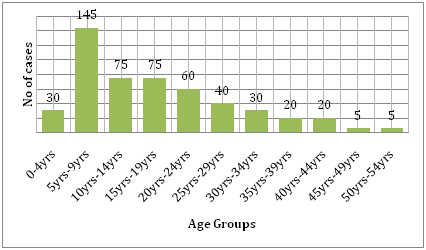
Figuur 6: Leeftijdsverdeling van het studiecohort in León naar leeftijdsgroep .
Naast de impact van morbiditeit en mortaliteit brengt het denguevirus een hoge financiële last met zich mee voor de getroffen regio’s, die vaak slecht toegerust zijn om deze kosten te dragen. In 2010 werd de financiële last van het denguevirus geschat op gemiddeld 2,1 miljard dollar per jaar in Noord- en Zuid-Amerika (in Amerikaanse dollars van 2010), met een marge van 1 tot 4 miljard dollar in gevoeligheidsanalyses en aanzienlijke variatie van jaar tot jaar. Volgens de WHO wordt dengue nu gezien als een wereldwijd probleem, waarbij het Aziatisch-Pacifisch gebied de grootste (75%) wereldbevolking met blootstelling aan het denguevirus herbergt. De westelijke Stille Oceaan heeft ook een voortdurende stijging van het aantal gemelde gevallen van DF in de afgelopen tien jaar ervaren .
Ondanks de afwezigheid van transmissie van DF in het midden van de 20e eeuw, is er nu sprake van een toegenomen endemie van inheems DF in de Amerika’s. Alleen al in Noord- en Zuid-Amerika werden in 2010 meer dan 1,6 miljoen gevallen van dengue gemeld, waarvan 49.000 gevallen ernstige dengue betroffen. In Afrika nemen de uitbraken van DF toe in omvang en frequentie, maar ze worden niet consequent gemeld aan de WHO. Tussen 1960 en 2010 werden sporadische gevallen gemeld door 22 Afrikaanse landen, zoals blijkt uit de beschikbare uitbraakgegevens . In Europa zijn geen epidemieën van DF gemeld sinds een uitbraak in Griekenland in 1928. Thans dreigt een uitbraak in Europa, die wordt toegeschreven aan Aedes albopictus als gevolg van reizen uit landen waar de ziekte endemisch is. Geschat wordt dat de incidentie van de ziekte in de komende jaren zal toenemen als gevolg van multifactoriële risicofactoren.