Kanker is het gevolg van de afbraak van de regels die de cellen reguleren. De oorzaken van de afbraak zijn altijd veranderingen in belangrijke genen. Deze veranderingen zijn vaak het gevolg van mutaties, veranderingen in de DNA-sequentie van chromosomen. Mutaties kunnen zeer kleine veranderingen zijn, die slechts enkele nucleotiden betreffen, of zij kunnen zeer groot zijn en leiden tot grote veranderingen in de structuur van chromosomen.
Zowel kleine als grote mutaties kunnen het gedrag van cellen beïnvloeden. Combinaties van mutaties in belangrijke genen kunnen leiden tot de ontwikkeling van kanker. Het materiaal op deze bladzijde beschrijft het verband tussen mutatie en kanker, de verschillende soorten mutaties en de oorzaken ervan. Meer informatie over de onderwerpen op deze pagina is ook te vinden in de meeste inleidende leerboeken Biologie, wij bevelen Campbell Biology, 11th edition aan.1
Onderwerpen op deze pagina:
- Mutatie en kanker
- Erfelijke mutaties en kanker
- Soorten mutatie
- Puntmutaties
- Translocaties
- Genamplificatie
- Inversies, Deleties, en Duplicaties
- Aneuploïdie
- Epigenetische Veranderingen
- Oorzaken van Mutatie
- Mutatie Samenvatting
- Ken de Flow: Mutatie
Mutatie en kanker
De abnormale gedragingen van kankercellen zijn het resultaat van een reeks mutaties in belangrijke regulerende genen. De cellen worden steeds abnormaler naarmate meer genen beschadigd raken. Vaak worden de genen die het herstel van het DNA regelen zelf beschadigd, waardoor de cellen nog vatbaarder worden voor steeds grotere genetische chaos.
Hieronder ziet u een animatie die de relatie tussen chromosomen, genen en DNA laat zien.
Van de meeste kankersoorten wordt gedacht dat ze ontstaan uit een enkele mutante voorlopercel. Als die cel zich deelt, kunnen de resulterende ‘dochtercellen’ in de loop van de tijd verschillende mutaties en verschillende gedragingen krijgen. De cellen die een voordeel hebben bij deling of weerstand tegen celdood zullen de neiging hebben de populatie over te nemen. Op deze wijze kunnen de tumorcellen een breed scala van mogelijkheden verwerven die normaal niet voorkomen in de gezonde versie van het vertegenwoordigde celtype. De gedragsveranderingen die bij kankercellen worden waargenomen, vormen de kern van het onderdeel Kankerbiologie van deze site.
Mutaties in belangrijke regulerende genen (tumorsuppressors en proto-oncogenen) veranderen het gedrag van cellen en kunnen mogelijk leiden tot de ongereguleerde groei die bij kanker wordt waargenomen.
Voor bijna alle soorten kanker die tot op heden zijn bestudeerd, lijkt het alsof de overgang van een normale, gezonde cel naar een kankercel een stapsgewijze progressie is die veel genetische veranderingen vereist die bij elkaar optellen om de kankercel te creëren. Deze mutaties komen zowel bij oncogenen als bij tumorsuppressoren voor. Dit is een van de redenen waarom kanker veel vaker voorkomt bij oudere mensen. Om een kankercel te doen ontstaan, moet een reeks mutaties in dezelfde cel optreden. Aangezien de waarschijnlijkheid dat een gen gemuteerd raakt zeer gering is, is het logisch dat de kans dat verschillende mutaties in dezelfde cel optreden zeer onwaarschijnlijk is. Om deze reden hebben de cellen in een 70 jaar oud lichaam meer tijd gehad om de veranderingen te accumuleren die nodig zijn om kankercellen te vormen, maar hebben de cellen in een kind veel minder kans om de vereiste genetische veranderingen te hebben verworven. Natuurlijk krijgen sommige kinderen kanker, maar het komt veel vaker voor bij oudere mensen. De onderstaande grafiek toont het aantal gevallen van darmkanker in de Verenigde Staten als functie van de leeftijd. De grafiek is afkomstig van het National Cancer Institute. 2
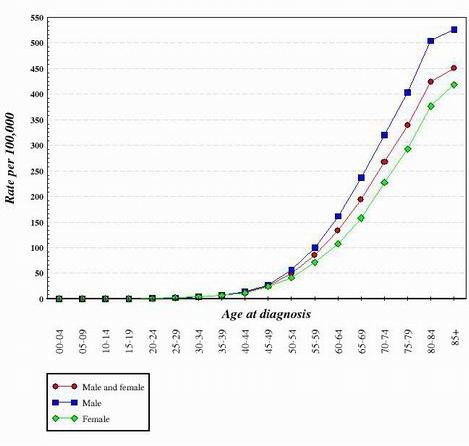
Aan de hand van de vorm van curven als hierboven is geconcludeerd dat er verschillende genetische veranderingen nodig zijn om cellen te creëren die kanker worden.
In het laboratorium hebben onderzoekers getracht tumorcellen te creëren door belangrijke regulerende eiwitten te veranderen of in te brengen. Verschillende studies hebben geprobeerd het minimale aantal genetische veranderingen te bepalen dat nodig is om een kankercel te creëren, met intrigerende resultaten.3
In de natuur kunnen mutaties zich in de loop van de tijd in cellen opstapelen en als de ‘juiste’ groep genen wordt gemuteerd, kan kanker het gevolg zijn. Een studie uit 2012 toonde aan dat beenmergstamcellen in een gezond individu veel mutaties accumuleren naarmate de persoon ouder wordt. Nog maar een paar veranderingen in belangrijke genen kunnen kanker veroorzaken. De resultaten impliceren dat ‘normale’ cellen en kankercellen in veel gevallen misschien niet zo verschillend zijn.4
Erfde mutaties in kanker
Om het nog ingewikkelder te maken, is het duidelijk dat de veranderingen die nodig zijn om een kankercel te creëren op veel verschillende manieren kunnen worden bereikt. Hoewel alle kankers hetzelfde spectrum van regulerende functies moeten overwinnen om te groeien en zich te ontwikkelen, kunnen de betrokken genen verschillen. Bovendien kan ook de volgorde waarin de genen worden ontregeld of verloren gaan, verschillen. Zo kunnen bij darmkankertumoren van twee verschillende personen zeer verschillende sets van tumorsuppressoren en oncogenen betrokken zijn, ook al is het resultaat (kanker) hetzelfde.
De grote heterogeniteit die bij kanker wordt waargenomen, zelfs bij kanker van hetzelfde orgaan, betekent dat diagnose en behandeling gecompliceerd zijn. De huidige vooruitgang op het gebied van de moleculaire classificatie van tumoren moet het mogelijk maken rationele behandelingsprotocollen op te stellen op basis van de genen die in een bepaald geval daadwerkelijk een rol spelen. Nieuwe diagnostische tests kunnen het screenen van honderden of duizenden genen inhouden om een persoonlijk profiel van de tumor in een individu te creëren. Deze informatie moet het mogelijk maken kankerbehandelingen op het individu af te stemmen. Zie voor meer informatie hierover het hoofdstuk Genomics/Proteomics.
De genetische veranderingen die tot ongereguleerde celgroei leiden, kunnen op twee verschillende manieren worden verworven. Het is mogelijk dat de mutatie geleidelijk in de loop van een aantal jaren optreedt, wat leidt tot de ontwikkeling van een ‘sporadisch’ geval van kanker. Anderzijds is het mogelijk disfunctionele genen te erven die leiden tot de ontwikkeling van een familiaire vorm van een bepaald type kanker. Enkele voorbeelden van kankers waarvan bekend is dat zij erfelijk zijn, zijn:
- Borstkanker- Overerving van gemuteerde versies van de BRCA1- en BRCA2-genen zijn bekende risicofactoren. Hoewel veel, zo niet de meeste, personen met borstkanker geen aantoonbare veranderingen in deze genen hebben, verhoogt het hebben van een gemuteerde vorm de kans op het ontwikkelen van borstkanker.
- Darmkanker- Defecten in DNA-herstelgenen zoals MSH2 zijn bekend als voorbeschiktheid voor erfelijke niet-polyposiserende colorectale kanker (HNPCC).
- Retinoblastoom- Defecten in het Rb tumoronderdrukkingsgen zijn bekend als veroorzakers van deze oogkanker en verschillende andere soorten kanker. Meer over deze specifieke ziekte is te vinden in het hoofdstuk over Rb
Dit is een onvolledige lijst van de bekende erfelijke kankersoorten, en het is zeker dat meer erfelijke vormen van kanker zullen worden geïdentificeerd naarmate de genetica van verschillende kankersoorten wordt opgehelderd.
Meer informatie over dit onderwerp is te vinden in de hoofdstukken 2 en 4 van The Biology of Cancer van Robert A. Weinberg.
Typen mutatie
Het proces waarbij eiwitten worden gemaakt, de translatie, is gebaseerd op het ‘lezen’ van mRNA dat via het proces van transcriptie is geproduceerd. Elke verandering in het DNA dat codeert voor een gen, zal leiden tot een wijziging van het geproduceerde mRNA. Het veranderde mRNA kan op zijn beurt leiden tot de productie van een eiwit dat niet langer naar behoren functioneert. Zelfs het veranderen van een enkele nucleotide in het DNA van een gen kan leiden tot een volledig niet-functioneel eiwit.
Er zijn verschillende manieren waarop DNA kan worden veranderd. Het volgende hoofdstuk beschrijft de verschillende soorten genetische veranderingen in meer detail.
Puntmutaties
Genetische veranderingen kunnen in twee algemene categorieën worden ingedeeld. De eerste categorie bestaat uit veranderingen die slechts één of enkele nucleotiden van een DNA-streng veranderen. Dit soort veranderingen wordt puntmutaties genoemd.
Wanneer ribosomen een boodschapper-RNA-molecuul lezen, wordt elke drie nucleotiden geïnterpreteerd als één aminozuur. Deze codes van drie letters worden codons genoemd. Om een analogie te maken met een Engelse zin: ‘De dikke kat at de rat op’ zou 6 codons bevatten. De veranderingen door mutatie kunnen leiden tot dingen als ‘De dikke vleermuis at de rat.’ of ‘De fa’ of ‘De dikke oca tat her at…’ Het effect op het eiwit hangt af van waar de verandering optreedt en het soort verandering.
De drieletterige codons die door ribosomen worden gelezen, kunnen door mutatie op een van de volgende drie manieren worden veranderd:
Nonsense-mutaties
Het nieuwe codon zorgt ervoor dat het eiwit voortijdig wordt beëindigd, waardoor een eiwit ontstaat dat verkort is en vaak niet goed of helemaal niet functioneert.
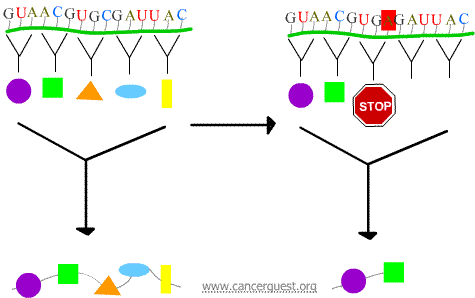
Missense mutaties
Het nieuwe codon veroorzaakt dat een onjuist aminozuur in het eiwit wordt ingevoegd. De gevolgen voor de functie van het eiwit hangen af van wat er in plaats van het normale aminozuur wordt ingevoegd.

Frameshift-mutaties
Het verlies of de toename van 1 of 2 nucleotiden leidt ertoe dat het aangetaste codon en alle codons die erop volgen verkeerd worden gelezen. Dit leidt tot een heel ander en vaak niet-functioneel eiwitproduct.
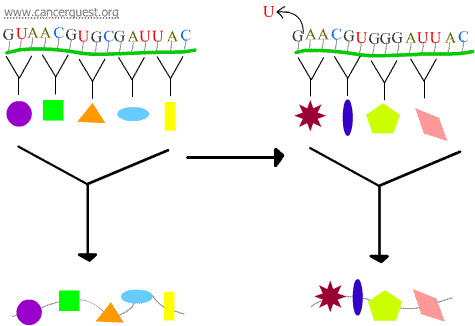
Transcriptiefouten
Sommige DNA-beschadigingen leiden tot een gemodificeerde nucleotide of kleine groep nucleotiden die niet door RNA-polymerase kunnen worden ‘gelezen’. Wanneer het RNA polymerase complex deze plekken bereikt, zal het soms de schade omzeilen door nucleotiden toe te voegen in een poging om door te gaan, zelfs als dit betekent dat er iets verkeerds in moet. Dit proces staat bekend als transcriptionele mutagenese en kan een belangrijke rol spelen bij de ontwikkeling van kanker.5
Translocaties
Een andere categorie mutaties betreft veranderingen van grotere hoeveelheden DNA, vaak op het niveau van het chromosoom. Deze worden translocaties genoemd en omvatten de breuk en verplaatsing van chromosoomfragmenten. Vaak maken breuken in twee verschillende chromosomen de vorming van twee ‘nieuwe’ chromosomen mogelijk, met nieuwe combinaties van genen.
Hoewel het misschien lijkt dat dit niet veel problemen zou opleveren, omdat alle genen nog aanwezig zijn, kan het proces op een aantal manieren tot een ontregelde celgroei leiden-
1. De genen kunnen op hun nieuwe plaats niet juist getranscribeerd en vertaald worden.
2. De verplaatsing van een gen kan leiden tot een verhoging of een verlaging van zijn niveau van transcriptie.
3. De breuk en het opnieuw samenvoegen kan ook binnen een gen gebeuren (zoals in groen hierboven getoond), wat leidt tot zijn inactivering.
Voor sommige kankers komen bepaalde translocaties zeer vaak voor en kunnen zelfs gebruikt worden bij het diagnosticeren van de ziekte. Translocaties komen vaak voor bij leukemieën en lymfomen en zijn minder vaak geïdentificeerd bij kankers van vaste weefsels. Een voorbeeld hiervan is een uitwisseling tussen de chromosomen 9 en 22 die bij meer dan 90% van de patiënten met chronische myeloïde leukemie (CML) wordt gezien. De verwisseling leidt tot de vorming van een verkorte vorm van chromosoom 22 die het Philadelphia-chromosoom wordt genoemd (naar de plaats waar het is ontdekt). Deze translocatie leidt tot de vorming van een oncogen uit het abl proto-oncogen.67
Andere kankersoorten die vaak (of altijd) met bepaalde translocaties worden geassocieerd, zijn onder meer Burkitts lymfoom, B-cel lymfomen en verschillende soorten leukemie.
Genamplificatie
In dit zeer ongebruikelijke proces wordt het normale DNA-replicatieproces ernstig verstoord. Het resultaat is dat in plaats van het maken van een enkele kopie van een regio van een chromosoom, vele kopieën worden geproduceerd. Dit leidt tot de productie van vele kopieën van de genen die zich op die regio van het chromosoom bevinden. Soms worden zoveel kopieën van de geamplificeerde regio gemaakt dat ze hun eigen kleine pseudochromosomen vormen, de zogenaamde dubbelminuutchromosomen.
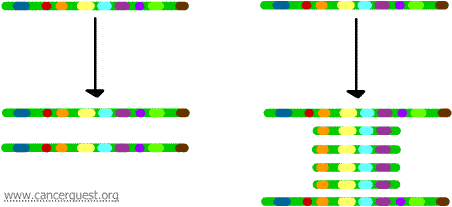
De genen op elk van de kopieën kunnen worden getranscribeerd en vertaald, wat leidt tot een overproductie van het mRNA en het eiwit dat correspondeert met de geamplificeerde genen, zoals hieronder te zien is. De kronkelende lijnen stellen voor dat mRNA wordt geproduceerd via de transcriptie van elke kopie van het gen.
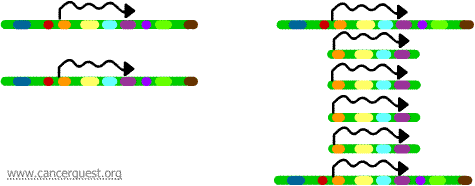
Terwijl dit proces niet in normale cellen wordt waargenomen, komt het vrij vaak voor in kankercellen. Als een oncogen in de geamplificeerde regio is opgenomen, kan de resulterende overexpressie van dat gen leiden tot een gestoorde celgroei. Voorbeelden hiervan zijn de amplificatie van het myc-oncogen in een groot aantal tumoren en de amplificatie van het ErbB-2- of HER-2/neu-oncogen in borst- en eierstokkanker. In het geval van het HER-2/neu-oncogen zijn klinische behandelingen ontworpen om cellen aan te pakken die het eiwitproduct overexpresseren.
Genamplificatie draagt ook bij tot een van de grootste problemen bij de behandeling van kanker: resistentie tegen geneesmiddelen. Drugresistente tumoren kunnen blijven groeien en zich verspreiden, zelfs in aanwezigheid van chemotherapiemiddelen. Een gen dat hierbij vaak betrokken is, heet MDR voor meervoudige geneesmiddelenresistentie. Het eiwitproduct van dit gen werkt als een pomp die zich in het celmembraan bevindt. Het is in staat selectief moleculen uit de cel te verwijderen, waaronder chemotherapiemedicijnen. Deze verwijdering maakt de geneesmiddelen onwerkzaam.
Dit wordt meer in detail besproken in het hoofdstuk over resistentie tegen geneesmiddelen. De amplificatie van verschillende genen kan andere chemotherapiemiddelen onwerkzaam maken.
Inversies, verdubbelingen en deleties
Inversies
Bij deze veranderingen worden DNA-segmenten van een chromosoom losgemaakt en vervolgens in de tegenovergestelde richting opnieuw ingebracht. Net als in de vorige voorbeelden kan deze herschikking leiden tot abnormale genexpressie, hetzij door het activeren van een oncogen of het deactiveren van een tumoronderdrukkend gen.
Duplicaties/Deleties
Door replicatiefouten kan een gen of een groep van genen meer dan één keer gekopieerd worden binnen een chromosoom. Dit verschilt van genamplificatie in die zin dat de genen niet buiten het chromosoom worden gerepliceerd en dat ze slechts één keer extra worden gekopieerd, niet honderden of duizenden keren. Genen kunnen ook verloren gaan door mislukking van het replicatieproces of andere genetische schade.

Aneuploïdie
Aneuploïdie is de genetische verandering die het verlies of de aanwinst van volledige chromosomen inhoudt. Door problemen in het celdelingsproces is het mogelijk dat de gerepliceerde chromosomen zich niet nauwkeurig in de dochtercellen scheiden. Dit kan resulteren in cellen die te veel chromosomen of te weinig chromosomen hebben. Een voorbeeld van een vrij veel voorkomende aneuploïde aandoening die geen verband houdt met kanker is het syndroom van Down, waarbij er een extra kopie van chromosoom 21 is in alle cellen van de getroffen persoon.
In de animatie hieronder worden kopieën van twee chromosomen gemaakt, maar wanneer de cel zich deelt, worden de chromosomen niet gelijkmatig verdeeld over de twee cellen die worden gevormd (dochtercellen). Het resultaat is dat één van de cellen te veel chromosomen heeft en één niet genoeg.
Kankercellen zijn heel vaak aneuploïd. Mensen hebben normaal 46 chromosomen in hun cellen, maar kankercellen hebben er vaak veel meer, soms meer dan 100. De aanwezigheid van de extra chromosomen maakt de cellen onstabiel en verstoort in ernstige mate de controle op de celdeling. Er is momenteel een debat gaande over de vraag of alle kankers aneuploïd zijn of niet. Ongeacht of dat het geval is, is het duidelijk dat aneuploïdie een gemeenschappelijk kenmerk van kankercellen is.
Epigenetische veranderingen
Naast feitelijke veranderingen in de DNA-sequentie kan de genexpressie worden veranderd door veranderingen in het DNA en het chromatine die de sequentie niet veranderen. Aangezien deze veranderingen de volgorde van het DNA in de genen niet veranderen, worden ze epigenetische veranderingen genoemd. Twee soorten epigenetische veranderingen worden hieronder beschreven.
Methylering
Bij deze verandering worden sommige nucleotiden in het DNA gewijzigd door de toevoeging van een methylgroep (-CH3) aan de base. Methylering van DNA wordt geassocieerd met de inactivering van dat specifieke gebied van DNA. Abnormale DNA-methyleringspatronen zijn waargenomen in kankercellen. Net als de beschreven veranderingen verandert methylering de expressie van de aangetaste genen.
Acetylering
Bij deze epigenetische verandering worden de histon-eiwitten waaromheen het DNA is gewonden, gewijzigd door de toevoeging van acetylgroepen (-CH3CHO). Deze wijziging leidt tot een versoepeling van de DNA:histon interactie en wordt in verband gebracht met een verhoogde genexpressie. De wijziging van de processen van toevoeging en verwijdering van acetylgroepen aan DNA is een actief gebied van onderzoek naar de behandeling van kanker.
Meer over epigenetische veranderingen en kankerbehandelingen.
Oorzaken van mutatie
Zoals we hebben gezien, ontstaan kankercellen uit normale voorlopercellen door een opeenstapeling van genetische schade. De mechanismen waardoor de veranderingen worden geïnduceerd zijn uiteenlopend. In ruime zin vallen de agentia van genetische verandering (mutatie) hoofdzakelijk in de hieronder beschreven categorieën, die in het volgende hoofdstuk uitvoerig worden besproken.
Spontane mutaties
Spontane mutaties: De basen (A, T, G, C) in het DNA worden veranderd of gaan verloren als gevolg van replicatiefouten die niet worden gerepareerd of willekeurige moleculaire gebeurtenissen. Bijvoorbeeld, het verlies van een aminogroep van cytosine, een normale base in DNA, leidt tot de productie van uracil, een base die normaal niet in DNA voorkomt. Als deze verandering niet wordt ontdekt en teruggedraaid, kan een mutatie ontstaan. Soms kan een hele base verloren gaan als gevolg van de splitsing van de binding tussen de DNA-backbone en de base. Dit leidt tot een gat in de DNA-dubbele-helix, dat, als het niet wordt gerepareerd, kan leiden tot een mutatie de volgende keer dat het DNA wordt gekopieerd (d.w.z. tijdens replicatie).
Geïnduceerde mutaties
Geïnduceerde mutaties: Mutaties kunnen worden geïnduceerd door organismen (of cellen) bloot te stellen aan een verscheidenheid van behandelingen. Enkele van de meest voorkomende zijn:
Straling- Een van de eerste bekende mutagenen, straling is een krachtige inducer van mutaties. Verschillende soorten straling veroorzaken verschillende soorten genetische veranderingen. Ultraviolette (UV) straling veroorzaakt puntmutaties. Röntgenstralen kunnen breuken in de dubbele DNA-helix veroorzaken en leiden tot translocaties, omkeringen en andere vormen van chromosoombeschadiging. Blootstelling aan de UV-stralen in zonlicht is in verband gebracht met huidkanker. Merk op dat de DNA-beschadigende eigenschappen van straling zijn gebruikt in verschillende op straling gebaseerde kankerbehandelingen.
Hieronder ziet u een type mutatie dat wordt veroorzaakt door ultraviolette straling. In dit voorbeeld zorgt het bombardement van de dubbele DNA-helix door UV-stralen ervoor dat twee basen zich met elkaar verbinden. Dit verandert de structuur van het DNA en kan leiden tot blijvende veranderingen indien deze niet worden hersteld.
Een ander type straling is de energie die wordt uitgezonden door in de natuur voorkomende radioactieve elementen (zoals radon en uranium) of door de mens gemaakte bronnen zoals die welke worden aangetroffen (en gecreëerd) in kernreactoren. Straling van dit type is er in verschillende soorten en kan verschillende soorten schade aan cellen en weefsels veroorzaken. Straling kan het DNA rechtstreeks beschadigen of de vorming van chemische stoffen (d.w.z. reactieve zuurstofsoorten of ROS) veroorzaken die vervolgens het DNA of andere celbestanddelen kunnen beschadigen.
Blootstelling aan straling van radioactieve materialen is goed gedocumenteerd. Analyses van overlevenden van de atoombommen die tijdens de Tweede Wereldoorlog op Japan zijn afgeworpen, lieten een grote toename zien van leukemieën kort na de blootstelling en vervolgens een toename van andere soorten kanker in de daaropvolgende decennia.8
Van kerncentrales zijn ook per ongeluk gevaarlijke hoeveelheden radioactief materiaal vrijgekomen. Stralingsblootstelling als gevolg van het per ongeluk vrijkomen van radioactieve stoffen uit de kernreactor van Tsjernobyl is in verband gebracht met een toename van schildklierkanker en andere kwaadaardige kankersoorten.9
Medische beeldvormingsmachines (zoals röntgenapparaten en CT-scanners) stellen patiënten ook bloot aan straling. De hoeveelheden die voor een enkele test worden gebruikt, worden niet geacht significante hoeveelheden kanker te veroorzaken, maar het langetermijneffect van vele tests over een periode van jaren is niet duidelijk.10 Ook de blootstelling van vliegtuigpassagiers aan full-body scans op luchthavens wordt niet geacht een risico op kanker op te leveren.11 Vliegtuigpassagiers worden ook blootgesteld aan straling uit de ruimte, maar op een laag niveau en er wordt niet verondersteld dat dit een kankerrisico inhoudt, zelfs niet voor bemanningsleden.1112
Chemische mutagenen- Van veel verschillende chemische stoffen is bekend dat zij mutaties veroorzaken. Deze chemicaliën oefenen hun effect uit door zich te binden aan DNA of de bouwstenen van DNA en interfereren met de replicatie- of transcriptieprocessen. Enkele voorbeelden van krachtige mutagenen zijn benzo-a-pyreen, een chemische stof die wordt aangetroffen in sigarettenrook, en aflatoxine, een mutageen dat het vaakst wordt aangetroffen in verkeerd opgeslagen landbouwproducten.
Chronische ontsteking- Chronische ontsteking kan leiden tot DNA-beschadiging als gevolg van de productie van mutagene chemische stoffen door de cellen van het immuunsysteem. Een voorbeeld hiervan is de langdurige ontsteking die wordt veroorzaakt door infectie met het hepatitisvirus. Leer meer over virussen en kanker.
Zuurstofradicalen- Tijdens het vastleggen van energie uit voedsel, wat in onze mitochondriën gebeurt, kunnen chemicaliën ontstaan die zeer reactief zijn en in staat zijn celmembranen en het DNA zelf te beschadigen. Deze reactieve zuurstof intermediairs (ROI) kunnen ook worden gegenereerd door blootstelling van cellen aan straling, zoals hieronder getoond.
De mutagene activiteit van ROI wordt in verband gebracht met de ontwikkeling van kanker, alsmede met de werking van verschillende kankerbehandelingen, waaronder bestraling en chemotherapie. 131415
Normale celdeling
Tijdens mitose is het mogelijk dat het celdelingsproces er niet in slaagt de gerepliceerde chromosomen nauwkeurig te verdelen over twee dochtercellen. Een dergelijke fout leidt tot de productie van aneuploïde cellen. De cellen zullen ofwel een aanzienlijk aantal genen missen, ofwel hebben gewonnen. Dit zeldzame proces kan cellen doen ontstaan die vatbaarder zijn voor ongeregelde celdeling. Zoals eerder gezegd, is een groot percentage van de bij de mens geïsoleerde kankers aneuploïd.
Als een cel een mutatie heeft in een gen waarvan het eiwitproduct verantwoordelijk is voor de “controle” van het delingsproces, kan de zaak snel uit de hand lopen en kunnen de dochtercellen van elke deling steeds abnormaler worden.
Virussen als mutagenen
Virussen worden verantwoordelijk geacht voor een aanzienlijk percentage van de kankergevallen. Virussen kunnen op verschillende manieren kanker veroorzaken en de manier waarop elk type virus werkt, is waarschijnlijk enigszins verschillend. Sommige virussen (waaronder veel retrovirussen) kunnen mutaties veroorzaken door hun genen in het genoom van de geïnfecteerde cel in te brengen. Het ingebrachte DNA kan de activiteit van aangetaste genen vernietigen of veranderen.161718
Virussen kunnen ook op indirecte manieren mutaties veroorzaken. Als voorbeeld: Een infectie met het hepatitisvirus kan vele jaren duren. Gedurende die tijd probeert het afweersysteem van het lichaam zich van het virus te ontdoen door giftige chemicaliën te produceren. Deze chemicaliën kunnen schade toebrengen aan verder gezonde cellen, waardoor deze de weg inslaan die tot kanker leidt. Er zijn talloze andere manieren waarop virussen kanker kunnen veroorzaken.1920
Omdat virussen zo’n belangrijke rol spelen bij de ontwikkeling van veel vormen van kanker, hebben we een sectie aan virussen en kanker gewijd.
Transposons als mutagenen
Transposons zijn korte DNA-sequenties die het vermogen hebben om van de ene plaats in het DNA naar een andere plaats te gaan. Transposons coderen voor een enzym, transposase, dat het transposon op nieuwe plaatsen in een genoom splitst (zie schema, linksonder, van een transposon) Transposons werden ontdekt door Barbara McClintock en zij won een Nobelprijs voor haar werk.2122 Het menselijk genoom bevat veel geïnactiveerde kopieën van transposons die hun vermogen hebben verloren om naar nieuwe plaatsen te bewegen of te ‘springen’. Ongeveer 50% van het menselijk genoom bestaat uit ‘dode’ transposons.23
De verplaatsing van actieve transposons kan leiden tot mutaties, waardoor de activiteit van genen verandert. Een zichtbaar voorbeeld van transposonbeweging (transpositie genoemd), is de verkleuring van de korrels in Indische maïs (zie rechtsonder). De transposons die bij de mens actief zijn, zouden betrokken zijn bij ziekten bij de mens, waaronder kanker.242526


Mutatie Samenvatting
Genetische verandering (mutatie) Inleiding
- De abnormale gedragingen van kankercellen zijn het resultaat van een reeks mutaties in belangrijke regulerende genen (d.w.z. DNA-herstelgenen).
- Van de meeste kankersoorten wordt gedacht dat ze ontstaan uit een enkele voorlopercel die voldoende mutaties oploopt om een kankercel te worden.
DNA Mutaties
- Genetische veranderingen kunnen klein zijn, slechts één of enkele nucleotiden beïnvloeden (puntmutaties) of ze kunnen vrij groot zijn, de structuur van een chromosoom of chromosomen veranderen.
- Puntmutaties
- Translatie is de productie van een eiwit door enzymen die drie nucleotide-‘woorden’ (codons) langs een boodschapper-RNA (mRNA) ‘lezen’.
- Zelfs het veranderen van één enkele nucleotide langs het DNA van een gen kan leiden tot een volledig niet-functioneel eiwit. De mutaties worden gegroepeerd volgens de veranderingen die ze veroorzaken in het resulterende eiwitproduct van het aangetaste gen.
- Nonsense mutaties – Het nieuwe (gemuteerde) codon zorgt ervoor dat de eiwitsynthese voortijdig stopt.
- Missense mutaties – Het veranderde codon resulteert in de invoeging van een onjuist aminozuur in het eiwit.
- Frameshift mutaties – Het verlies of de winst van 1 of 2 nucleotiden in een mRNA veroorzaakt codons die verkeerd worden gelezen. Resulteert vaak in verkorte en niet functionele eiwitten.
- Veranderingen op chromosoomniveau
- Translocaties – Breuk en (soms) uitwisseling van chromosoomfragmenten.
- Genamplificatie – Abnormale replicatie creëert meerdere kopieën van een regio van een chromosoom. Uiteindelijk leidt dit tot overproductie van de corresponderende eiwitten.
- Inversies – Segmenten DNA worden losgemaakt van een chromosoom en vervolgens opnieuw ingebracht in de tegenovergestelde oriëntatie.
- Duplicaties/deleties – Een gen of een groep genen kan helemaal verloren gaan of meer dan één keer worden gekopieerd binnen een chromosoom.
- Aneuploïdie – Een genetische verandering die het verlies of de aanwinst van volledige chromosomen inhoudt.
- Spontane mutaties kunnen optreden als gevolg van ongerepareerd DNA of willekeurige moleculaire gebeurtenissen.
- Aneuploïdie komt zeer vaak voor in kankercellen.
Epigenetische veranderingen
- Genexpressie kan worden veranderd door veranderingen in het DNA en chromatine die de genetische sequentie niet veranderen. Voorbeelden zijn DNA-methylering en acetylering van histonen.
- Methylering – Sommige nucleotiden in het DNA worden gewijzigd door de toevoeging van een methylgroep die gepaard gaat met de inactivering van die regio van het DNA
- Acetylering – Toevoeging van acetylgroepen maakt het DNA losser en verhoogt de genexpressie.
Geïnduceerde mutaties
- Mutaties kunnen worden geïnduceerd door organismen (of cellen) aan allerlei behandelingen bloot te stellen:
- Radiation – UV-stralen veroorzaken puntmutaties en röntgenstralen veroorzaken meerdere vormen van schade.
- Chemische mutagenen – Kunnen zich binden aan DNA of de bouwstenen van DNA en de replicatie- of transcriptieprocessen verstoren.
- Chronische ontsteking – DNA-beschadiging door de productie van mutagene chemicaliën door de cellen van het immuunsysteem
- Zuurstofradicalen – Ontstaan bij de energieproductie van een cel en kunnen het DNA beschadigen.
Andere genetische veranderingen
- Aberrante celdeling die leidt tot een onjuiste deling van de chromosomen kan leiden tot aneuploïdie.
- Virussen kunnen op verschillende manieren genetische schade veroorzaken en worden in verband gebracht met een breed scala van kankersoorten.
Mutatie en kanker
- Het lijkt erop dat de overgang van een normale, gezonde cel naar een kankercel een stapsgewijze progressie is.
- De ontwikkeling van kanker vereist genetische veranderingen in verschillende oncogenen en tumoronderdrukkers.
- Alle kankers moeten hetzelfde spectrum van regulerende functies overwinnen om te kunnen groeien en voortschrijden, maar de betrokken genen kunnen verschillen.
- De heterogeniteit van kanker bemoeilijkt de diagnose en behandeling.
- Het is mogelijk disfunctionele genen te erven die leiden tot de ontwikkeling van een familiaire vorm van een bepaald type kanker.
Know the Flow: Mutation
Know the Flow is een interactief spel waarmee u uw kennis kunt testen. Om te spelen:
- Sleep de juiste keuzes uit de kolom aan de rechterkant en plaats ze in volgorde in de vakjes aan de linkerkant. Merk op dat u slechts vijf van de zes keuzes zult gebruiken om het spel te voltooien.
- Als u klaar bent, klik dan op ‘Check’ om te zien hoeveel u er goed heeft.
- Bij onjuiste antwoorden, klik op ‘Description’ om informatie over de processen te bekijken.
- Om het opnieuw te proberen, kies ‘Reset’ en begin opnieuw.
-
1
-
2
-
3
-
4
-
5
-
Leer meerEen cel is bezig met de synthese van DNA
-
Leer meerVeel kopieën van een regio van een chromosoom worden gemaakt
-
Leer meerTranscriptie van geamplificeerde genen
-
Leer meerTranscriptie van geamplificeerde genen
-
Leer meerOverproductie van een belangrijk eiwit leidt tot groei van medicijnresistente tumor
-
Meer informatieDuplicatie komt voor
Speel opnieuw
- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) vertegenwoordigd door National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. “Creatie van menselijke tumorcellen met gedefinieerde genetische elementen.” Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, 20 juli 2012
- 5. Brégeon D, Doetsch PW. Transcriptionele mutagenese: oorzaken en betrokkenheid bij tumorontwikkeling. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. “Chromosome studies on normal and leukemic human leukocytes.” J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. “A new consistent chromosomal abnormality in chronic myelogenous leukemia identified by quinacrine fluorescence and Giemsa staining.” Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exposure to low-dose ionizing radiation from medical imaging procedures. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: Wat is het risico? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Kosmische straling in de commerciële luchtvaart. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. “Oxidatieve Stress, DNA schade en borstkanker.” AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. “Oxidatieve stress en experimentele carcinogenese.” Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. “Oxy radicalen, lipide peroxidatie en DNA schade.” (2002)181-182:219-222
- 16. Nair V. Retrovirus-geïnduceerde oncogenese en veiligheid van retrovirale vectoren. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr virus and Burkitt lymphoma. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogene retrovirussen en kanker. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-gerelateerd hepatocellulair carcinoom: Van chronische ontsteking tot kanker. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. The origin and behavior of mutable loci in maize. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobelprijs lezing
- 23. Burns KH, Boeke JD. Menselijke transposon tectonics. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobiele genetische elementen en kanker. Van mutaties tot gentherapie. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobile elements in the human genome: implications for disease. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pitt WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Natural mutagenesis of human genomes by endogenous retrotransposons. Cell. 2010 Jun 25;141(7):1253-61.