US Pharm. 2009;34(2):25-27.
Kardiovaskulära sjukdomar (CVD), som är den främsta dödsorsaken i världen, involverar mekanismer som ännu inte är helt klarlagda. Plasmalipider är biologiskt nödvändiga för syntesen av cellmembran och hormonproduktion och är en källa till fria fettsyror, men dyslipidemi har länge varit kopplad till ökad förekomst av CVD, stroke och perifer artärsjukdom.1
Traditionell riskstratifiering
Den nuvarande behandlingsmetoden för dyslipidemi specificeras i National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 I ATP III härleds riskfaktorer och efterföljande riskstratifiering genom att beräkna det som kallas Framingham risk score (FRS), som har använts i årtionden för att förutsäga risken för CVD. ATP III innehåller rekommendationer för riskstratifiering enligt flera riskfaktorer, diabetes och metaboliskt syndrom. Riskfaktorer för kranskärlssjukdom (CHD) inkluderar högt blodtryck (blodtryck ≥140/90 eller användning av antihypertensiva medel), familjehistoria (förstagradssläkting med CHD ), ålder (man, ≥45 år; kvinna, ≥55 år), nivå av högdensitetslipoprotein (HDL) som överstiger 40 mg/dL och rökning. En HDL-nivå som överstiger 50 mg/dL identifieras som hjärtskyddande och betraktas därför som en ”negativ” riskfaktor. Förutom att ange specifika riskfaktorer för hjärt-kärlsjukdom identifierar ATP III riskekvivalenter för hjärt-kärlsjukdom (tillstånd som ger en liknande risk för en hjärt-kärlsjukdom). KOL-riskekvivalenter inkluderar karotisartärsjukdom, bukaortaaneurysm, perifer artärsjukdom, diabetes mellitus eller en tioårsrisk för hjärtinfarkt (MI) på minst 20 % (dvs. FRS ≥20 %).1,2
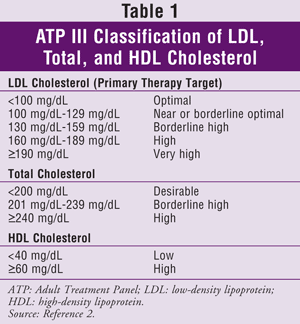
ATP III anger lipoprotein med låg densitet (LDL) som det primära målet för kolesterolbehandling. Att uppnå målnivåer för triglycerider (TG) och HDL anses i allmänhet vara ett sekundärt mål. Kolesterolmålen för den allmänna befolkningen anges i TABELL 1.2
En uppdatering av ATP III publicerades 2004.3 Denna version innehåller en rekommendation om en 30-40-procentig sänkning av LDL-värdet från utgångsvärdet hos patienter som anses löpa måttlig eller hög risk för CHD och riktlinjer enligt vilka en patient anses löpa mycket hög risk. Patienter med mycket hög risk kan omfatta patienter med etablerad hjärt-kärlsjukdom plus en eller flera av följande: flera stora riskfaktorer (t.ex. diabetes), allvarliga och dåligt kontrollerade riskfaktorer (t.ex, rökning, okontrollerat högt blodtryck); flera komponenter av det metabola syndromet (TABELL 2); eller akut kranskärlssyndrom.

I ATP III-uppdateringen föreslås också att lipidsänkande medicinering och ett LDL-mål på mindre än 100 mg/dL ska övervägas för vissa patienter.3 Dessa patienter ska ha en 10-årig risk för KOL på 10-20 % och en LDL-nivå mellan 100 mg/dL och 130 mg/dL. De ska också vara i hög ålder och ha allvarliga riskfaktorer; TG-nivå 200 mg/dL eller mer, icke-HDL-nivå 160 mg/dL eller mer och HDL-nivå 40 mg/dL eller mindre; metaboliskt syndrom; eller nya riskfaktorer som högkänsligt C-reaktivt protein (hs-CRP) (<3 mg/dL) eller koronarkalcium som är större än den 75:e percentilen för en persons ålder och kön.
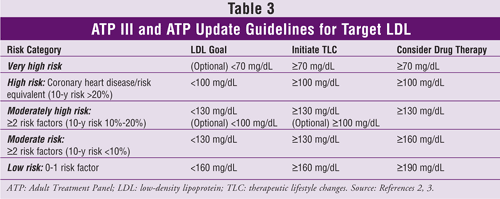
Mål-LDL-nivåer, rekommendationer för terapeutiska livsstilsförändringar och information om initiering av kolesterolsänkande läkemedel (baserat på antalet riskfaktorer för hjärt-kärlsjukdom eller motsvarande) från ATP III och dess uppdatering finns i TABELL 3.2,3
Otraditionella riskmarkörer
Traditionell förutsägelse av risk för hjärt-kärlsjukdom bygger i hög grad på FRS. Det finns dock begränsningar i detta tillvägagångssätt, eftersom FRS har konstaterats överskatta risken i lågriskpopulationer och underskatta risken i högriskpopulationer.4 Faktum är att plötslig död och icke-dödlig hjärtinfarkt utan tidigare symtom förekommer hos upp till 25 % av patienterna med hjärt-kärlsjukdom.5 Som tidigare nämnts rekommenderas i ATP III-uppdateringen att man överväger en aggressivare lipidbehandling hos patienter med nya riskfaktorer.3 Under det senaste decenniet har forskningen fokuserat på den roll som icke-traditionella riskfaktorer spelar i patofysiologin för hjärt-kärlsjukdom. Fibrinogen, hs-CRP, koronarkalk och analys av lipoproteinsubfraktioner har varit föremål för mycket forskning.
Och även om flera inflammationsmarkörer har förknippats med CVD är det bara de som lätt kan mätas som har ett praktiskt värde.6 En sådan inflammationsmarkör är hs-CRP.7 Förhöjt hs-CRP har förknippats med en ökad risk för CVD, stroke och perifera kärlsjukdomar hos patienter med och utan känd ateroskleros. Nivåerna av hs-CRP har delats in i tertiler. Dessa tertiler (<1,0 mg/L, 1 mg/L-3 mg/L och >3 mg/L) motsvarar respektive FRS med låg, måttlig och hög risk.8
Den senaste stora kliniska studien som undersöker användbarheten av CRP för att förutsäga kardiovaskulär risk är JUPITER-studien.9 I denna studie ingick specifikt friska patienter med normalt kolesterol (LDL <130 mg/dL) och en förhöjd CRP-nivå (>2 mg/dL). Dessa patienter behandlades med rosuvastatin 20 mg eller placebo för att utvärdera den sammansatta slutpunkten av efterföljande MI eller icke-dödlig stroke och den sammansatta risken för MI, stroke och död av kardiovaskulära orsaker. Studien avbröts efter 1,9 års uppföljning eftersom behandling med rosuvastatin visade sig minska den sammansatta slutpunkten med 44 % jämfört med placebo. Detta har varit en banbrytande studie eftersom den visar att patienter utan andra kardiovaskulära riskfaktorer än förhöjt CRP fick en betydande fördel av rosuvastatinbehandling; kostnadseffektiviteten av att screena friska individer för förhöjt CRP och utöka förskrivningen av statiner i sådana fall är dock okänd.
När statiner har andra lipidsänkare (t.ex. niacin, fibrater och ezetimib) samt tiazolidinedioner och raloxifen visat sig minska CRP-nivåerna. Det rekommenderas för närvarande att beakta hs-CRP-nivåer i behandlingsbeslutsprocessen för patienter med en FRS-beräknad CVD-risk på 10-20 % under de närmaste 10 åren, och att undvika rutinmässig mätning av hs-CRP i den allmänna vuxna befolkningen.7,8,10
Fibrinogen har också undersökts som en icke-traditionell prediktor för CVD-risk. I studien Coronary Artery Risk Development in Young Adults (CARDIA) var en förhöjd fibrinogennivå hos personer i åldern 25 till 37 år förknippad med en ökad risk för subklinisk CVD under patientens efterföljande decennium i livet10 . Fibrinogen spelar en viktig roll i trombocytaggregation och fibrinbildning, som båda är nyckelkomponenter i ateroskleros och trombosutveckling.1,11 Patienter i CARDIA-studien som hade förhöjda fibrinogennivåer visade sig ha ökad intimtjocklek i carotis och förkalkning av kranskärl (CAC) under det efterföljande decenniet. För närvarande rekommenderas dock inte rutinmässig mätning av fibrinogennivåer.10
CAC utvecklas i aterosklerotiska kranskärl och är praktiskt taget obefintlig i en normal kärlvägg. Högre CAC-poäng är förknippade med ökad specificitet, men minskad känslighet, för prediktion av kardiovaskulär risk. Det är dock viktigt att notera att även om förhöjda CAC-poäng korrelerar med en ökad risk för CVD kan kardiovaskulära händelser fortfarande inträffa hos en patient med en CAC-poäng på noll. Det prognostiska värdet av att mäta CAC har diskuterats mycket under det senaste decenniet. Sedan 2000 har det funnits allt fler bevis för att CAC kan vara en oberoende prediktiv faktor för kardiovaskulärt utfall utöver de traditionella riskfaktorerna. År 2007 publicerade American College of Cardiology Foundation/American Heart Association Writing Committee ett konsensusdokument om användningen av CAC vid global kardiovaskulär riskbedömning.12 Kommitténs konsensus var att avråda från oselekterad CAC-screening, eftersom den har ett begränsat kliniskt värde för patienter med låg risk för hjärt-kärlsjukdom (FRS <1%/år). I likhet med hs-CR och fibrinogen rekommenderas inte rutinmässig mätning av CAC; CAC-poäng kan dock vara ett användbart verktyg för att modifiera riskprognosen och eventuellt ändra behandlingen för lämpligt utvalda asymtomatiska patienter med intermediär risk.
Lipoprotein(a), eller Lp(a), identifieras i ATP III-riktlinjerna som en ny riskfaktor för hjärt- och kärlsjukdomar.2 Lipider transporteras genom hela kroppen i form av lipid- och proteinkomplex som kallas lipoproteiner. Lipoproteiner varierar i storlek och densitet och benämns därför som LDL, HDL och VLDL (very low density lipoprotein). Proteinkomponenterna i dessa komplex kallas apolipoproteiner. Lp(a), en modifierad form av LDL, består av en apoprotein(a)-molekyl eller apo(a)-molekyl som är kopplad till apolipoprotein B-molekylen eller apo(b)-molekylen i den traditionella LDL-partikeln. Den liknar LDL i både sammansättning och densitet. Eftersom apo(a)-komponenten i Lp(a) strukturellt liknar plasminogen tror man att den kan konkurrera med plasminogen i kroppen och därmed hämma fibrinolysen. Dessutom spekuleras det att Lp(a) främjar kolesterolansamling, utveckling av skumceller och spridning av aterosklerotiska plack.1 Både niacin och östrogen har visat sig sänka Lp(a) på ett effektivt sätt, men ingen statin gör det på ett effektivt sätt.13,14 Förhöjda nivåer av Lp(a) har förknippats med en ökad risk för hjärt- och kärlsjukdomar i vissa, men inte alla, studerade populationer.15 För närvarande finns det inga bevis för att övervakning eller sänkning av Lp(a)-nivåerna är kliniskt användbart, och rutinmässig mätning rekommenderas inte.16
Apolipoprotein(b) är den viktigaste proteinkomponenten inte bara i LDL, utan även i LDL med medelhög densitet och VLDL. För prediktion av kardiovaskulär risk har det nyligen föreslagits att mätning av apo(b)- och icke-HDL-kolesterolnivåer är bättre än mätning av LDL-kolesterol.17 I en post-hoc-analys av studierna Treating to New Targets och IDEAL konstaterades att icke-HDL-kolesterol (produkten av att subtrahera HDL-kolesterol från det totala kolesterolmåttet) och apo(b) hade ett närmare samband med kardiovaskulära utfall än LDL-kolesterol.18,19 Det spekuleras i att framtida riktlinjer kan gynna icke-HDL-kolesterol eller apo(b) snarare än LDL-kolesterol som det primära behandlingsmålet; för närvarande förblir dock LDL det primära målet för kolesterolhantering.
Hyperhomocysteinemi har oberoende kopplats till en ökad risk för hjärt- och kärlsjukdomar, även om det inte är lika starkt förknippat med detta som FRS, och den exakta orsaksmekanismen är okänd.20 Defekter i folat- och B12-vägar kan leda till förhöjda homocysteinnivåer, liksom kost med brist på folat eller vitamin B6 och B12 samt läkemedel som stör metabolismen eller absorptionen av dessa vitaminer.1 Njur- och leversvikt kan också leda till förhöjda homocysteinnivåer. Hyperhomocysteinemi tros vara ganska ovanligt. Den äldre befolkningen kan ha en ökad risk för detta tillstånd på grund av folatbrist i kosten. Mätning av homocysteinnivåer bör utföras när patienten är i fastande tillstånd, med förhöjda nivåer som föranleder en utvärdering av etiologin.
Till sist är analys av lipoproteinsubfraktioner ett annat potentiellt verktyg för ytterligare kardiovaskulär riskstratifiering. Det är känt att LDL-mätning omfattar ett spektrum av LDL-partiklar som sträcker sig från de som är små och täta till de som är lättare och mer flytande. Små, täta LDL-partiklar anses ge en högre kardiovaskulär risk.21 När LDL ökar, ökar de små, täta LDL-subfraktionerna. På samma sätt består total-HDL-mätningar av ett spektrum av partiklar som varierar i storlek och densitet. Mindre, tätare HDL-molekyler ger mindre kardioprotektiv effekt. När HDL-nivåerna sjunker sker en markant ökning av små HDL-partiklar. På grundval av dessa resultat har det föreslagits att förhöjda LDL-värden, förhöjda små LDL-subfraktioner, låga HDL-värden och låga, stora HDL-subfraktioner är prediktiva för CVD. I ATP III-riktlinjerna erkänns att små LDL-partiklar har identifierats som en komponent i aterogenesen och att mätningar av HDL-subfraktioner kan bidra till riskbedömning av CVD. Enligt riktlinjerna är dock förmågan hos LDL-subfraktioner att förutsäga CVD oberoende av andra riskfaktorer inte väl definierad. Vidare påpekar ATP III att den kliniska nyttan av mätning av HDL-subfraktioner inte har fastställts. På grund av detta och det faktum att meningsfulla och reproducerbara gränsvärden för partikelstorlek, densitet och antal ännu inte har fastställts, används mätning av lipoproteinsubfraktioner inte vid rutinmässig behandling av hyperlipidemi eller vid riskstratifiering. Den kan dock vara användbar som ett komplement till traditionell riskstratifiering för att bestämma behandlingsaggressivitet hos en patient med intermediär risk.
Slutsats
Och även om ATP III-baserade behandlingsriktlinjer, som i hög grad bygger på FRS, förblir kärnan i behandlingsrekommendationerna för CVD, framträder icke-traditionella indikatorer för CVD som komplement för att ge en mer förfinad riskstratifiering och hjälpa till med att identifiera patienter med tidig subklinisk sjukdom som kan behöva en tidigare och mer aggressiv behandling.
Den exakta roll som icke-traditionella riskmarkörer för CVD spelar för att fastställa en persons framtida kardiovaskulära risk, riktlinjer för målnivåer och specifika rekommendationer om vilka befolkningsgrupper som bör få dessa markörer rutinmässigt uppmätta har ännu inte fastställts. Ingen av de icke-traditionella CVD-markörerna rekommenderas för närvarande för rutinmässig screening, men hos patienter för vilka beslutet att inleda behandling (särskilt medicinering) är oklart kan mätning av dessa riskfaktorer vara användbar. I sådana situationer kan mätning av icke-traditionella riskfaktorer utöver de traditionella verktygen för att förutsäga risken för hjärt-kärlsjukdom ge en betydande fördel.
1. Talbert RL. Hyperlipidemi. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Third report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Besökt den 1 november 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death: epidemiology, transient risk, and intervention assessment. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reaktivt protein: en otraditionell serummarkör för kardiovaskulär risk. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. C-reaktivt protein, en känslig markör för inflammation, förutsäger framtida risk för kranskärlssjukdom hos ursprungligen friska medelålders män: resultat från MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984-1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markörer för inflammation och kardiovaskulär sjukdom: tillämpning på klinisk och folkhälsopraxis: ett uttalande för hälso- och sjukvårdspersonal från Centers for Disease Control and Prevention och American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin för att förebygga vaskulära händelser hos män och kvinnor med förhöjt C-reaktivt protein. N Engl J Med. 2008;359:2195-2207.
10. Kommittén för kardiovaskulära och metabola sjukdomar. Bedömning av risken för hjärt- och kärlsjukdomar med otraditionella riskfaktorer: de senaste rönen. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Additivt värde av fibrinogen- och högkänsliga C-reaktiva proteinnivåer som mäts med immunoassay för att förutsäga kardiovaskulära händelser. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. En rapport från American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Terapi för att sänka lipoprotein (a)-nivåerna. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatin och niacin, antioxidativa vitaminer eller kombinationen för förebyggande av kranskärlssjukdom. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Inget samband mellan koncentrationer av lipoprotein(a) i plasma och förekomst eller avsaknad av koronar ateroskleros hos afroamerikaner. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a)-nivåer och risk för framtida kranskärlssjukdom: storskaliga prospektiva data. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipider, apolipoproteiner och deras förhållanden i förhållande till kardiovaskulära händelser vid statinbehandling. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Intensiv lipidsänkning med atorvastatin hos patienter med stabil kranskärlssjukdom. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocystein och kardiovaskulära sjukdomar: bevis för kausalitet från en metaanalys. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Low-density lipoprotein size and cardiovascular risk assessment. QJM.2006;99:1-14.