Zellen enthalten viel Wasser. Eine der Aufgaben des Wassers ist es, verschiedene Stoffe zu lösen. Zum Beispiel gibt es viele verschiedene ionische Verbindungen (Salze) in den Zellen. Ionen werden zur Aufrechterhaltung des Zellpotentials verwendet und sind wichtig für die Zellsignale und die Muskelkontraktion.
Wie kann man feststellen, ob eine Verbindung ionisch oder kovalent ist?
Es gibt keine einfache Antwort auf diese Frage. Viele Bindungen liegen irgendwo dazwischen. Bei einer polaren kovalenten Bindung wird ein Elektronenpaar zwischen zwei Atomen geteilt, um ihre Oktette zu erfüllen, aber die Elektronen liegen näher an einem Ende der Bindung als am anderen. An einem Ende der Bindung befindet sich mehr negative Ladung, während am anderen Ende mehr positive Ladung verbleibt.
Die Elektronegativitätswerte der verschiedenen Atome helfen uns zu entscheiden, wie gleichmäßig ein Elektronenpaar in einer Bindung geteilt wird. Die Elektronegativität nimmt zur oberen rechten Ecke des Periodensystems hin zu, was auf eine Kombination aus Kernladung und Abschirmungsfaktoren zurückzuführen ist. Atome in der oberen rechten Ecke des Periodensystems üben eine stärkere Anziehungskraft auf ihre gemeinsam genutzten Bindungselektronen aus, während Atome in der unteren linken Ecke eine schwächere Anziehungskraft auf die Elektronen in kovalenten Bindungen ausüben.
In einer Kohlenstoff-Sauerstoff-Bindung würden mehr Elektronen vom Sauerstoff angezogen werden, da dieser in seiner Reihe im Periodensystem rechts vom Kohlenstoff liegt. Verbindungen wie Dimethylether, CH3OCH3, sind ein wenig polar. Formaldehyd, CH2O, ist sogar noch polarer. Elektronen in Pi-Bindungen werden aus quantenmechanischen Gründen lockerer gehalten als Elektronen in Sigma-Bindungen. Dadurch kann der Sauerstoff die Elektronen in einer Mehrfachbindung leichter zu sich ziehen als in einer Sigma-Bindung.

Nicht alle Polaritäten sind durch einen Blick auf das Periodensystem leicht zu bestimmen. Die Richtung des Dipols in einer Bor-Wasserstoff-Bindung wäre schwer vorherzusagen, ohne die Elektronegativitätswerte nachzuschlagen, da Bor weiter rechts, Wasserstoff aber weiter oben liegt. Wie sich herausstellt, ist der Wasserstoff leicht negativ.
Eine Bindung ist ionisch, wenn der Elektronegativitätsunterschied zwischen den Atomen so groß ist, dass ein Atom dem anderen ein Elektron vollständig entziehen könnte. Dies ist häufig bei Verbindungen der Fall, die Elemente vom linken Rand des Periodensystems (Natrium, Kalium, Kalzium usw.) mit Elementen in der äußersten rechten Ecke des Periodensystems (meist Sauerstoff, Fluor, Chlor) verbinden. Natriumchlorid ist eine ionische Verbindung.
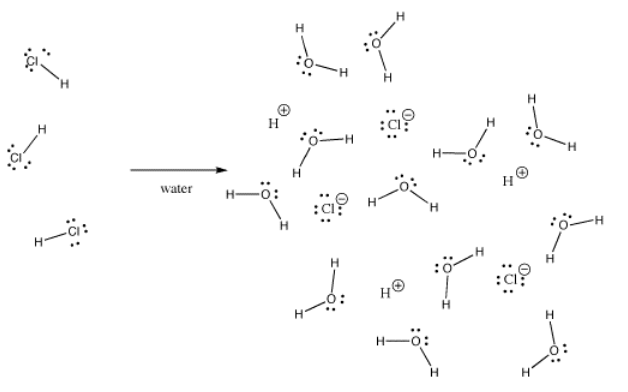
Viele Bindungen können in einer Situation kovalent und in einer anderen ionisch sein. Zum Beispiel ist Chlorwasserstoff, HCl, ein Gas, in dem Wasserstoff und Chlor kovalent gebunden sind, aber wenn HCl in Wasser eingeblasen wird, ionisiert es vollständig, um das H+ und Cl- einer Salzsäurelösung zu ergeben. Selbst in gasförmigem HCl ist die Ladung nicht gleichmäßig verteilt. Das Chlor ist teilweise negativ und der Wasserstoff teilweise positiv.
Kaliumhydroxid, KOH, enthält eine kovalente (O-H) und eine ionische Bindung (K-O). Wasserstoff ist ein heikles Element, da es sich sowohl an der Spitze des Periodensystems als auch auf der linken Seite befindet. Er ist gerade elektropositiv genug, um in einigen Fällen ionische Bindungen zu bilden. In anderen Fällen ist er gerade elektronegativ genug, um kovalente Bindungen zu bilden.
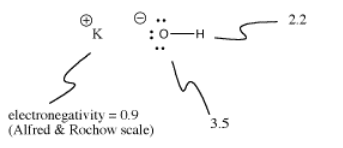
In KOH ist die K-O-Bindung ionisch, weil der Unterschied in der Elektronegativität zwischen Kalium und Sauerstoff groß ist. Der Unterschied in der Elektronegativität zwischen Sauerstoff und Wasserstoff ist nicht klein. Eine O-H-Bindung kann manchmal ionisieren, aber nicht in allen Fällen.
Manchmal hängt die Ionisierung davon ab, was sonst noch in einem Molekül vor sich geht. Da die K-O-Bindung in Kaliumhydroxid ionisch ist, ist die O-H-Bindung nicht sehr wahrscheinlich zu ionisieren. Der Sauerstoff ist bereits negativ geladen. Die Ladungstrennung kostet Energie, daher ist es schwieriger, dem Sauerstoff eine zweite negative Ladung zu verleihen, indem man auch die O-H-Bindung ionisiert. Häufig sind erste Ionisationen in Molekülen viel einfacher als zweite Ionisationen.
Übung \(\PageIndex{1}\)
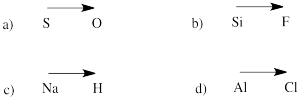
Vorhersagen Sie die Richtung der Polarität in einer Bindung zwischen den Atomen der folgenden Paare:
a) Schwefel-Sauerstoff b) Silizium-Fluor
c) Wasserstoff-Natrium d) Chlor-Aluminium
Antwort
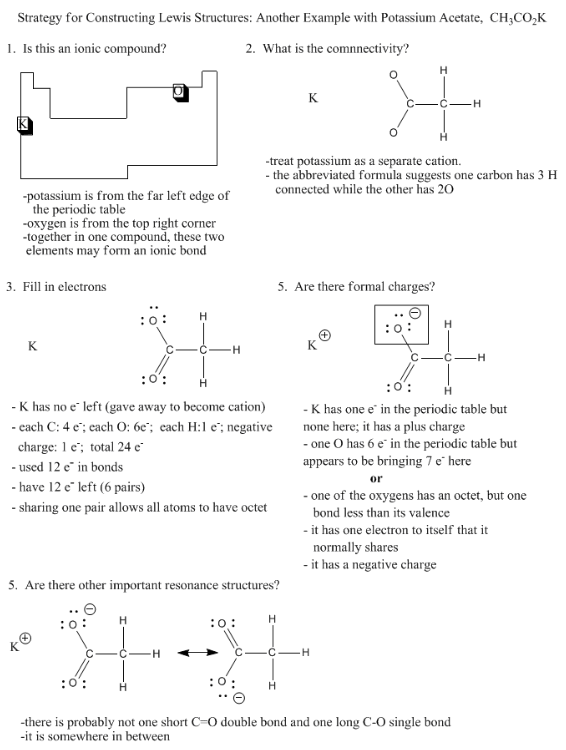
Da es so häufig vorkommt, dass ein Element von der äußersten linken Seite des Periodensystems als Kation vorliegt, und die Elemente auf der äußersten rechten Seite negative Ladungen tragen, kann man oft davon ausgehen, dass eine Verbindung, die ein Beispiel von beiden enthält, mindestens eine Ionenbindung aufweist.
Übung \(\PageIndex{2}\)
Zeichne die Strukturen der folgenden Verbindungen. Jede von ihnen enthält mindestens ein Anion und ein Kation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Antwort
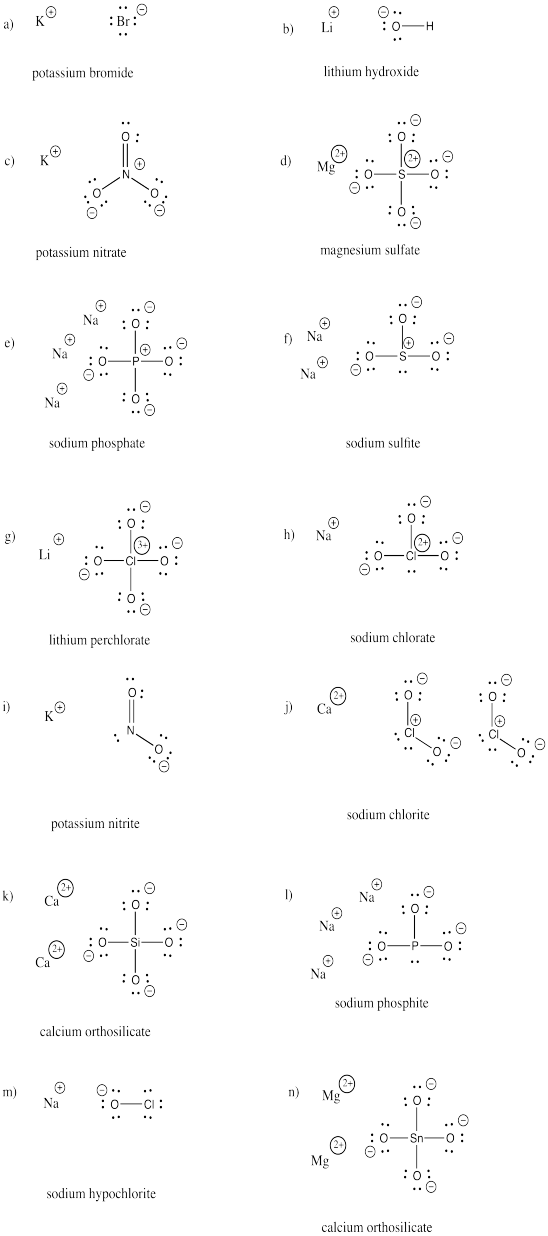
Übung \(\PageIndex{3}\)
Ammoniumion, NH4+, ist ein häufiges Molekülion. Zeichne die Strukturen der folgenden Verbindungen, die dieses Ion enthalten.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Antwort
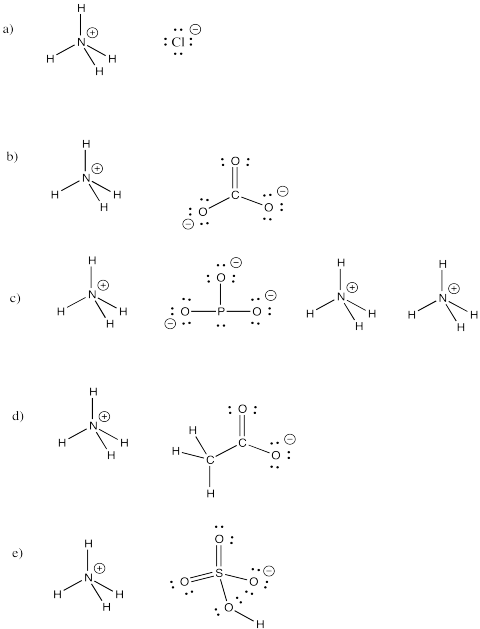
Übung \(\PageIndex{4}\)
Viele Anionen haben Namen, die etwas über ihre Struktur sagen.
| Präfix- oder -Suffix |
Gemeinsame Bedeutung |
Beispielname | Beispielformel |
| -ide | Atom liegt als Anion | Chlorid | Cl vor – |
| -ate | Atom liegt als Oxyanion vor; gewöhnlich eine häufige Form | Chlorat | ClO3- |
| -it | Atom liegt als Oxyanion vor, aber mit weniger Sauerstoff (oder niedrigerer „Oxidationsstufe“) als eine andere häufige Form | Chlorit | ClO2- |
| pro- | Atom liegt als Oxyanion vor, aber mit noch mehr Sauerstoff als die „-ate“ Form | Perchlorat | ClO4- |
| hypo- | Atom liegt als Oxyanion vor, aber mit noch weniger Sauerstoff als die „-it“-Form | Hypochlorit | ClO- |
Schlage anhand der Tabelle Namen für die folgenden Anionen vor:
a) Br- b) O2- c) F- d) CO32- (gewöhnliches Oxyanion) e) NO3- (gewöhnliches Oxyanion) f) NO2-
g) S2- h) SO42- (gewöhnliches Oxanin) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (gewöhnliches Oxyanion) o) PO33- p) I- q) IO3- (gemeinsames Oxyanion) r) IO4-
Antwort a)
Bromid
Antwort b)
Oxid
Antwort c)
Fluorid
Antwort d)
Carbonat
Antwort e)
Nitrat
Antwort f)
Nitrit
Antwort g)
Sulfid
Antwort h)
Sulfat
Antwort i)
Sulfit
Antwort j)
Persulfat
Antwort k)
Karbid
Antwort l)
Nitrid
Antwort m)
Arsenid
Antwort n)
Phosphat
Antwort o)
Phosphit
Antwort p)
Jodid
Antwort q)
Jodat
Antwort r)
Periodat
Vermerk
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)