Atomare Emissionsspektren
Die Elektronen in einem Atom neigen dazu, so angeordnet zu sein, dass die Energie des Atoms so niedrig wie möglich ist. Der Grundzustand eines Atoms ist der niedrigste Energiezustand des Atoms. Wenn diesen Atomen Energie zugeführt wird, nehmen die Elektronen die Energie auf und bewegen sich auf ein höheres Energieniveau. Diese Energieniveaus der Elektronen in den Atomen sind quantisiert, was wiederum bedeutet, dass das Elektron nicht kontinuierlich, sondern in diskreten Schritten von einem Energieniveau zum anderen wechseln muss. Ein angeregter Zustand eines Atoms ist ein Zustand, in dem seine potenzielle Energie höher ist als im Grundzustand. Ein Atom im angeregten Zustand ist nicht stabil. Wenn es in den Grundzustand zurückkehrt, gibt es die zuvor gewonnene Energie in Form von elektromagnetischer Strahlung ab.
Wie gewinnen Atome also überhaupt Energie? Eine Möglichkeit besteht darin, einen elektrischen Strom durch eine eingeschlossene Gasprobe bei niedrigem Druck zu leiten. Da die Elektronenenergieniveaus für jedes Element einzigartig sind, leuchtet jede Gasentladungsröhre in einer unverwechselbaren Farbe, je nach Identität des Gases (siehe unten).

„Neon“-Schilder sind bekannte Beispiele für Gasentladungsröhren. Allerdings sind nur Schilder, die in der rot-orangenen Farbe der Abbildung leuchten, tatsächlich mit Neon gefüllt. Schilder in anderen Farben enthalten andere Gase oder Gasgemische.
Wissenschaftler untersuchten die charakteristische rosa Farbe der Gasentladung, die durch Wasserstoffgas erzeugt wird. Wenn ein schmaler Strahl dieses Lichts durch ein Prisma betrachtet wurde, wurde das Licht in vier Linien mit ganz bestimmten Wellenlängen (und Frequenzen, da \(\lambda\) und \(\nu\) in umgekehrtem Verhältnis zueinander stehen) aufgeteilt. Ein atomares Emissionsspektrum ist das Linienmuster, das entsteht, wenn Licht durch ein Prisma fällt, um es in die verschiedenen Frequenzen des enthaltenen Lichts zu zerlegen. Die folgende Abbildung zeigt das atomare Emissionsspektrum von Wasserstoff.
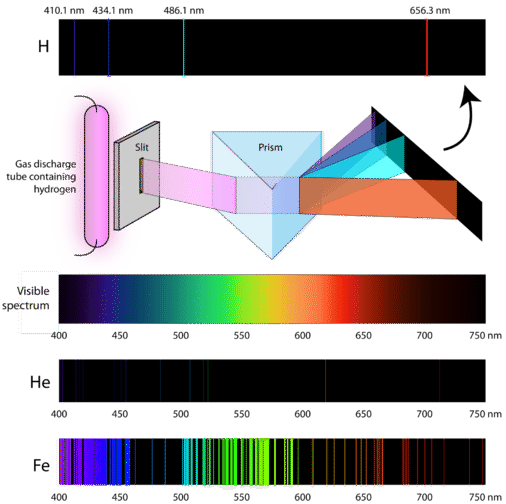
Die klassische Theorie war nicht in der Lage, die Existenz von Atomemissionsspektren, die auch als Linienemissionsspektren bezeichnet werden, zu erklären. Nach der klassischen Physik wäre ein Atom im Grundzustand in der Lage, jede beliebige Energiemenge zu absorbieren und nicht nur diskrete Mengen. Ebenso könnte jede beliebige Energiemenge freigesetzt werden, wenn die Atome in einen niedrigeren Energiezustand zurückfallen. Dies würde zu einem so genannten kontinuierlichen Spektrum führen, in dem alle Wellenlängen und Frequenzen vertreten sind. Weißes Licht, das durch ein Prisma betrachtet wird, und ein Regenbogen sind Beispiele für kontinuierliche Spektren. Atomare Emissionsspektren waren ein weiterer Beweis für die gequantelte Natur des Lichts und führten zu einem neuen Modell des Atoms auf der Grundlage der Quantentheorie.