Periodische Trends
Zunächst werden wir uns auf einzelne Atome konzentrieren und über Trends nachdenken, die mit der Position eines Elements im Periodensystem zusammenhängen. Als erste Modelle dienen uns die einfachen organischen Verbindungen Ethan, Methylamin und Ethanol, aber die Konzepte lassen sich auch auf komplexere Biomoleküle mit denselben Funktionen anwenden, zum Beispiel die Seitenketten der Aminosäuren Alanin (Alkan), Lysin (Amin) und Serin (Alkohol).
Horizontaler periodischer Trend bei Säure und Basizität:
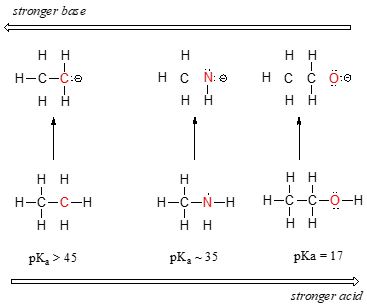
Wir können einen klaren Trend bei der Säure erkennen, wenn wir uns von links nach rechts entlang der zweiten Reihe des Periodensystems von Kohlenstoff über Stickstoff zu Sauerstoff bewegen. Der Schlüssel zum Verständnis dieses Trends liegt in der Betrachtung der hypothetischen konjugierten Base in jedem Fall: Je stabiler (schwächer) die konjugierte Base, desto stärker die Säure. Schauen Sie sich an, wo die negative Ladung in jeder konjugierten Base landet. In der konjugierten Base von Ethan wird die negative Ladung von einem Kohlenstoffatom getragen, während sich die negative Ladung in der konjugierten Base von Methylamin und Ethanol an einem Stickstoff- bzw. Sauerstoffatom befindet. Erinnern Sie sich aus Abschnitt 2.4A, dass die Elektronegativität auch zunimmt, wenn man sich von links nach rechts entlang einer Reihe des Periodensystems bewegt, was bedeutet, dass Sauerstoff das elektronegativste der drei Atome ist und Kohlenstoff das am wenigsten elektronegative.
Anmerkung
Je elektronegativer ein Atom ist, desto besser kann es eine negative Ladung tragen. Schwächere Basen tragen negative Ladungen an elektronegativen Atomen, stärkere Basen tragen negative Ladungen an weniger elektronegativen Atomen.
Das Methoxid-Anion ist also die stabilste (niedrigste Energie, am wenigsten basisch) der drei konjugierten Basen, und das Ethylcarbanion-Anion ist die am wenigsten stabile (höchste Energie, am meisten basisch). Umgekehrt ist Ethanol die stärkste Säure und Ethan die schwächste Säure.
Wenn wir uns innerhalb einer bestimmten Spalte des Periodensystems vertikal bewegen, können wir wiederum einen klaren Trend in der Säurezahl beobachten. Dies lässt sich am besten anhand der Halogensäuren und Halogenide veranschaulichen: Die Basizität nimmt, ebenso wie die Elektronegativität, mit zunehmender Höhe der Spalte zu.
Vertikaler periodischer Trend bei der Azidität und Basizität:

Umgekehrt nimmt die Azidität bei den Halogensäuren zu, wenn wir uns in der Säule nach unten bewegen.
Um diesen Trend zu verstehen, betrachten wir noch einmal die Stabilität der konjugierten Basen. Da Fluor das elektronegativste Halogenelement ist, könnte man erwarten, dass Fluorid auch das am wenigsten basische Halogenion ist. Tatsächlich ist es aber das am wenigsten stabile und das basischste! Es stellt sich heraus, dass bei einer vertikalen Bewegung im Periodensystem die Größe des Atoms seine Elektronegativität in Bezug auf die Basizität übertrumpft. Der Atomradius von Iod ist etwa doppelt so groß wie der von Fluor, so dass sich in einem Iodid-Ion die negative Ladung auf ein wesentlich größeres Volumen verteilt:

Dies veranschaulicht ein grundlegendes Konzept in der organischen Chemie:
Elektrostatische Ladungen, ob positiv oder negativ, sind stabiler, wenn sie auf eine größere Fläche „verteilt“ sind.
Dieser Gedanke wird im Laufe unseres Studiums der organischen Reaktivität in vielen verschiedenen Zusammenhängen immer wieder zum Ausdruck kommen. Im Moment wenden wir das Konzept nur auf den Einfluss des Atomradius auf die Basenstärke an. Da Fluorid die am wenigsten stabile (basischste) der konjugierten Halogenidbasen ist, ist HF die am wenigsten saure der Halogensäuren und nur geringfügig stärker als eine Carbonsäure. HI ist mit einem \(pK_a\) von etwa -9 fast so stark wie Schwefelsäure.
Noch wichtiger für die Untersuchung der biologischen organischen Chemie ist, dass dieser Trend zeigt, dass Thiole saurer sind als Alkohole. Der \(pK_a\) der Thiolgruppe an der Cysteinseitenkette beträgt beispielsweise etwa 8,3, während der \(pK_a\) für die Alkoholgruppe an der Serinseitenkette in der Größenordnung von 17 liegt.
Erinnern Sie sich an das Konzept der „treibenden Kraft“, das in Abschnitt 6.2 eingeführt wurde? Erinnern Sie sich, dass die treibende Kraft für eine Reaktion in der Regel auf zwei Faktoren beruht: relative Ladungsstabilität und relative Gesamtbindungsenergie. Schauen wir uns an, wie dies auf eine einfache Säure-Base-Reaktion zwischen Salzsäure und Fluoridion zutrifft:
\
Wir wissen, dass HCl (\(pK_a\) -7) eine stärkere Säure ist als HF (\(pK_a\) 3.2), so dass das Gleichgewicht für die Reaktion auf der Produktseite liegt: die Reaktion ist exergonisch, und eine „treibende Kraft“ drängt den Reaktanten zum Produkt.
Was erklärt diese treibende Kraft? Betrachten wir zunächst den Ladungsfaktor: Wie wir gerade gelernt haben, ist das Chlorid-Ion (auf der Produktseite) stabiler als das Fluorid-Ion (auf der Reaktanden-Seite). Dies erklärt zum Teil die treibende Kraft, die in dieser Reaktion vom Reaktanten zum Produkt geht: Wir gehen von einem weniger stabilen Ion zu einem stabileren Ion über.
Wie steht es mit der Gesamtbindungsenergie, dem anderen Faktor der treibenden Kraft? Wenn Sie eine Tabelle der Bindungsenergien zu Rate ziehen, werden Sie feststellen, dass die H-F-Bindung auf der Produktseite energiereicher (stärker) ist als die H-Cl-Bindung auf der Reaktantenseite: 570 kJ/mol gegenüber 432 kJ/mol). Dies trägt auch zur treibenden Kraft bei: Wir bewegen uns von einer schwächeren (weniger stabilen) Bindung zu einer stärkeren (stabileren) Bindung.