24th Annual Glaucoma Report
Klicken Sie auf die folgenden Links, um weitere Artikel aus dem Annual Update on Glaucoma zu lesen:
Glaucoma Care with Laser Precision
MIGS Madness: Ein Atlas der Möglichkeiten
Invasive Glaukom-Operationen bewältigen
Glaukom: Lebensstil der Antioxidantien-Reichen und Berühmten (verdienen Sie 2 CE-Kredite)
Die Fachleute haben sich noch nicht auf eine allgemein anerkannte Ätiologie des Glaukoms geeinigt. In einem Punkt sind sie sich jedoch einig: Die Senkung des Augeninnendrucks (IOD) ist der einzige modifizierbare Risikofaktor, um das Fortschreiten des Glaukoms zu verlangsamen. Die topische Pharmakotherapie ist der traditionelle Ansatz der ersten Wahl, und die Möglichkeiten sind vielfältiger denn je.
Dieser Artikel, Teil drei unserer Serie Take Charge of Glaucoma, untersucht die vielen Medikamente, die ODs einsetzen können, und gibt Ratschläge, wann welche Therapie bei welchen Patienten eingesetzt werden sollte.
Early Autonomics
Medikamente, die auf das vegetative Nervensystem wirken (d.h., Cholinergika und Adrenergika) bilden seit dem 19. Jahrhundert eine Grundlage der Glaukomtherapie.1,2 Cholinergika induzieren eine Miosis, die das Trabekelwerk (TM) dehnt und stimuliert, um den Abfluss des Kammerwassers dorthin und in den Schlemmschen Kanal zu erhöhen.3 Zu dieser Klasse gehören Pilocarpin, Carbachol, Physostigmin, Neostigmin und Ecothiophat. Von diesen wird nur Pilo noch routinemäßig eingesetzt. Die Behandlung zeigt eine dosisabhängige Reaktion mit einer Senkung des Augeninnendrucks um etwa 20 %, wenn es als Tagesdosis verordnet wird.4
Glaukom in die Hand nehmen
Klicken Sie auf die folgenden Links, um weitere Artikel aus unserer vierteiligen Glaukom-Serie zu lesen:
Teil eins: Glaukom: Ein Kreuzzug der Primärversorgung
Zweiter Teil: Vorbereitung Ihres diagnostischen Werkzeugkastens
Vierter Teil: Beteiligen Sie sich an der postoperativen Glaukombehandlung
Trotz ihrer Wirksamkeit ist der Einsatz von Cholinergika durch ihre okulären und systemischen Nebenwirkungen begrenzt. Dazu gehören Spasmen des Ziliarmuskels (mit entsprechenden Kopfschmerzen und induzierter Myopie), Miosis, Hornhauttoxizität, Rötung, Uveitis, mögliche Kataraktbildung, Atemdepression und gastrointestinale Beschwerden. Darüber hinaus haben neuere Medikamente eine stärkere IOD-senkende Wirkung, so dass Cholinergika nur noch in bestimmten Fällen eingesetzt werden, in denen die miotische Wirkung einen zusätzlichen Nutzen hat, wie z. B. bei akutem Winkelverschluss.
Adrenerge Agonisten hingegen wirken auf die adrenergen Alpha- oder Beta-Rezeptoren (oder beide, wenn sie nicht selektiv sind). Epinephrin, der wichtigste nicht-selektive Wirkstoff, senkt den IOD, indem er zunächst die Kammerwasserproduktion verringert und dann den Abfluss durch den TM erhöht.5 Leider ist seine Anwendung aufgrund erheblicher systemischer Nebenwirkungen begrenzt. Dipivefrin, ein in den 1970er Jahren entwickeltes Prodrug von Epinephrin, ermöglicht die Verwendung viel niedrigerer Konzentrationen der Ausgangssubstanz mit geringeren systemischen Wirkungen.6 Nichtselektive Adrenergika werden heute nur noch selten eingesetzt, außer in Fällen, in denen andere Medikamente kontraindiziert sind.
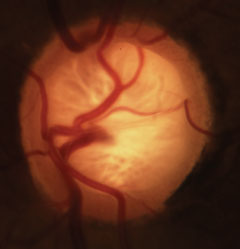
Glaukomatöse Schröpfung mit charakteristischem Verlust des neuroretinalen Randsaums, der Lamina und Veränderungen des Gefäßsystems. Zum Vergrößern Bild anklicken.
Beta-Blocker
Adrenerge Antagonisten oder Beta-(β)-Blocker hemmen die Kammerwasserproduktion und sind der Standard, mit dem neue Medikamente verglichen werden. Insbesondere reduzieren β-Blocker die Ultrafiltration, was die Verfügbarkeit von Kammerwassersubstrat für die Übertragung in die Hinterkammer einschränkt.1,7,8 Diese Medikamente können nicht-selektiv sein, d.h. sie hemmen beide Isoformen der β-adrenergen Rezeptoren (β1 und β2), oder kardioselektiv, die eine viel größere Affinität für den β1-Rezeptor haben. Da β2 der vorherrschende Adrenorezeptor des Auges ist, haben nicht-selektive Wirkstoffe einen größeren Einfluss auf die Kontrolle des Augeninnendrucks.9,10
Zu den topischen β-Blockern gehören Timolol, Levobunolol, Metipranolol, Carteolol und Betaxolol. Nur Betaxolol ist kardioselektiv, was es bei bestimmten Kontraindikationen hilfreich macht, aber es kann bei der Senkung des Augeninnendrucks weniger wirksam sein.11β-Blocker senken den Augeninnendruck um 20 bis 30 % und können zweimal täglich verabreicht werden. Sie können auch einmal täglich verabreicht werden, insbesondere bei der Verwendung von gelförmigen Lösungen aufgrund ihrer längeren Kontaktzeit mit dem Auge.12,13 Adrenerge Antagonisten haben während des Schlafs möglicherweise eine geringere Wirkung, so dass Vorsicht geboten ist, wenn β-Blocker kurz vor dem Schlafengehen verabreicht werden, insbesondere wenn sie einmal täglich verschrieben werden.14,15 Wenn Patienten systemische β-Blocker einnehmen, ist die augensenkende Wirkung topischer β-Blocker vermindert, und andere Klassen topischer Medikamente können in Betracht gezogen werden.16
Obwohl diese Medikamentenklasse bei pulmonalen oder kardialen Erkrankungen meist vermieden werden sollte, kann es in ausgewählten Fällen sinnvoll sein, eine Betablockertherapie in Betracht zu ziehen. Dies sollte jedoch nur mit Zustimmung des zuständigen Facharztes (Kardiologie oder Lungenfacharzt) geschehen.
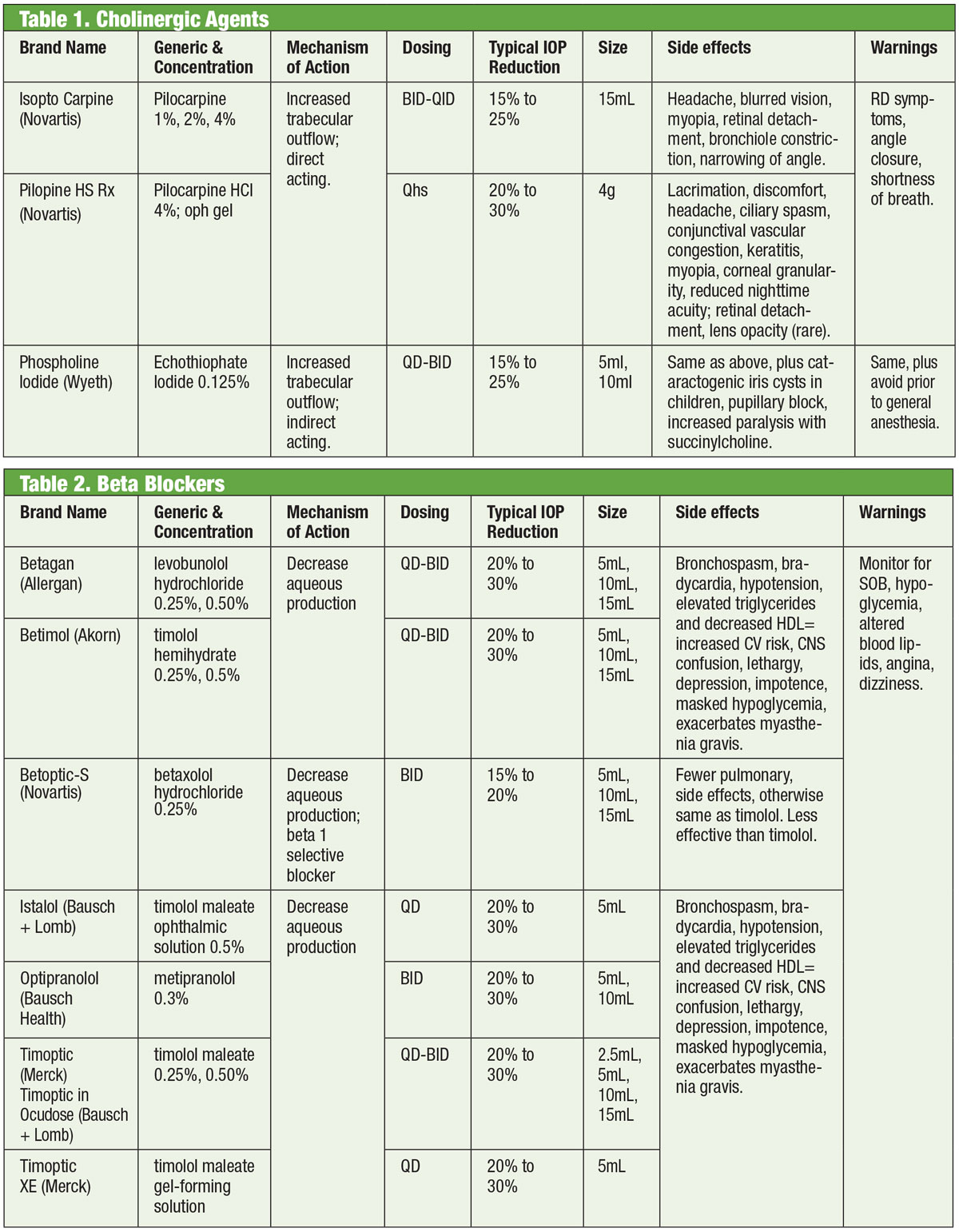
Tabellen: Bruce Onofrey, OD, RPh. Klicken Sie zum Vergrößern auf das Bild.
Generell sollte jedoch die Verwendung von β-Blockern bei Patienten mit atrioventrikulärem Block, Sinusbradykardie und obstruktiver Lungenerkrankung vermieden werden.17
Kohlensäureanhydrasehemmer
Forscher wissen seit den 1950er Jahren, dass orale Kohlensäureanhydrasehemmer (CAI) den Augeninnendruck senken können.18 Sie erreichen dies, indem sie die Produktion von Kammerwasser unterdrücken.18 Systemische Nebenwirkungen (wie Müdigkeit, gastrointestinale Störungen und Parästhesien) schränken jedoch ihre chronische Anwendung bei Glaukom ein.18 Orale CAIs werden immer noch in Fällen eingesetzt, in denen topische CAIs eine Überempfindlichkeit hervorrufen oder wenn die Verwendung von Tropfen ausgeschlossen ist, sowie in Fällen von akutem Winkelverschluss.18 Versuche, eine topische Variante zu formulieren, waren mit der Einführung von Dorzolamid Mitte der 1990er Jahre und bald darauf von Brinzolamid erfolgreich.19
Es gibt mindestens sieben verschiedene Isoenzyme der Kohlensäureanhydrase (CA), wobei CA-II in den Ziliarfortsätzen überwiegend an der Produktion des Kammerwassers beteiligt ist.18 Sowohl Dorzolamid als auch Brinzolamid sind potente Inhibitoren dieses Isoenzyms, weisen jedoch einige klinisch relevante Unterschiede auf. So hat Dorzolamid einen pH-Wert von 5,6, während Brinzolamid einen pH-Wert von 7,5 aufweist. Außerdem ist Brinzolamid als Suspension erhältlich. Dies sind nur einige der Eigenschaften, die für die individuellen Nebenwirkungen der Produkte verantwortlich sein können, zu denen im Falle von Dorzolamid Brennen und im Falle von Brinzolamid verschwommenes Sehen gehören können.19
Obwohl die Arzneimittel von der FDA für eine TID-Dosierung zugelassen sind, entscheiden sich einige Ärzte für eine BID-Verabreichung. Für Brinzolamid berichten Phase-III-Studien von klinisch gleichwertigen Augeninnendrucksenkungen mit BID- oder TID-Schemata.20 Andere berichten von keinen statistisch signifikanten Unterschieden zwischen BID- und TID-Dosierung bei Dorzolamid.18 Andere wiederum befürworten die TID-Dosierung für die Monotherapie und die BID-Dosierung, wenn sie als Zusatztherapie eingesetzt wird.21
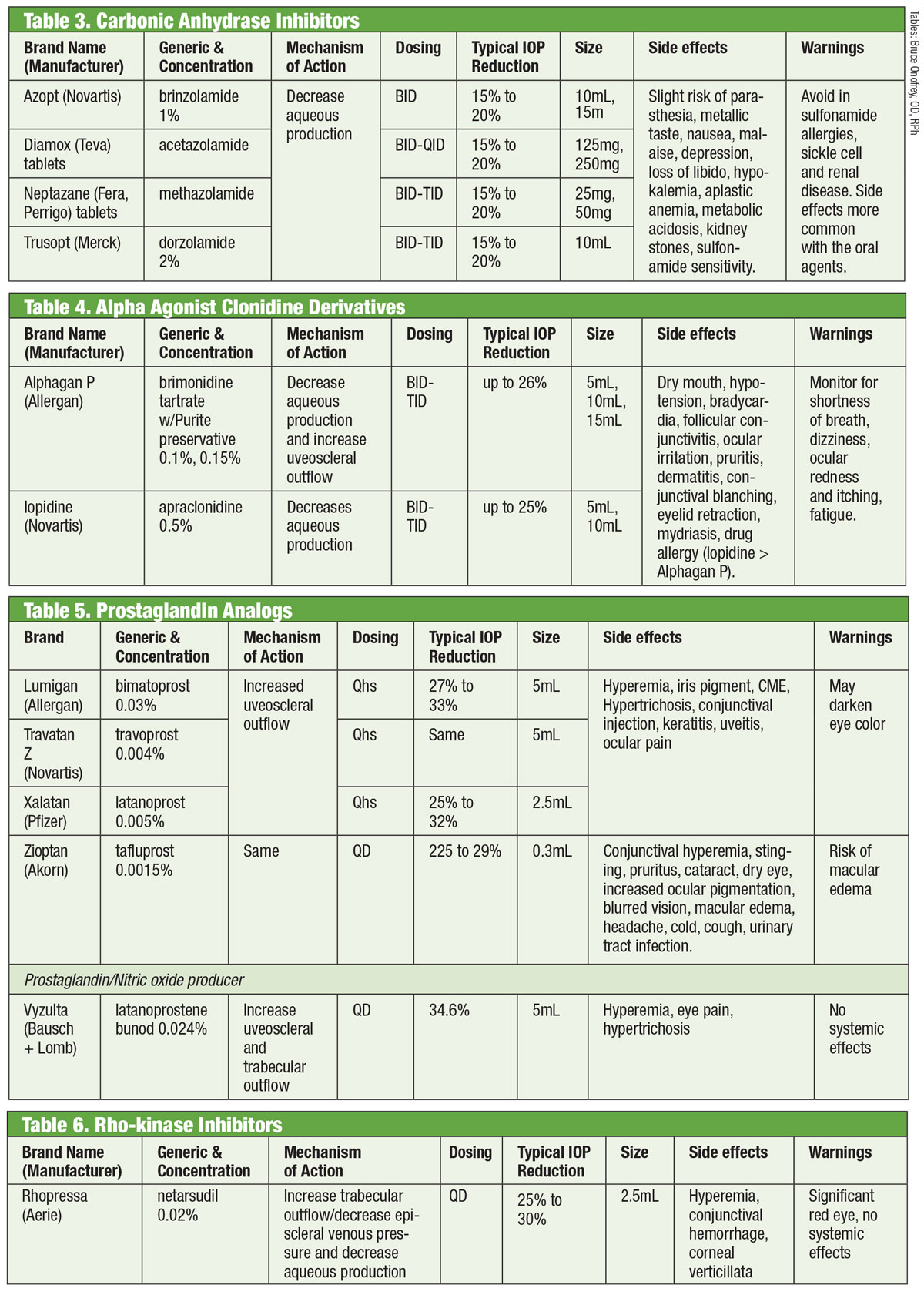
Tabellen: Bruce Onofrey, OD, RPh. Zum Vergrößern Bild anklicken.
Alpha-Agonisten
Clonidin war der erste Alpha-Agonist (AA), der zur Senkung des IOD wirksam war. Doch selbst in topischer Form verursachte es tiefgreifende systemische Nebenwirkungen wie Bradykardie, Sedierung und Hypotonie.22 Die Substitution von Apraclonidin durch eine Amidgruppe verringerte die Penetration der Blut-Hirn-Schranke und damit die Nebenwirkungen. Leider wird es aufgrund seiner im Laufe der Zeit abnehmenden Wirksamkeit und einer erhöhten Inzidenz von Augenallergien nur kurzfristig eingesetzt.
Das 1997 eingeführte Brimonidin ist ein starkes AA mit einer 32-mal höheren Selektivität für β2-Adrenorezeptoren als Apraclonidin.22 Es senkt den IOD durch einen doppelten Mechanismus, indem es die Produktion von Kammerwasser verringert und den uveoskleralen Abfluss erhöht.23 Wie sein Vorgänger hat es eine beachtliche Allergierate (bis zu 20 %), die bis zu acht Monate nach Beginn der Therapie auftreten kann.22 Es wurden drei Formulierungen entwickelt, die alle eine ähnliche Wirksamkeit aufweisen: 0,2 % mit Benzalkoniumchlorid (BAK) sowie 0,15 % und 0,1 % mit dem Konservierungsmittel Purite.24 Allergan hat die mit BAK konservierte Formulierung inzwischen eingestellt.
The Straight Dope
Medizinisches Marihuana hat in letzter Zeit dank einer Reihe von Gesetzesänderungen in den Vereinigten Staaten für Aufsehen gesorgt. Obwohl es seit den 1970er Jahren als Methode zur Senkung des Augeninnendrucks erforscht wird, haben Forscher festgestellt, dass es den Augeninnendruck nur für kurze Zeit senken kann. In Verbindung mit seinem recht hohen Nebenwirkungsprofil ist es daher ein schlechter Kandidat für eine Behandlung. Die Forschung sagt jedoch, dass es eine Rolle für „Glaukompatienten im Endstadium spielen könnte, bei denen die maximale medizinische Therapie und die Operation versagt haben oder die schlechte Kandidaten für eine Operation sind.“
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Auch wenn die Nebenwirkungen meist mit der Einnahme von Prostaglandinen korrelieren, gibt es in der Literatur Hinweise auf eine Brimonidin-induzierte anteriore Uveitis.25 Die Dauer reichte von sieben Tagen bis zu fünf Jahren mit einem Mittelwert von fast 20 Monaten.
Prostaglandinanaloga
Sie bewirken die stärkste IOD-Senkung von allen Tropfen, indem sie den uveoskleralen Kammerwasserabfluss verbessern. Prostaglandinanaloga (PGAs) binden an Rezeptoren im Ziliarkörper und bewirken eine Entspannung der glatten Muskulatur und verändern die extrazelluläre Matrix innerhalb des Ziliarmuskels, um den Kammerwasserabfluss über uveosklerale Wege zu erhöhen.26 Bei einmaliger Verabreichung pro Tag, in der Regel vor dem Schlafengehen, bewirken PGAs eine Senkung des Augeninnendrucks um 30 bis 35 %; zur Auswahl stehen Latanoprost, Bimatoprost, Travoprost und Tafluprost (als konservierungsmittelfreie Einzeldosis).26 Die häufigste Nebenwirkung von PGAs ist eine Bindehauthyperämie, häufig in den ersten Wochen nach Beginn der Therapie.26 Augenreizungen, Verschlimmerung bestehender entzündlicher Zustände (Makulaödem, Iritis), Atrophie der periorbitalen Fettpolster, Pigmentierung der periokularen Haut, der Wimpern und der Iris sowie Hypertrichose können ebenfalls auftreten.26
Eine neue Variante in der Kategorie der Prostaglandinanaloga ist Latanoprostenbunod 0,024%. Dieser Wirkstoff hat einen doppelten Mechanismus: Er erhöht den uveoskleralen Abfluss und verbessert den Abfluss aus dem Trabekelwerk durch die Wirkung von Stickstoffoxid.27 Das Auge baut Latanoprostenbunod zweimal ab, um die aktiven Komponenten Latanoprostsäure und Stickstoffoxid zu erhalten.28 Letzteres wirkt sich auf einen Signalweg aus, der die kontraktilen Komponenten im TM entspannt, was den Abfluss erhöht.28 Durch die zusätzliche Wirkung sinkt der IOD im Vergleich zu Latanoprost allein über mehrere Zeitpunkte um >1 mm Hg, wobei die gesamte IOD-Senkung zwischen 7,5 mm Hg und 9,1 mm Hg liegt. Die Nebenwirkungen von Latanoprostene Bunod waren mit denen von Latanoprost allein vergleichbar, mit möglicherweise weniger periokulärer Pigmentierung und Hypertrichose, so die Forscher.28,29
ROCK-Hemmer
In einem normalen Auge ist der Hauptabflussweg für Kammerwasser das TM. Bei Patienten mit Glaukom ist der Widerstand gegen den Abfluss des Kammerwassers durch diese Struktur erhöht, was zu einem Anstieg des Augeninnendrucks führt.30 Bis vor kurzem konnten Glaukom-Medikamente nicht auf diese Struktur einwirken. Das änderte sich 2017 mit der Einführung von Rhopressa (Netarsudil 0,02 %, Aerie), einem Rho-Kinase (ROCK)-Inhibitor.
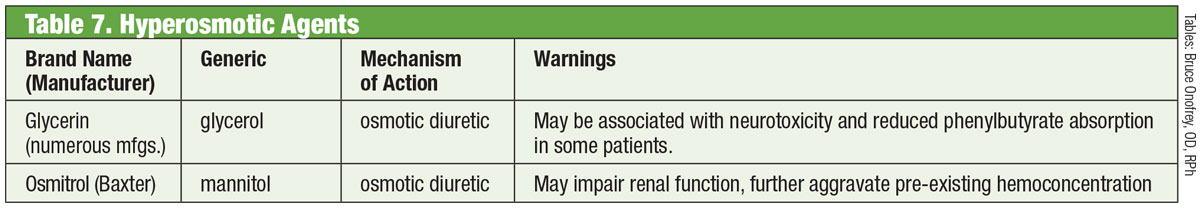
Tabelle: Bruce Onofrey, OD, RPh. Zum Vergrößern Bild anklicken.
Rho-Kinase wird in vielen Geweben exprimiert, auch im TM, wo sie den Aufbau von Aktin-Stressfasern fördert und die Zellkontraktion reguliert.31 ROCK-Inhibitoren erhöhen den Wasserabfluss, indem sie die Aktin- und Myosin-gesteuerte Zellkontraktion verringern und die Produktion von extrazellulären Matrixproteinen reduzieren.32 Rhopressa hemmt auch den Noradrenalin-Transporter (NET) und ist damit ein ROCK/NET-Inhibitor. Der NET-Mechanismus könnte das Ergebnis eines verringerten Blutflusses zum Ziliarkörper durch eine Noradrenalin-induzierte Vasokonstriktion sein, die zu einer verringerten Produktion von Kammerwasser führt.33 Darüber hinaus senkt Netarsudil auch den episkleralen Venendruck (EVP) und bietet somit mehrere Möglichkeiten zur Senkung des IOD.32 Die häufigste okuläre Nebenwirkung ist eine okuläre Hyperämie (etwa die Hälfte der behandelten Patienten), die in den meisten Fällen leicht und vorübergehend ist und sich selbst auflöst.32
Bemerkenswert ist, dass rho selbst eine wichtige Rolle beim Wachstum und der Führung von Axonen sowie bei der Regulierung des Überlebens und des Absterbens von Neuronen spielt.34 Forscher fanden heraus, dass nach einer Verletzung des Sehnervs die topische Anwendung von Netarsudil das Absterben retinaler Ganglienzellen reduziert und die axonale Regeneration fördert.34
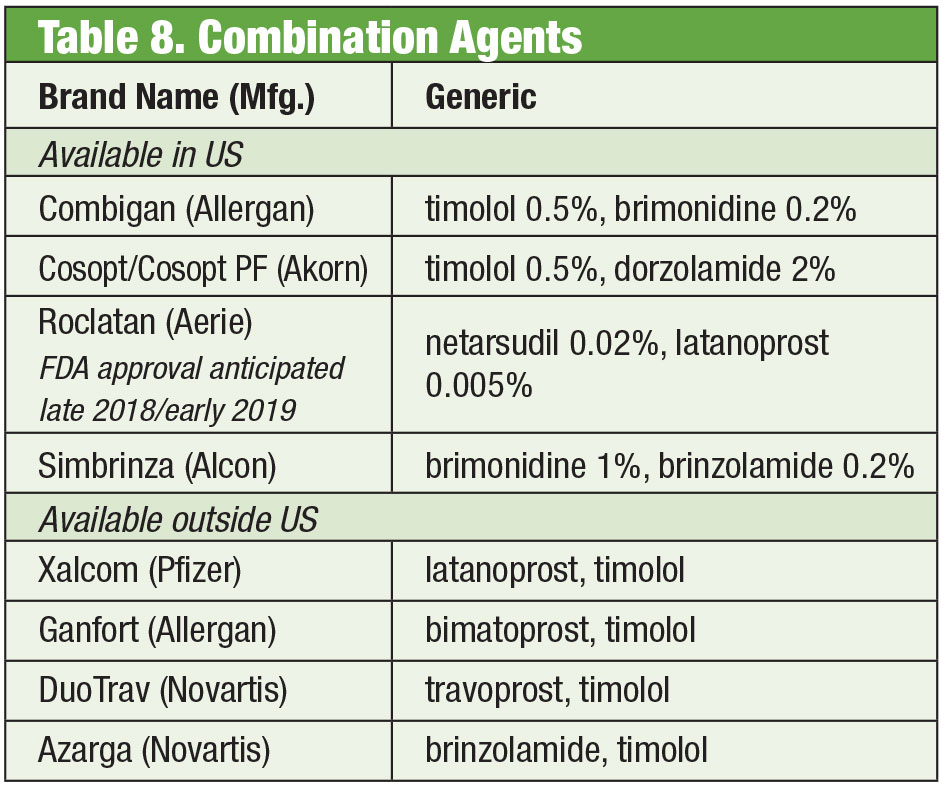
Mischung gefällig
Manchmal benötigen Patienten mehr als das, was die Standardprodukte bieten. Die Empfindlichkeit der Patienten oder die Toxizität der Augenoberfläche aufgrund der chronischen Verwendung von Konservierungsmitteln kann dazu führen, dass man nach Alternativen sucht. Einige Fertigarzneimittel sind ohne Konservierungsmittel erhältlich. Wenn die Compliance ein Problem ist, können diese Mischungen bis zu vier Medikamente in einer einzigen Flasche enthalten. Darüber hinaus wurden viele fixe Kombinationen außerhalb der Vereinigten Staaten erfolgreich eingesetzt, sind aber derzeit nicht von der FDA zugelassen; durch Compounding erhalten US-amerikanische Ärzte Zugang zu diesen Therapien. Wenn die Kosten eine Einschränkung darstellen, könnte das Compoundieren einen zusätzlichen Vorteil darstellen. Auch wenn das zusammengesetzte Produkt oft nicht von der Versicherung des Patienten übernommen wird, kann der Preis für ein oder zwei Kombinationspräparate kostengünstiger sein als der für mehrere Einzelpräparate, selbst wenn es sich um generische Formulierungen handelt. Zwei Compounding-Apotheken bieten mehrere voreingestellte Varianten an: Simple Drops von Imprimis Pharmaceuticals und die Omni-Produktlinie von Ocular Science. Auch hier sind zusätzliche Anpassungen möglich.
Auch wenn die einzelnen Wirkstoffe von der FDA zugelassen sind, sind bestimmte Kombinationen möglicherweise nicht zugelassen. Es ist Sache des Arztes, die Risiken und Vorteile der Einhaltung der Vorschriften abzuwägen.
Zusammengesetzte Glaukom-Produkte:
Simple Drops (Imprimis Pharmaceuticals)
Alle sind ohne Konservierungsmittel erhältlich.
– Tim-Lat PF (Timolol/Latanoprost)
– Brim-Dor PF (Brimonidin/Dorzolamid)
– Tim-Brim-Dor PF (Timolol/Brimonidin/Dorzolamid)
– Tim-Dor-Lat PF (Timolol/Dorzolamid/Latanoprost)
– Tim-.Brim-Dor-Lat PF (Timolol/Brinzolamid/Dorzolamid/Latanoprost)
– Dor-Tim (Dorzolamid/Timolol)
– Dorzolamid PF
– Latanoprost PF
Omni-Tropfen (Ocular Science)
Enthalten Benzalkoniumchlorid, aber in niedrigeren Konzentrationen (0.001%) als die üblichen generischen Formulierungen (0,002%).
– Timolol/Latanoprost
– Timolol/Brimonidin/Dorzolamid (AM-Formel)*
– Timolol/Brimonidin/Dorzolamid/Latanoprost (PM-Formel)*
* Zur gleichzeitigen Anwendung vorgesehen, wobei in der AM-Version das Prostaglandin fehlt, das üblicherweise nur einmal pro Tag verabreicht wird.
Fixe Kombinationspräparate
Trotz der Wirksamkeit dieser Einzelpräparate benötigen viele Glaukompatienten häufig mehrere Therapien, um ihren Zustand zu kontrollieren.35 Wenn eine duale Therapie erforderlich ist, kann es am besten sein, denselben Spender anzubieten, um die Compliance zu verbessern und die Auswirkungen der Toxizität auf die Augenoberfläche zu verringern.36 Timolol wird mit Brimonidin (als Combigan, Allergan) und Dorzolamid (als Cosopt, Akorn) kombiniert, die beide zweimal täglich verabreicht werden, wobei für das Timolol-Dorzolamid-Produkt eine konservierungsmittelfreie Variante erhältlich ist. Eine weitere zweimal täglich zu verabreichende Kombination – Simbrinza – kombiniert Brimonidin und Dorzolamid. Die Fixkombinationen zeigen eine gute Wirksamkeit sowohl als Primärtherapie als auch als Ergänzung zu PGAs. Die Nebenwirkungen sind mit denen der Einzelkomponenten vergleichbar.
Adhärenz/Patientenwahrnehmung
Auch wenn die Entscheidung, eine Behandlung zu empfehlen, komplex sein kann und von vielen Faktoren abhängt, müssen Arzt und Patient, sobald sie sich auf die Einleitung einer Therapie geeinigt haben, bestimmte Hintergrundfakten zur Kenntnis nehmen und sich an grundlegende Prinzipien halten.
Klicke auf das Bild, um es zu vergrößern.
Das Fortschreiten und der Schweregrad der Erkrankung sind mit einer schlechten Adhärenz verbunden.37 Patienten mit chronischen Erkrankungen verbrauchen im Durchschnitt 30 bis 70 % der ihnen verschriebenen Medikamentendosis, und 50 % setzen ihre Medikamente innerhalb der ersten Monate der Therapie ab, wie eine Studie ergab.38 Die Adhärenz bei Glaukom-Medikamenten ist ähnlich schlecht wie bei anderen chronischen Erkrankungen.38 Dementsprechend kann eine Lücke in der Wirksamkeit bestehen, die darin besteht, dass topische Medikamente zwar in großen klinischen Studien ihre Wirksamkeit bewiesen haben, in der Praxis jedoch aufgrund der mangelnden Compliance der Patienten unwirksam sein können.39
Hauptfaktoren, die zu einer schlechten Adhärenz beim Glaukom beitragen, sind unter anderem das Nebenwirkungsprofil der Medikamente, die Kosten der Therapie, die Patientenaufklärung und die Arzt-Patienten-Beziehung.40 Darüber hinaus kann die Krankheit bis zu einem späten Zeitpunkt asymptomatisch verlaufen, ohne dass man sich des Gesichtsfeldausfalls bewusst ist.41
Und nun zu etwas völlig anderem
Medikamente sind seit über einem Jahrhundert das Rückgrat der Glaukomtherapie, und die Entwicklung neuer Medikamente geht unvermindert weiter. Einige Forscher suchen jedoch nach Alternativen jenseits der Flasche. Eine Brille mit einer elektromagnetischen Spule in Verbindung mit einer Kontaktlinse, die eine Spur von Gold enthält, könnte eines Tages helfen, den Augeninnendruck zu senken. Die von einem Unternehmen namens Bionode entwickelte Kombination soll einen elektrischen Strom erzeugen, der durch die Ziliarmuskeln fließt, um den natürlichen Abflussweg zu stimulieren und den IOD zu senken.
American Academy of Ophthalmologie. Eyeglasses may one day treat glaucoma. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accessed July 3, 2018.
Ein zusätzliches Hindernis für die Adhärenz ist die Schwierigkeit, die Tropfen einzufüllen und den Dosierungsplan einzuhalten.42 Tatsächlich verunreinigen bis zu 80 % der Patienten ihre Tropfen, indem sie ihr Gesicht berühren, bis zu 61 % träufeln nicht genau einen Tropfen ein und, was am kritischsten ist, bis zu 37 % verfehlen das Auge mit den Tropfen.43 Der Arzt sollte niemals davon ausgehen, dass der Patient die Tropfeneinführung beherrscht. Bevor Sie mit der Tropfenbehandlung beginnen, sollten Sie dem Patienten beibringen, wie man die Tropfen richtig einträufelt, und ihn dazu bringen, die Instillation vor dem Verlassen der Praxis erfolgreich zu demonstrieren. Dies kann effizient an einen Augenoptiker delegiert und mit einem Informationsblatt über die Technik (druckbare PDF-Datei unter www.glaucoma.org/treatment/eyedrop-tips.php) sowie mit Videos wie dem der Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php) unterstützt werden.
Wenn der Patient erhebliche Schwierigkeiten beim Einträufeln der Augentropfen hat, kann eine mechanische Dosierhilfe die Erfolgsaussichten verbessern. Die Einhaltung des korrekten Dosierungsplans verbessert sich durch den Einsatz automatischer telekommunikationsgestützter Erinnerungshilfen, Smartphone- und Tablet-basierter Erinnerungs-Apps.44,45 Eine Kombination aus Aufklärung in der Praxis, Zielsetzung, vereinfachtem Tropfenschema und Technologie sollte zur Verbesserung der Therapietreue eingesetzt werden.46 Die Beseitigung bekannter Hindernisse für die Therapietreue ist ein erster notwendiger Schritt zum Erfolg.
Drucksenkung
Der Augeninnendruck ist der einzige bekannte modifizierbare Risikofaktor für Glaukom, und seine Senkung verringert nachweislich das Risiko eines Fortschreitens der Krankheit.47,48 Eine wirksame Senkung des Augeninnendrucks ist daher das Ziel der Behandlung von Glaukompatienten. Nachdem die Krankheit genau klassifiziert wurde, wird in der Regel ein Therapieziel festgelegt. In den Vereinigten Staaten wird in der Praxis bevorzugt ein IOD-Zielbereich festgelegt, von dem der Arzt glaubt, dass er das lebenslange Erblindungsrisiko des Patienten reduzieren und gleichzeitig die behandlungsbedingte Belastung minimieren kann.49-52
Obwohl es mehrere Methoden gibt, um einen anfänglichen Ziel-IOD zu bestimmen (Schwellen-IOD, berechneter IOD, Einheitsgröße), besteht die einfachste und evidenzbasierte Methode darin, den IOD um einen bestimmten Prozentsatz gegenüber dem täglichen Spitzen-IOD zu senken, bei dem eine Schädigung des Sehnervs auftritt. Der Augeninnendruck ist dynamisch und weist kurz- und langfristige Schwankungen auf, so dass die derzeit verfügbaren Tonometermethoden nicht perfekt reproduzierbar sind. Daher wird empfohlen, dass der Arzt vor Beginn der Behandlung mehrere IOD-Messungen zu verschiedenen Tageszeiten vornimmt, um zu versuchen, einen tageszeitlichen Spitzenwert des IOD zu ermitteln, der als Grundlage für den Zielbereich dienen kann.53-55 Es ist jedoch unwahrscheinlich, dass ein echter Spitzenwert ermittelt werden kann, wenn nicht mehrere 24-Stunden-IOD-Kurven gemessen werden. Letztendlich muss der Arzt den Behandlungserfolg an der Verringerung der Progressionsrate bei strukturellen und funktionellen Tests messen.48,56,57
Die empfohlene prozentuale Senkung des IOD liegt zwischen 20 % und 50 %, je nach Erkrankung (z. B., Glaukomverdacht, okuläre Hypertension, Normaldruckglaukom, Hochspannungsglaukom, Winkelverschlussglaukom), der Schwere der Grunderkrankung und der Lebenserwartung.58-61
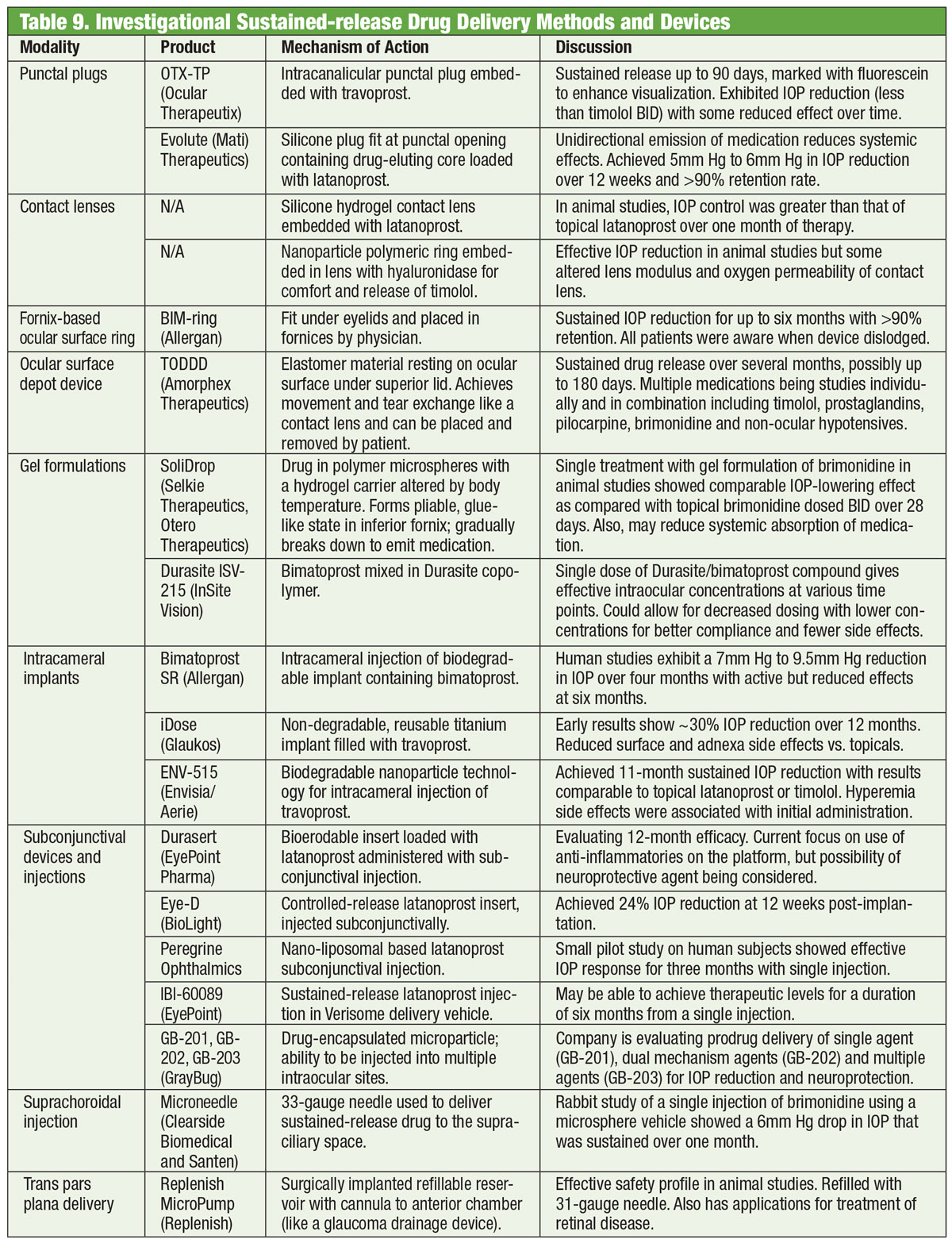
Tabelle: Bruce Onofrey, OD, RPh. Zum Vergrößern Bild anklicken.
Getting Started
PGAs sind in den Vereinigten Staaten für die Erstlinienbehandlung zugelassen und sind wirksamer bei der Senkung des Augeninnendrucks, haben ein relativ begrenztes Nebenwirkungsprofil und werden weniger häufig (einmal täglich) verabreicht als andere Medikamentenklassen.62,63
Wenn ein bestimmter Wirkstoff ausgewählt wurde, sollte der Patient in spätestens vier Wochen erneut untersucht werden, um die Wirksamkeit des Medikaments zu beurteilen, eventuellen Nebenwirkungen vorzubeugen, die Therapietreue des Patienten sicherzustellen und den Wert der Behandlung zu bestätigen.
Letztendlich werden eine angemessene Aufklärung und eine aufmerksame Nachsorge mit strukturellen und funktionellen Tests dazu beitragen, den Sehkraftverlust zu minimieren.
Dr. Dorkowski ist der klinische Koordinator für das Programm für Pflegeheime und betreutes Wohnen am SCO.
Dr. Williamson ist der Betreuer der Facharztausbildung am Memphis VA Medical Center.
Dr. Rixon ist Oberarzt am Memphis VA und Mitglied der Optometric Glaucoma Society.
Dr. Onofrey ist Autor von The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. Die beta-adrenergen Blocker und die Behandlung des Glaukoms. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direct effects of muscarinic agents on the outflow pathways in human eyes. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. The mechanism of action of adrenergic drugs in glaucoma. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl Epinephrin: ein neues Pro-Drug in der Behandlung des Glaukoms. Ophthalmologie. 1978;85(3):268-75.
7. Neufeld AH. Experimentelle Studien über den Wirkungsmechanismus von Timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Der Mechanismus von Timolol bei der Senkung des Augeninnendrucks: Am normalen Auge. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenerge Rezeptoren in pigmentierten Ziliarfortsätzen. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Verteilung und Eigenschaften von beta-adrenergen Rezeptoren im menschlichen Iris-Ziliarkörper. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Ein Doppelmasken-Vergleich von Betaxolol gegenüber Timolol bei der Behandlung des Offenwinkelglaukoms. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Ophthalmische Betablocker seit Timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Bewertung von Timolol bei chronischem Offenwinkelglaukom: Once a day vs. twice a day. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Auswirkungen von Timolol, Epinephrin und Acetazolamid auf den Kammerwasserfluss im Schlaf. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraocular pressure variation with beta-blockers. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Auswirkungen einer systemischen Betablockertherapie auf die Wirksamkeit und Sicherheit von topischem Brimonidin und Timolol. Brimonidine Study Groups 1 and 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukom und systemische Erkrankungen. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Pharmakologische und okuläre hypotensive Eigenschaften von topischen Karbonatanhydrasehemmern. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topical drug delivery to the eye: dorzolamide. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide ophthalmic suspension: a review of its pharmacology and use in the treatment of open angle glaucoma and ocular hypertension. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparison of the additive intraocular pressure-lowering effect of latanoprost and dorzolamide when added to timolol in patients with open-angle glaucoma or ocular hypertension: a randomized, open-label, multicenter study in Greece. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Inzidenz einer Brimonidin-Allergie bei Patienten, die zuvor auf Apraclonidin allergisch waren. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Wirksamkeit und Sicherheit von Brimonidin als Zusatztherapie für Patienten mit erhöhtem Augeninnendruck in einer großen, offenen Gemeinschaftsstudie. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidin-Purit 0,1% versus Brimonidin-Purit 0,15% zweimal täglich bei Glaukom oder okulärer Hypertension: eine 12-monatige randomisierte Studie. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidin induzierte anteriore Uveitis. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Update zum Wirkmechanismus von topischen Prostaglandinen zur Augeninnendrucksenkung. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Wirksamkeit von Latanoprostene Bunod 0,024% im Vergleich zu Timolol 0,5% bei der Senkung des Augeninnendrucks über 24 Stunden. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene Bunod ophthalmische Lösung 0,024% zur IOD-Senkung bei Glaukom und okulärer Hypertension. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Vergleich von Latanoprostene Bunod 0,024% und Timolol Maleat 0,5% bei Offenwinkelglaukom oder okulärer Hypertension: Die LUNAR-Studie. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. The trabecular meshwork: A basic review of form and function. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Accessed June 29, 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Two phase 3 clinical trials comparing the safety and efficacy of netarsudil to timolol in patients with elevated intraocular pressure: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 and ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Topical administration of a rock/net inhibitor promotes retinal ganglion cell survival and axon regeneration after optic nerve injury. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Adjunktive Therapiemuster bei Glaukompatienten mit Prostaglandinanaloga. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Fixed combinations. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Korrelieren Adhärenzraten und glaukomatöse Gesichtsfeldprogression? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. A view on glaucoma-Are we seeing it clearly? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence: A cross-sectional survey. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Tropfeninstillation und Glaukom. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: Die Studie zur automatischen Dosierungserinnerung. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Interesse von Patienten und ihren Betreuern an einer Smartphone- und Tablet-basierten Glaukom-Anwendung. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Attribute, die mit der Adhärenz zur medizinischen Glaukomtherapie assoziiert sind, und ihre Auswirkungen auf die Glaukom-Ergebnisse: Eine evidenzbasierte Überprüfung und mögliche Strategien zur Verbesserung der Therapietreue. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. New perspectives on target intraocular pressure. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalizing intraocular pressure: Target intraocular pressure in the setting of 24-hour intraocular pressure monitoring. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Target pressure in glaucoma therapy. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Care of the patient with open-angle glaucoma. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Frühe aggressive Augeninnendrucksenkung, Ziel-Augeninnendruck und ein neues Konzept für die Glaukombehandlung. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Diurnale Intraokulardruckmuster sind bei gesunden Personen kurzfristig nicht wiederholbar. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Day-to-day variability in intraocular pressure in glaucoma and ocular hypertension. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reduction of Intraocular Pressure and Glaucoma Progression: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Die fortgeschrittene Glaukom-Interventionsstudie (AGIS): Die Beziehung zwischen der Kontrolle des Augeninnendrucks und der Verschlechterung des Gesichtsfelds. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study. Der Einfluss der Behandlung und anderer Ausgangsfaktoren. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost in der Behandlung des Glaukoms. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impact of the introduction of generic latanoprost on glaucoma medication adherence. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0.005% in the treatment of ocular hypertension and open angle glaucoma: Die VOYAGER-Studie. Br J Ophthalmol. 2015;99(6):738-45.