Strukturelle Instabilität von Enzymen
Die Tatsache, dass die aktiven Stellen so gut geeignet sind, um bestimmte Umweltbedingungen zu schaffen, bedeutet auch, dass sie von der lokalen Umgebung beeinflusst werden können. Es stimmt, dass eine Erhöhung der Umgebungstemperatur im Allgemeinen die Reaktionsraten erhöht, ob enzymkatalysiert oder nicht. Eine Temperaturerhöhung oder -senkung außerhalb des optimalen Bereichs kann jedoch die chemischen Bindungen im aktiven Zentrum so beeinflussen, dass sie weniger gut für die Bindung von Substraten geeignet sind. Hohe Temperaturen führen schließlich dazu, dass Enzyme, wie auch andere biologische Moleküle, denaturieren, ein Prozess, der die natürlichen Eigenschaften einer Substanz verändert. Auch der pH-Wert der lokalen Umgebung kann die Funktion eines Enzyms beeinflussen. Die Aminosäurereste im aktiven Zentrum haben ihre eigenen sauren oder basischen Eigenschaften, die für die Katalyse optimal sind. Diese Reste reagieren empfindlich auf Änderungen des pH-Werts, die die Bindung von Substratmolekülen beeinträchtigen können. Enzyme funktionieren am besten innerhalb eines bestimmten pH-Bereichs, und wie bei der Temperatur können extreme pH-Werte (sauer oder basisch) in der Umgebung dazu führen, dass Enzyme denaturieren.
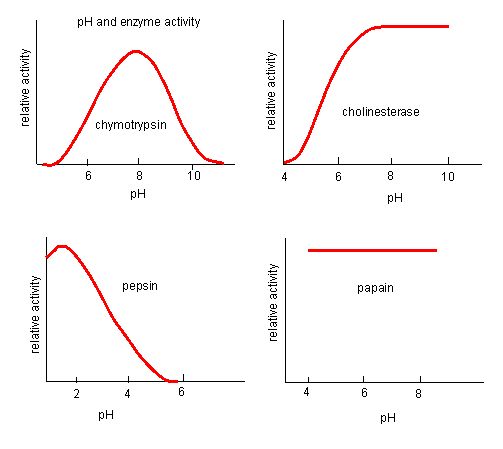
Abbildung 4. Enzyme haben einen optimalen pH-Wert. Der pH-Wert, bei dem das Enzym am aktivsten ist, ist der pH-Wert, bei dem die R-Gruppen des aktiven Zentrums protoniert/deprotoniert sind, so dass das Substrat in das aktive Zentrum eindringen kann und der erste Schritt der Reaktion beginnen kann. Einige Enzyme benötigen einen sehr niedrigen pH-Wert (sauer), um vollständig aktiv zu sein. Im menschlichen Körper befinden sich diese Enzyme höchstwahrscheinlich im unteren Teil des Magens oder in den Lysosomen (eine zelluläre Organelle, die zur Verdauung großer Verbindungen innerhalb der Zelle dient).
Quelle: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Der Prozess der Denaturierung von Enzymen beginnt in der Regel mit der Auflösung der Tertiärstruktur durch Destabilisierung der Bindungen, die die Tertiärstruktur zusammenhalten. Wasserstoffbrücken, Ionenbindungen und kovalente Bindungen (Disulfidbrücken und Peptidbindungen) können alle durch starke Temperatur- und pH-Änderungen gestört werden. Erstellen Sie anhand der unten stehenden Tabelle zur Enzymaktivität und Temperatur eine Energiegeschichte für das rote Enzym. Erkläre, was zwischen 37 °C und 95 °C passieren könnte.
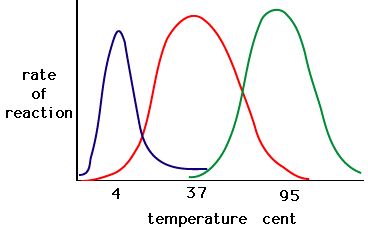
Abbildung 5. Enzyme haben eine optimale Temperatur. Die Temperatur, bei der das Enzym am aktivsten ist, ist in der Regel die Temperatur, bei der die Struktur des Enzyms stabil ist oder nicht beeinträchtigt wird. Einige Enzyme benötigen eine bestimmte Temperatur, um aktiv zu bleiben und nicht zu denaturieren. Quelle: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Anpassung und Enzymfunktion
Viele Jahre lang dachten die Wissenschaftler, dass die Bindung zwischen Enzym und Substrat in einer einfachen „Schlüssel-Schloss“-Methode erfolgt. Dieses Modell besagt, dass das Enzym und das Substrat in einem einzigen Schritt perfekt zusammenpassen. Die aktuelle Forschung unterstützt jedoch eine verfeinerte Sichtweise, die als induzierte Passung bezeichnet wird. Das Modell der induzierten Passung erweitert das Lock-and-Key-Modell, indem es eine dynamischere Interaktion zwischen Enzym und Substrat beschreibt. Wenn das Enzym und das Substrat zusammenkommen, bewirkt ihre Interaktion eine leichte Verschiebung in der Enzymstruktur, die eine produktivere Bindungsanordnung zwischen dem Enzym und dem Übergangszustand des Substrats bestätigt. Diese energetisch günstige Bindung maximiert die Fähigkeit des Enzyms, seine Reaktion zu katalysieren.
Wenn ein Enzym sein Substrat bindet, wird ein Enzym-Substrat-Komplex gebildet. Dieser Komplex senkt die Aktivierungsenergie der Reaktion und fördert ihren schnellen Ablauf auf verschiedene Weise. Grundsätzlich fördern Enzyme chemische Reaktionen, an denen mehr als ein Substrat beteiligt ist, indem sie die Substrate in einer optimalen Ausrichtung zusammenbringen. Der entsprechende Bereich (Atome und Bindungen) des einen Moleküls wird dem entsprechenden Bereich des anderen Moleküls, mit dem es reagieren muss, gegenübergestellt. Eine weitere Möglichkeit, wie Enzyme die Reaktion ihrer Substrate fördern, ist die Schaffung eines energetisch günstigen Umfelds innerhalb des aktiven Zentrums, in dem die Reaktion stattfinden kann. Bestimmte chemische Reaktionen können in einer leicht sauren oder unpolaren Umgebung am besten ablaufen. Die chemischen Eigenschaften, die sich aus der besonderen Anordnung der Aminosäurereste in einem aktiven Zentrum ergeben, schaffen ein energetisch günstiges Umfeld für die Reaktion der spezifischen Substrate eines Enzyms.
Die für viele Reaktionen erforderliche Aktivierungsenergie umfasst die Energie, die für die leichte Verformung chemischer Bindungen erforderlich ist, damit sie leichter reagieren können. Die enzymatische Wirkung kann diesen Prozess unterstützen. Der Enzym-Substrat-Komplex kann die Aktivierungsenergie senken, indem er die Substratmoleküle so verformt, dass das Aufbrechen von Bindungen erleichtert wird. Schließlich können Enzyme auch die Aktivierungsenergie senken, indem sie an der chemischen Reaktion selbst teilnehmen. Die Aminosäurereste können bestimmte Ionen oder chemische Gruppen bereitstellen, die tatsächlich kovalente Bindungen mit den Substratmolekülen eingehen, was ein notwendiger Schritt im Reaktionsprozess ist. In diesen Fällen ist es wichtig, daran zu denken, dass das Enzym nach Abschluss der Reaktion immer in seinen ursprünglichen Zustand zurückkehrt. Eine der charakteristischen Eigenschaften von Enzymen ist, dass sie durch die Reaktionen, die sie katalysieren, letztlich unverändert bleiben. Nachdem ein Enzym mit der Katalyse einer Reaktion fertig ist, setzt es sein(e) Produkt(e) frei.
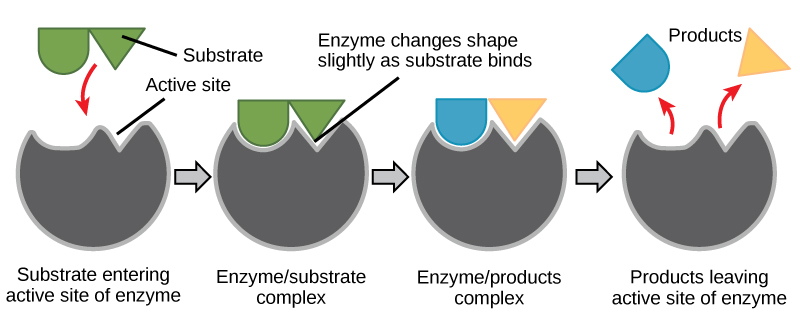
Abbildung 6. Nach dem Modell der induzierten Anpassung erfahren sowohl das Enzym als auch das Substrat bei der Bindung dynamische Konformationsänderungen. Das Enzym verformt das Substrat in seinen Übergangszustand und erhöht dadurch die Reaktionsgeschwindigkeit.
Erstelle eine Energiegeschichte für die obige Reaktion
Beantworte unter Verwendung von Abbildung 6 die in der Energiegeschichte gestellten Fragen.
1. Was sind die Reaktanten? Was sind die Produkte?
2. Welche Arbeit wurde durch das Enzym verrichtet?
3. In welchem Zustand befindet sich die Energie am Anfang? In welchen Zustand wird die Energie im Endzustand umgewandelt? Dies könnte noch knifflig sein, aber versuche herauszufinden, wo die Energie im Anfangszustand und im Endzustand ist.