Nachdem Sie die Existenz des Atomkerns nachgewiesen haben, können Sie nun die experimentellen Beweise für seine Größe betrachten, beginnend mit dem Rutherford-Experiment.
Zusammenfassung der Lektion
- Diskussion und Arbeitsbeispiel: Größe eines Atomkerns (15 Minuten)
- Diskussion: Atom- und Zellkerngröße (10 Minuten)
- Schülerfragen: Kräfte und engste Annäherung (30 Minuten)
- Diskussion: Ordnungszahl und Ladung eines Kerns (5 Minuten)
- Diskussion: Obere Grenze der Kerngröße (30 Minuten)
- Diskussion: Ein Rätsel für eine zukünftige Lektion (5 Minuten)
Diskussion und Arbeitsbeispiel: Größe des Atomkerns
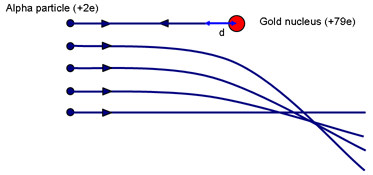
Man kann sich eine Vorstellung von der möglichen Größe des Atomkerns machen, wenn man an das Experiment von Rutherford denkt. Frage: Welcher Stoßparameter führt dazu, dass ein Teilchen dem Kern am nächsten kommt? (Ein Frontalzusammenstoß mit p = 0.)
Der Grundsatz der Energieerhaltung wird zur Berechnung der Entfernung der größten Annäherung als Maß für die Größe eines Kerns verwendet. Das Verständnis der folgenden Berechnung hängt davon ab, ob die Schüler das elektrische Potential und die Felder behandelt haben. Alternativ dient es als gute Wiederholung.
Episode 522-1: Alpha-Teilchenstreuung – Entfernung der größten Annäherung (Word, 29 KB)
Episode 522-2: Entfernung der größten Annäherung (Word, 107 KB)
Wenn das α kurzzeitig zur Ruhe gebracht wird (nachdem es so weit wie möglich den elektrostatischen Hügel hinaufgeklettert ist), wurde Arbeit gegen die abstoßende Kraft des Kerns geleistet. Die kinetische Energie des α wird in dem Feld um den Kern gespeichert. Wenn die Geschwindigkeit gleich Null ist, ist die gesamte Energie im Feld gespeichert.
Wenn das α in einem Abstand d vom (Zentrum) des Kerns der Ladung Ze vorübergehend stehen bleibt, ist die Energie im Feld:
Eα = 14πε0 2e Zed
Dies entspricht der ursprünglichen kinetischen Energie des α-Teilchens. Rutherford verwendete eine α-Quelle, die ihm von Madame Curie zur Verfügung gestellt wurde. Die α-Energie betrug ~ 7,7 MeV.
Für Gold ist Z = 79. Die Lösung ergibt d ~ 3 × 10-14 m. Vergleichen Sie dies mit dem Durchmesser von Goldatomen ~ 3 × 10-10 m. Ein Atomkern ist also mindestens 10 000 Mal kleiner als ein Atom. Es ist wichtig zu betonen, dass diese Berechnung eine Obergrenze für die Größe des Goldkerns angibt; wir können nicht sagen, dass das Alphateilchen den Kern berührt; ein energiereicheres α könnte noch näher herankommen.
Ein Atom ist größtenteils leer (weshalb die meisten Teilchen direkt hindurchgehen – irgendwelche Elektronen würden das relativ massive α mit hoher Geschwindigkeit kaum behindern).
Diskussion: Atom- und Kerngröße
Bitten Sie Ihre Schüler, ein maßstabsgetreues Modell des Atoms vorzuschlagen. Zum Beispiel: Wenn ein Kern einen Durchmesser von 1 mm hätte, wäre ein Atom 10 000 mal größer oder 10 m im Durchmesser. Wählen Sie eine geeignete Stelle für einen 1 mm großen Kern (ein kleines Kugellager oder eine Kugel aus Blu-tac). Gehen Sie 5 m (fünf große Schritte) bis zum Rand des Atoms, wo sich die Elektronen befinden. Hinweis: Lehrbuchdiagramme eines Atoms mit einem Kern sind nicht maßstabsgetreu gezeichnet.
Verstärken Sie ein genaues Bild, indem Sie einen Schüler als Kern aufstehen lassen, seinen Umfang schätzen (40 cm?) und fragen, wo ein anderer Schüler stehen müsste, um am Rand des Atoms zu sein. 104 × 40 cm = 4000 m}, also beträgt der Radius dieses Atoms 2 km! Überprüfe mit einer lokalen Karte, ob die Schüler einen Ort finden, der 2 km entfernt ist.
Weitere Verstärkung: In einem Festkörper, in dem die Atome dicht gepackt sind, entspricht der Abstand zwischen benachbarten Kernen ~ der Größe eines Atoms, d.h. zwei Schülern, die 4 km voneinander entfernt stehen!
So ist es ziemlich erstaunlich, dass überhaupt ein Kern getroffen wurde. Beide haben eine ähnliche Größe. Querschnittsfläche eines Kerns ~Radius2, also ~1 × 10-28 m2}.
Fragen Sie: Wie würden Sie erwarten, dass die Anzahl der reflektierten Strahlen von der Dicke der Metallfolie abhängt, die die Zielkerne enthält? (Stellen Sie sich die Goldatome in Schichten vor, die Chance einer Ablenkung nimmt mit der Dicke zu, aber die Absorption auf dem Weg in die oder zurück aus der immer dicker werdenden Folie wird schließlich verhindern, dass die Zahl der reflektierten und detektierten Strahlen weiter zunimmt.
Es ist sehr hilfreich, wenn Ihre Schüler sich an die folgenden Größenordnungen erinnern können:
Radius des Atomkerns ~ 10 -14m
Radius des Atoms ~ 10 -10m
Schülerfragen: Kräfte und dichteste Annäherung
Episode 522-3: Rutherford-Streuung: Richtungen der Kräfte (Word, 82 KB)
Folge 522-4: Rutherford-Streuung: Energie und dichteste Annäherung (Word, 83 KB)
Diskussion: Ordnungszahl und Ladung eines Kerns
Rutherford nutzte seine Daten, um die Ladung des Gold-Target-Kerns zu bestimmen. Weitere Experimente zur Bestimmung der Ladung von Cu-, Ag- und Pt-Folien ergaben:
| Atomzahl | Ein Streuexperiment | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
Die elektrische Ladung eines Kerns ist also durch die Ordnungszahl × e gegeben, d.h. Z e. Mit einer Ausnahme (Wasserstoff, H-1) ist Z immer kleiner als die Ordnungszahl. Woher kommt also die Differenz? Das Atom muss elektrisch neutral sein. Rutherford schlägt das Neutron vor.
Diskussion: Obere Grenze der Kerngröße
Erinnern Sie sich, dass Rutherfords Analyse eine obere Grenze für die Größe des Kerns angibt (d ~ 1 α Teilchenenergie). Die Größe, die man misst, hängt von der Energie des α-Teilchens ab, das man verwendet. Wir brauchen also einen anderen Ansatz, um die Größe eines Goldkerns zu bestimmen. Fällt Ihnen ein besseres Teilchen ein, um die Größe eines Kerns zu bestimmen? (Das Neutron – da es ungeladen ist, kommt es näher heran.)
Eine andere Technik ist die tiefe inelastische Streuung von Elektronen. Beziehen Sie sich darauf, wenn Sie bereits die Wellennatur von Teilchen (de Broglie-Wellen λ = hp) behandelt haben, oder fügen Sie dieses Thema hier ein, wenn Sie möchten. Das Elektronenbeugungsgerät hat eine grundlegende Ähnlichkeit mit einer Teilchenstreuung. Die Elektronen werden auf eine dünne Schicht – in diesem Fall aus Graphit – geschossen.
Rutherford hatte das Glück, dass die de Broglie-Wellenlänge der (ihm unbekannten) α-Teilchen recht klein war und die Coulomb-Abstoßung bei zu großer Nähe aufhört – sonst hätten Beugungseffekte die Daten verwirrt! (Versuchen Sie die Berechnung, wenn Sie λ = hp bereits behandelt haben.)
Folge 506-2: Interpretation von Elektronenbeugungsmustern (Word, 30 KB)
Folge 522-5: Tiefe inelastische Streuung (Word, 56 KB)
Episode 522-6: Elektronen messen die Größe von Atomkernen (Word, 42 KB)
Diskussion: Ein Rätsel für eine zukünftige Lektion
Es gibt ein grundlegendes Problem mit dem Rutherford-Modell. Fragen Sie Ihre Klasse: Wie kann ein Atom mit einem zentralen Kern stabil sein – warum kollabiert es nicht? Nach der klassischen Elektrodynamik müssten die Elektronen auf ihrer Umlaufbahn Strahlung aussenden und sich spiralförmig nach innen bewegen.
(Es ist gut, eine Klasse mit einem Rätsel für eine spätere Unterrichtsstunde zu verlassen.)