Einführung
Chronische Nierenerkrankungen (CKD) sind weltweit weit verbreitet. In China leidet fast 1 von 10 Menschen an einer Nierenfunktionsstörung, das sind insgesamt fast 150 Millionen Patienten (1). Anämie und sekundärer Hyperparathyreoidismus sind die beiden häufigsten Komplikationen im Zusammenhang mit CKD (2, 3). Tatsächlich wurde berichtet, dass fast 90 % der Patienten mit fortgeschrittener CKD (klassifiziert als Stadium 4 und 5) an Anämie leiden (4). Es hat sich gezeigt, dass das Auftreten und der Schweregrad der Anämie gut mit dem Rückgang der glomerulären Filtrationsrate korreliert (4). Eine frühzeitige Erkennung, Bewertung und Behandlung der Anämie kann die Morbidität und Mortalität von CKD-Patienten verringern und ihre Lebensqualität verbessern.
Der sekundäre Hyperparathyreoidismus ist durch erhöhte Serumspiegel des Parathormons (PTH) gekennzeichnet. Überschüssiges PTH kann die Erythropoese beeinträchtigen, indem es eine direkte toxische Wirkung auf erythroide Vorläuferzellen und eine indirekte Wirkung durch Induktion von Knochenmarkfibrose ausübt (5, 6). Darüber hinaus kann eine niedrige Hämoglobinkonzentration bei urämischen Patienten auf eine erhöhte osmotische Fragilität der Erythrozyten aufgrund einer hohen PTH-Konzentration zurückzuführen sein (7). Es wurde eine umgekehrte Korrelation zwischen PTH und Hämoglobinwerten festgestellt (8-10). Meytes et al. fanden heraus, dass PTH-Konzentrationen zwischen 7,5 und 30 U/mL, die mit den Serum-PTH-Spiegeln urämischer Patienten vergleichbar sind, eine signifikante Hemmung des Wachstums von Burst-bildenden Einheiten der Erythrozyten (BFU-E) in Knochenmarkskulturen von Mäusen bewirken, was auf einen möglichen Weg für die Beteiligung von überschüssigem PTH an der Entstehung der Anämie der Urämie hinweist (11).
Erythropoese-stimulierende Wirkstoffe (ESAs) sind zu einem Markenzeichen der Anämietherapie bei Patienten mit CKD geworden und sind das am häufigsten verschriebene Medikament bei Dialysepatienten, mit >95% Anwendung in China (1). Das erste rekombinante humane Erythropoietin, Epoetin-alfa, wurde 1988 in den Vereinigten Staaten zugelassen (12). Epoetin-alfa und Epoetin-beta sind kurzwirksame und kostengünstige Therapeutika und werden bei der Mehrzahl der CKD-Patienten ein- bis dreimal wöchentlich verabreicht. Die Dosierung erhöht sich jedoch mit einem verlängerten Dosierungsintervall, um einen Zielhämoglobinwert zu erreichen oder zu halten. Epiao® (3.000 μ/Röhrchen) ist eine Art von Epoetin-alfa, die in China weit verbreitet ist, während Recormon® (2.000 μ/Röhrchen) eine Art von Epoetin-beta ist, die eher in Europa verwendet wird, und in China seit etwa 4 Jahren eingesetzt wird.
Ergebnisse neuerer klinischer Studien haben gezeigt, dass Dosen, mit denen hohe Hämoglobin-Zielwerte erreicht werden, Bedenken hinsichtlich eines erhöhten Risikos von Todesfällen oder unerwünschten Wirkungen wie thromboembolischen Ereignissen und Schlaganfällen aufkommen lassen (13-16). Andrews et al. fanden heraus, dass eine erhöhte Dosishäufigkeit bei einer hohen Dosierung die Inzidenz thrombotischer Toxizitäten im Vergleich zu Tieren in niedrigeren Dosierungsgruppen erhöhte, obwohl der Hämatokrit in allen Gruppen ähnlich hoch war (17), was darauf hindeutet, dass ein hoher Hämatokrit nicht der einzige kausale Faktor ist, der zu ESA-bedingten Toxizitäten führt, sondern auch mit der Dosishöhe, Dosishäufigkeit und Dosierungsdauer zusammenhängt. Daher sollte ESA-bedingten Toxizitäten, die unabhängig von einem hohen Hämatokrit sind, besondere Aufmerksamkeit gewidmet werden.
Zurzeit liegen nur wenige Daten über den möglichen Zusammenhang zwischen der Dosis von ESAs und PTH bei urämischen Patienten vor, die eine regelmäßige Hämodialyse erhalten. Diese retrospektive Studie zielte darauf ab, den Zusammenhang zwischen der Dosis von ESAs und dem Intakt-PTH (iPTH)-Spiegel bei Hämodialysepatienten auf der Grundlage klinischer Daten in unserem Krankenhaus-Computerdatenbanksystem zu untersuchen.
Materialien und Methoden
Patienten und Verfahren
Diese retrospektive Kohortenstudie wurde von Februar 2015 bis Mai 2015 im Xiamen Zhongshan Hospital, Xiamen University, China durchgeführt. Die Studie schloss urämische Patienten ein, die seit mindestens 3 Monaten eine Hämodialyse erhielten und ESA zur Behandlung von Anämie einnahmen. Patienten, die die folgenden Kriterien erfüllten, wurden von der Studie ausgeschlossen: (1) Alter <18 Jahre; (2) Patienten mit aktiver Infektion, Malignität, Eisenmangelanämie (definiert als Ferritin <100 ng/ml und Sättigung <20%) oder aktiven Blutungen innerhalb von 3 Monaten; (3) Patienten mit unvollständigen Daten. Die in Frage kommenden Patienten wurden auf der Grundlage des verwendeten ESA in zwei Gruppen eingeteilt: Recormon-Gruppe und Epiao-Gruppe.
Datenerhebung
Die Daten stammen aus Jinshida, dem Computerdatenbanksystem des Xiamen Zhongshan-Krankenhauses, in dem die klinischen Daten von 376 Hämodialysepatienten erfasst wurden. Folgende Daten wurden erfasst: Alter, Geschlecht, Trockengewicht, Diagnose von Grunderkrankungen, Blut-Harnstoff-Stickstoff (BUN), Serum-Kreatinin (Scr), Hämoglobin, Kalzium, Phosphor, Albumin, iPTH, Serum-Ferritin, Transferrin-Sättigung und die Dosierung von ESAs. Diese Daten wurden morgens am Tag der Hämodialyse (vor der Dialyse) gemessen. In Übereinstimmung mit den KDIGO-Richtlinien (Kidney Disease Improving Global Outcomes) wurde ein normaler Hämoglobinwert bei urämischen Patienten mit kontinuierlicher Hämodialyse als Wert zwischen 110 und 130 g/L definiert (8). Als Referenzwerte für Serumkalzium und -phosphor wurden Werte zwischen 2,1-2,54 bzw. 1,1-1,78 mmol/L definiert (18). Die Patienten wurden außerdem anhand der iPTH-Werte klassifiziert: 150, 300, 600 und 1.500 pg/ml (19, 20).
Studienethik
Diese Studie wurde durch die Analyse retrospektiver Daten aus dem elektronischen Patientenaufzeichnungssystem unseres Krankenhauses durchgeführt. Das Studienprotokoll zur Forschung am Menschen wurde von der Ethikkommission des Zhongshan-Krankenhauses der Universität Xiamen genehmigt. Von allen Probanden wurde eine schriftliche Einverständniserklärung eingeholt.
Statistische Analyse
Die statistische Analyse wurde mit der Software SPSS für Windows Version 17.0 durchgeführt. Die Daten wurden als Prozentsätze oder Mittelwert ± Standardfehler des Mittelwerts (SEM) angegeben. Demografische Daten und Labormessungen zwischen den Gruppen wurden mit dem Chi-Quadrat-Test von Pearson, dem exakten Test von Fisher oder der Yate-Korrektur für Kontinuität verglichen. Ein P-Wert <0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Charakteristika von urämischen Patienten mit regelmäßiger Hämodialyse
In diese Studie wurden insgesamt 240 urämische Patienten mit regelmäßiger Hämodialyse aufgenommen. Die Ausgangscharakteristika der Patienten sind in Tabelle 1 dargestellt. Es gab keine signifikanten Unterschiede in Bezug auf Alter, Geschlecht, Trockengewicht, Grunderkrankungen, BUN, Scr, Hämoglobin, Serumphosphat, Kalzium, Albumin, Serumferritin und Transferrinsättigung zwischen der Recormon- und der Epiao-Gruppe (Tabelle 1, P > 0,05).

Tabelle 1. Ausgangscharakteristika der Patienten.
Der durchschnittliche Hämoglobinwert aller Probanden betrug 103,15 ± 1,07 g/L. Der Anteil der Patienten mit einem Hämoglobinwert zwischen 110 und 130 g/L lag bei 30,4 % (n = 84). Die Anämie wurde anhand des Hämoglobinspiegels in fünf Klassen eingeteilt, je nach Schweregrad der Anämie (21, 22): Hämoglobinspiegel <60 g/L (2,1%, n = 5), Hämoglobinspiegel ≥60 und <90 g/L (21,7%, n = 52), Hämoglobinspiegel ≥90 und <110 g/L (38.7%, n = 93), Hämoglobinspiegel ≥110 und <130 g/L (30,4%, n = 73), und Hämoglobinspiegel ≥130 g/L (7,1%, n = 17).
Beziehung zwischen dem Grad der Anämie und iPTH
Die Beziehung zwischen verschiedenen Graden der Anämie und iPTH wurde analysiert. Die Ergebnisse zeigten, dass der Hämoglobinwert negativ mit dem iPTH verbunden war (Abbildung 1A; Tabelle 2; P < 0,05). Es wurde jedoch kein signifikanter Zusammenhang zwischen Anämie und Serumkalzium- oder Phosphorspiegel gefunden (Abbildung 1B; Tabelle 2; P > 0,05 für beide).
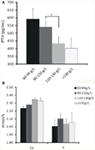
Abbildung 1. Die Beziehung zwischen Hämoglobinkonzentration und iPTH, Serumkalzium oder Phosphorspiegel. (A) Die Hämoglobinkonzentration stieg mit abnehmendem iPTH-Spiegel nach Stratifikation. (B) Es wurde kein signifikanter Zusammenhang zwischen der Hämoglobinkonzentration und dem Serumkalzium- oder -phosphorwert festgestellt. Die Daten wurden mittels t-Test berechnet. *P < 0,05.

Tabelle 2. Messungen der Serumkalzium-, Phosphor- und iPTH-Werte auf der Grundlage der Hämoglobinwerte nach Stratifikation.
Patienten mit 150-300 pg/mL iPTH hatten die höchsten Hämoglobin-, Serumferritin- und Transferrinsättigungswerte
Wenn der iPTH-Spiegel zwischen 150-300 pg/mL lag, wiesen die Hämodialysepatienten die höchsten durchschnittlichen Hämoglobin-, Serumferritin- und Transferrinsättigungswerte auf, die 106.25 g/L, 248,98 μg/L bzw. 30,97 % (Abbildung 2).
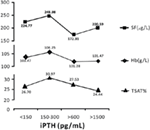
Abbildung 2. Patienten mit iPTH-Werten zwischen 150-300 pg/ml hatten die höchsten Hämoglobin-, Serumferritin- und Transferrinsättigungswerte. Die Daten sind in Prozent oder als Mittelwert ± SEM angegeben.
Vergleich von Recormon und Epiao bei der Behandlung von Anämie
Patienten, die mit Recormon und Epiao behandelt wurden, hatten ähnliche Hämoglobinwerte (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05; Abbildung 3A). Die Dosierung von Recormon (3.853,66 ± 225,13 μ/Woche, n = 98) zur Anämiebehandlung war jedoch signifikant geringer als die von Epiao (7.083,33 ± 264,93 μ/Woche, n = 142, P < 0,05; Abbildung 3B, Tabelle 1).
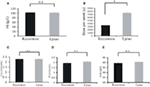
Abbildung 3. Vergleich von Recormon vs. Epiao bei der Behandlung von Anämie. (A) Die mit Recormon und Epiao behandelten Patienten hatten ähnliche Hämoglobinwerte (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05). (B) Die Dosierung von Recormon zur Anämiebehandlung war signifikant niedriger als die von Epiao, 3.853,66 ± 225,13 μ/Woche, n = 98 vs. 7.083,33 ± 264,93 μ/Woche, n = 142. (C-E) Es gab keine signifikanten Unterschiede bei den Kalzium- (C), Phosphor- (D) und Albuminwerten (E) zwischen der Recormon- und der Epiao-Gruppe. Die Daten wurden mittels t-Test berechnet; P > 0,05.
Die Serumspiegel von Kalzium, Phosphor und Albumin unterschieden sich nicht signifikant zwischen der Recormon- und der Epiao-Gruppe (jeweils 2.27 ± 0,47 vs. 2,29 ± 0,01 mmol/L, P > 0,05; 1,94 ± 0,10 vs. 2,06 ± 0,04 mmol/L, P > 0,05; 39,5 ± 0,44 vs. 40,2 ± 0.35 g/L, P > 0,05; Abbildungen 3C-E; Tabelle 1).
Die Beziehung zwischen den ESA-Dosen und den iPTH-Spiegeln
Für alle Hämodialysepatienten waren die iPTH-Spiegel in der Recormon-Gruppe niedriger als in der Epiao-Gruppe (336.66 ± 57,76 pg/ml, n = 98 vs. 531,05 ± 39,57 pg/ml, n = 142; P < 0,05; Abbildung 4A; Tabelle 1). Ein ähnlicher Trend wurde bei Hämodialysepatienten mit Hämoglobinwerten zwischen 110 und 130 g/L festgestellt (319,50 ± 74,9 pg/mL in der Recormon-Gruppe, n = 28 vs. 499,5 ± 64,38 pg/mL in der Epiao-Gruppe, n = 45; P < 0,05; Abbildung 4A).
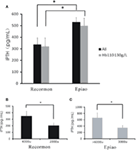
Abbildung 4. Der Zusammenhang zwischen der Dosis der ESAs und dem iPTH-Spiegel. (A) Der iPTH-Spiegel in den Gruppen Recormon und Epiao. (B) In der Recormon-Gruppe: iPTH-Spiegel bei Patienten, die mit Recormon in einer Dosierung von 2.000 bzw. 4.000 μ/Woche behandelt wurden. (C) In der Epiao-Gruppe: iPTH-Werte bei Patienten, die mit Epiao mit 3.000 und >6.000 μ/Woche behandelt wurden. Die Daten wurden mittels t-Test berechnet; *P < 0,05.
Bei den Patienten mit Hämoglobinwerten zwischen 110 und 130 g/L betrug der iPTH-Spiegel 201,54 ± 42.67 pg/mL (n = 10) bei Patienten, die mit Recormon bei 2.000 μ/Woche behandelt wurden, was signifikant niedriger war als bei Patienten, die mit Recormon bei 4.000 μ/Woche behandelt wurden (348,16 ± 117,9 pg/mL, n = 13; P < 0,05, Abbildung 4B). Ebenso war der durchschnittliche iPTH-Spiegel bei Patienten, die mit Epiao bei 3.000 μ/Woche behandelt wurden, signifikant niedriger als bei Patienten, die mit Epiao >6.000 μ/Woche behandelt wurden (347,15 ± 75,94 pg/mL, n = 12 vs. 661,01 ± 198,45 pg/mL, n = 27; P < 0,05, Abbildung 4C).
Diskussion
Diese retrospektive Studie ist die erste, die den Nachweis erbringt, dass höhere Dosen von ESAs (Epoetin-alfa und -beta) mit höheren iPTH-Spiegeln bei urämischen Patienten, die eine regelmäßige Hämodialyse erhalten, verbunden sein könnten. Darüber hinaus stellten wir fest, dass Patienten mit iPTH-Spiegeln zwischen 150-300 pg/ml die höchsten Hämoglobin-, Serumferritin- und Transferrinsättigungswerte aufwiesen, was mit den empfohlenen iPTH-Werten gemäß den KDIGO-Leitlinien (9) übereinstimmte.
Anämie ist eine der häufigsten Komplikationen von CKD. Die Weltgesundheitsorganisation hat Anämie als eine Hämoglobinkonzentration von weniger als 13,0 g/dl bei Männern und Frauen nach der Menopause oder eine Hämoglobinkonzentration von <12,0 g/dl bei anderen Frauen definiert. Der Einsatz von ESAs hat das Leben vieler anämischer Patienten mit CKD deutlich verbessert. Es hat sich jedoch gezeigt, dass hohe Dosen von ESAs bei Erwachsenen und Kindern mit CKD mit einem erhöhten Risiko für negative Folgen verbunden sind. Patienten, die mit hohen ESA-Dosen behandelt werden, haben ein um 1,2-1,5 erhöhtes Sterberisiko (23). In dieser Studie fanden wir einen signifikanten umgekehrten Zusammenhang zwischen iPTH-Spiegeln und Hämoglobinkonzentrationen bei Hämodialysepatienten, die mit ESAs behandelt wurden, was mit den Ergebnissen früherer Studien übereinstimmt (8-10).
In dieser Studie wiesen die Patienten in der Recormon- und der Epiao-Gruppe ähnliche Hämoglobinkonzentrationen auf; die für Recormon verwendete Dosierung war jedoch deutlich niedriger als die von Epiao. Wir stellten außerdem fest, dass der iPTH-Spiegel in der Recormon-Gruppe deutlich niedriger war als in der Epiao-Gruppe. Um den Zusammenhang zwischen der ESA-Dosis und dem iPTH-Spiegel weiter zu ermitteln, analysierten wir die klinischen Daten der mit Recormon oder Epiao behandelten Patienten getrennt. Der iPTH-Spiegel war bei Patienten, die mit Recormon mit 2.000 μ/Woche behandelt wurden, deutlich niedriger als bei Patienten, die mit Recormon mit 4.000 μ/Woche behandelt wurden. Ein ähnlicher Trend wurde bei Patienten festgestellt, die mit Epiao in einer Dosierung von 3.000 oder 6.000 μ/Woche behandelt wurden, was darauf hindeutet, dass hohe Dosen von ESAs mit hohen iPTH-Spiegeln zusammenhängen können. Diese Ergebnisse deuten darauf hin, dass ESA-Toxizitäten nicht allein durch einen hohen Hämatokritwert erklärt werden können. In Anbetracht der Tatsache, dass hohe ESA-Dosen mit hohen iPTH-Spiegeln bei Dialysepatienten in Verbindung gebracht werden können, sollten Patienten mit terminaler Niereninsuffizienz am besten durch eine Minimierung oder Zurückhaltung der ESA-Dosis behandelt werden, insbesondere bei Patienten mit kürzlichen kardiovaskulären oder zerebrovaskulären Ereignissen, hypertensiven Notfällen oder akuten thromboembolischen Ereignissen. In Anbetracht des erhöhten Risikos für kardiovaskuläre Ereignisse bei nahezu normalen Hämoglobinkonzentrationen und hohen Dosen von ESAs bei CKD wird in Taiwan nicht empfohlen, unverhältnismäßig hohe Dosen von ESAs zu verwenden, um einen Hämoglobinwert von 100-110 g/L zu erreichen (24).
Obwohl die Pathogenese der Anämie bei CKD multifaktoriell ist, ist der Mangel an Erythropoietin die Hauptursache für Anämie bei CKD-Patienten (25). Weitere Faktoren, die zur CKD-assoziierten Anämie beitragen, sind Eisenmangel, Entzündungsanämie, Unterdrückung der Erythropoese, Verkürzung der Überlebenszeit der roten Blutkörperchen durch urämische Toxine und Blutverluste wie gastrointestinale Blutungen. Da Eisenmangel ebenfalls eine häufige Ursache für Anämie ist, wurde die intravenöse Eisensupplementierung in Taiwan bereits 1996 gefördert. Auf der Grundlage der Erfahrungen mit der Behandlung von CKD-Anämie in Taiwan kann ein vernünftiges Hämoglobin-Ziel durch die Verwendung der niedrigstmöglichen ESA-Dosis und intravenöser Eisensupplementierung erreicht werden (24).
Unsere Studie hat mehrere Einschränkungen. Erstens handelt es sich bei dieser Beobachtungsstudie um eine Studie an einem einzigen Zentrum. Zweitens ist angesichts möglicher Verwechslungen und Selektionsverzerrungen je nach Indikation eine vorsichtige Interpretation dieser Daten erforderlich. In der Tat erfordern unsere Beobachtungen zum Zusammenhang zwischen iPTH und ESAs eine weitere Untersuchung durch prospektive Längsschnittstudien. Drittens überwiegt die Zahl der mit Epiao behandelten Patienten (142 für Epiao gegenüber 98 für Rocormon), was wahrscheinlich auf den relativ günstigen Preis von Epiao im Vergleich zu Recormon zurückzuführen ist (Tabelle 1). Viertens könnten pharmakologische Interventionen wie blutdrucksenkende Mittel zu vorübergehenden Schwankungen oder sogar Störungen der iPTH- oder Hämoglobinwerte geführt haben.
Zusammenfassend zeigt diese Studie, dass höhere Dosen von ESAs mit höheren iPTH-Werten bei urämischen Patienten, die eine regelmäßige Hämodialyse erhalten, verbunden sein könnten. Die Beteiligung höherer ESA-Dosen an der Pathogenese des sekundären Hyperparathyreoidismus ist nach wie vor unklar und erfordert möglicherweise weitere Untersuchungen. Unsere Ergebnisse deuten darauf hin, dass die Verwendung der niedrigstmöglichen ESA-Dosis potenzielle Risiken minimieren und gleichzeitig ein vernünftiges Hämoglobin-Ziel erreichen kann.
Beiträge der Autoren
Das Manuskript wurde von allen Autoren geprüft und genehmigt und wird nicht für eine Veröffentlichung an anderer Stelle in ähnlicher Form und in einer anderen Sprache in Betracht gezogen.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Finanzierung
Diese Forschung wurde durch den Medical Innovation Program Fund der Provinz Fujian (Nr. 2011027) unterstützt.
Abkürzungen
BUN, Blut-Harnstoff-Stickstoff; CKD, chronische Nierenerkrankung; ESA, Erythropoese-stimulierender Wirkstoff; Hb, Hämoglobin; iPTH, intaktes Parathormon; Scr, Serum-Kreatinin.
1. Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Martin KJ, Gonzalez EA. Metabolische Knochenerkrankung bei chronischer Nierenerkrankung. J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. The calcium-sensing receptor: a key factor in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Levin A, Thompson CR, Ethier J, Carlisle EJ, Tobe S, Mendelssohn D, et al. Anstieg des linksventrikulären Massenindexes bei früher Nierenerkrankung: Auswirkungen der Abnahme des Hämoglobins. Am J Kidney Dis (1999) 34:125-34. doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kwack C, Balakrishnan VS. Managing erythropoietin hyporesponsiveness. Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gallieni M, Corsi C, Brancaccio D. Hyperparathyreoidismus und Anämie bei Nierenversagen. Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Red blood cell osmotic fragility in chronically hemodialyzed patients. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Baradaran A, Nasri H. Intensivierung der Anämie durch sekundären Hyperparathyreoidismus bei Hämodialysepatienten. Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Sliem H, Tawfik G, Moustafa F, Zaki H. Beziehung zwischen assoziiertem sekundärem Hyperparathyreoidismus und Serum-Fibroblasten-Wachstumsfaktor-23 bei Nierenerkrankungen im Endstadium: eine Fall-Kontroll-Studie. Indian J Endocrinol Metab (2011) 15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Hyperparathyroidism, anaemia and erythropoietin: effects on systolic function of dialysis patients. Abstracts of 31 st Congress of European Renal Association/European dialysis ND Transplantation Association, September 5-8, 1999 Madrid. Nephrol Dial Transpl (1999) 14:190.
Google Scholar
11. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. Wirkung von Parathormon auf die Erythropoese. J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Eschbach JW, Abdulhadi MH, Browne JK, Delano BG, Downing MR, Egrie JC, et al. Recombinant human erythropoietin in anemic patients with end-stage renal disease. Ergebnisse einer multizentrischen klinischen Studie der Phase III. Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Singh AK. Sollten wir den Hämoglobinwert als brauchbares Ergebnismaß beibehalten? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15. Phrommintikul A, Haas SJ, Elsik M, Krum H. Mortality and target haemoglobin concentrations in anaemic patients with chronic kidney disease treated with erythropoietin: a meta-analysis. Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. Veränderungen bei der Dosierung von Erythropoese-stimulierenden Substanzen (ESA) und Hämoglobinwerten bei US-amerikanischen Patienten mit chronischen Nierenerkrankungen ohne Dialyse zwischen 2005 und 2009. Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. Hoher Hämatokrit nach Verabreichung von Erythropoese-stimulierenden Mitteln ist nicht vollständig prädiktiv für Mortalität oder Toxizität in präklinischen Spezies. Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO-Leitlinie für die klinische Praxis zur Diagnose, Bewertung, Vorbeugung und Behandlung von chronischen Nierenerkrankungen – Mineralien- und Knochenerkrankungen (CKD-MBD). Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19. Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Mortalitätsrisiko für Dialysepatienten mit unterschiedlichen Serumkalzium-, Phosphor- und PTH-Werten: die Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20. National Kidney Foundation. K/DOQI-Richtlinien für die klinische Praxis bei chronischer Nierenerkrankung: Bewertung, Klassifizierung und Stratifizierung. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO clinical practice guideline for anemia in chronic kidney disease. Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23. Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Treatment with high dose of erythropoiesis-stimulating agents and mortality: analysis with a sequential Cox approach and a marginal structural model. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. Management der Anämie bei Patienten mit chronischer Nierenerkrankung: Taiwanische Praxisrichtlinien. Nephrology (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. Klinische Wirksamkeit und Sicherheit von rekombinantem caninem Erythropoietin bei Hunden mit Anämie bei chronischem Nierenversagen und Hunden mit rekombinantem humanem Erythropoietin-induzierter Erythrozytenaplasie. J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar