Obwohl Dengue-Fieber früher eine periodisch auftretende Krankheit war, die in langen Abständen Epidemien verursachte, gilt sie heute als die wichtigste durch Mücken übertragene Viruserkrankung der Welt. Jährlich werden weltweit etwa fünfzig bis hundert Millionen Fälle von Dengue-Fieber registriert. Bei einer halben Million dieser Fälle tritt die schwerste Form des Dengue-Fiebers (DF) auf, das hämorrhagische Dengue-Fieber (DHF). DHF ist eine Krankheit, die vor allem Kinder unter 15 Jahren betrifft und durch plötzliches Fieber, Thrombozytopenie und ein vaskuläres Lecksyndrom gekennzeichnet ist. DHF entsteht durch eine Infektion mit dem Dengue-Virus, das zur Familie der Flaviviridae gehört. Bei dem Virus handelt es sich um eine ikosaedrische, umhüllte, einzelsträngige RNA mit positivem Sinn. Der Ikosaederkern hat einen Durchmesser von vierzig bis fünfzig Nanometern und enthält das C-Protein, das das virale Genom einkapselt. Zwei virale Proteine, M und E, aus denen die Lipidhülle besteht, umgeben den Kern. Die Infektion wird durch einen der vier Serotypen des Dengue-Virus (DENV) verursacht: DENV-1, DENV-2, DENV-3 und DENV-4. Eine Infektion mit einem der Serotypen verleiht keine Immunität gegen eine Infektion mit den anderen Serotypen.
Wenn jemand, der bereits infiziert war, erneut infiziert wird, besteht ein erhöhtes Risiko für die Entwicklung des Dengue-Schock-Syndroms (DSS) und der DHF, die zu einer Schwächung und Ruptur der Blutgefäße und zu inneren Blutungen führt. Nicht-neutralisierende Antikörper können die Aufnahme des Virus durch Zellen, die Fc-Rezeptoren exprimieren, verstärken und so eine Antikörper-abhängige Verstärkung der DHF ermöglichen. Verschiedene Arten von Aedesmücken sind Vektoren für das Dengue-Virus und übertragen das Virus durch Stiche in einen menschlichen Wirt. Aedes aegypti, eine kleine, schwarz-weiße, tropische und subtropische Mücke, die in Mittelamerika, Lateinamerika, Südostasien und im westlichen Pazifik vorkommt, ist der Hauptüberträger.
Epidemiologie
Heute gilt die DHF international als die bedeutendste durch Mücken übertragene Viruserkrankung. Sie ist in mehr als 100 Ländern weltweit endemisch, insbesondere in tropischen und subtropischen Regionen. In den Vereinigten Staaten ist die DHF verursachende Aedes aegyptispecies saisonal in Louisiana, Südflorida, New Mexico, Arizona, Texas, Georgia, Alabama, Mississippi, North und South Carolina, Kentucky, Oklahoma und Tennessee zu finden. In den letzten 50 Jahren hat sich das Auftreten von Dengue um das 30-fache erhöht .
Nach Angaben der Weltgesundheitsorganisation (WHO) schätzt man die Zahl der jährlichen Dengue-Fieber-Infektionen auf 50 bis 100 Millionen. Von diesen Fällen entwickeln sich 500.000 zu DHF und führen zu 22.000 Todesfällen, meist bei Kindern. Offiziellen Angaben der WHO zufolge gab es 2008 in Nord- und Südamerika, Südostasien und im westlichen Pazifik mehr als 1,2 Millionen Dengue-Fälle und 2013 über 3 Millionen. Im Jahr 2013 wurden allein in Nord-, Mittel- und Südamerika 2,35 Millionen Dengue-Fälle gemeldet, davon 37 687 Fälle von DHF . Nach der ersten bekannten DHF-Epidemie in den Jahren 1953 bis 1954 auf den Philippinen breitete sich die Krankheit weiter in ganz Südostasien aus.
Während der 1950er, 1960er und des größten Teils der 1970er Jahre traten Dengue-Epidemien in den meisten Teilen Süd- und Mittelamerikas nur selten auf, da der Hauptüberträger, die Stechmücke Aedes aegypti, ausgerottet war. Nach der Einstellung der Ausrottung begann Aedes aegypti jedoch, diese Regionen wieder zu bevölkern. Seit 1997 sind Aedes aegypti und das Dengue-Virus wieder weltweit verbreitet (Abbildungen 1 und 2). 2,5 Milliarden Menschen leben nach Angaben der WHO in Gebieten, in denen Dengue/DHF endemisch ist, und sind dem Risiko ausgesetzt, sich mit dem Dengue-Virus zu infizieren. Mehrere Faktoren tragen zur Übertragung des Virus durch Aedes aegypti bei, darunter Temperatur, Niederschläge, Land-Stadt-Migration, Bevölkerungswachstum, gestautes Wasser und die Zunahme fester Abfälle, die Larvenhabitate für den Vektor bieten. Es kann auch zu Ausbrüchen von reiseassoziiertem DHF kommen. Dengue-Fieber ist die weltweit am weitesten verbreitete Arbovirus-Infektion.
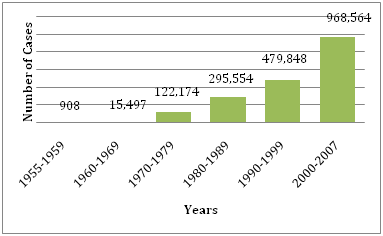
Abbildung 1: Durchschnittliche Anzahl der der WHO gemeldeten DF/DHF in den angegebenen Jahren.
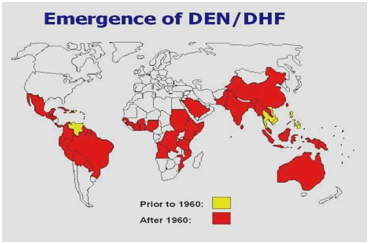
Abbildung 2: Verteilung von Dengue/Dengue-Hämorrhagisches Fieber in Nord- und Südamerika, der Karibik, Afrika und dem Nahen Osten.
Risikofaktoren für DF und die Übertragung des Dengue-Virus
Dengue-Fieber ist eine wichtige durch Arthropoden übertragene Viruserkrankung . Die Forschung zeigt, dass die Mücken der Gattung Aedes, vor allem Aedes aegypti und Aedes albopictus, sich an das Leben in der Nähe menschlicher Wohngebiete angepasst haben und für die Übertragung von Dengue-Fieber verantwortlich sind. Die Stechmücken ernähren sich tagsüber und bevorzugen den Menschen gegenüber anderen Tieren. Aedes aegyptii hat mit 76,9 % den höchsten Anteil an der menschlichen Blutmahlzeit, gefolgt von Aedes albopictus und Aedes vittatus mit 75 % bzw. 33,3 %. Das Auftreten von DF wurde mit der Menge der Vegetation, der Baumbedeckung, der Wohnqualität und der umgebenden Landfläche in Verbindung gebracht.
Neben den vom Menschen geschaffenen Brutstätten hat auch das Klima nachweislich Einfluss auf die Dengue-Ökologie, indem es die Vektordynamik, die Entwicklung der Erreger und die Interaktion zwischen Mücke und Mensch beeinflusst.13 Die Temperatur trägt dazu bei, die Entwicklungsraten der Vektoren, die Sterblichkeit und das Verhalten zu beeinflussen, und steuert die Virusreplikation innerhalb des Vektors. Ein warmes Klima ermöglicht die Larvenentwicklung und eine schnellere Virusreplikation, während ein kaltes Klima die Virusentwicklung verlangsamt und die Überlebenszeit der Mücken verkürzt, wodurch die Möglichkeit eines infektiösen Vektors und die Übertragung des Dengue-Fiebers verringert werden. Die Temperatur steht auch in Wechselwirkung mit den Niederschlägen als Hauptregulator der Verdunstung und wirkt sich somit direkt auf die Verfügbarkeit von Wasserhabitaten und indirekt auf die Bodenbedeckung und -nutzung aus, was das Wachstum von Vektorpopulationen fördern oder behindern kann.
Demografische und soziale Veränderungen wie Bevölkerungswachstum, Verstädterung und moderne Verkehrsmittel tragen in hohem Maße zur Zunahme der Inzidenz und der geografischen Ausbreitung von Dengue-Fieber bei. Wenn Reisende aus endemischen Gebieten wegziehen, dienen sie oft als Vehikel für die weitere Ausbreitung . Die Virulenz der Virusstämme und die genetische Variation des Dengue-Virus tragen ebenfalls zu einem größeren epidemischen Übertragungspotenzial der DHF bei.
Pathogenese des hämorrhagischen Dengue-Fiebers
Wenn sich die Mücke vom menschlichen Wirt ernährt, injiziert sie das Dengue-Virus (DENV) in die Blutbahn und die umgebende Epidermis und Dermis. Dies führt zur Infektion von unreifen Langerhans-Zellen und Keratinozyten durch rezeptorvermittelte Endozytose. Das E-Protein, das Oberflächenprotein, wird neu konfiguriert und ermöglicht die Membranfusion und die Freisetzung der viralen RNA in die infizierte Zelle. Die Nicht-Strukturproteine NS1 und NS2A steuern die virale RNA-Replikation, und NS1 ist möglicherweise auch an der Aktivierung der Komplementkaskade beteiligt. Die infizierten Zellen können dann durch Apoptose oder Nekrose absterben oder in die Lymphknoten wandern, wo Makrophagen rekrutiert werden (Abbildung 3). Eine Infektion mit einem der vier Dengue-Serotypen (DENV-1 bis DENV-4) kann in den meisten Fällen asymptomatisch verlaufen, da das Immunsystem des Wirts in der Lage ist, die Infektion lokal zu neutralisieren, sie kann aber auch ein Spektrum klinischer Symptome hervorrufen, wobei die schwerste Form die DHF ist, die zu DSS und Tod führen kann. DHF ist klinisch definiert als anhaltendes Fieber über 2 bis 7 Tage mit hämorrhagischen Manifestationen der Schleimhäute oder der Haut in Verbindung mit Thrombozytopenie (<100.000 Zellen/mm3) und einem Hämatokrit von mehr als 20% über dem Ausgangswert des Patienten oder der gleichaltrigen Bevölkerung. Die pathologischen Merkmale der DHF sind Plasmaaustritt aus dem Pleura- oder Peritonealraum und intrinsische Koagulopathie, die klinisch entweder durch einen positiven Tourniquet-Test oder durch Anzeichen spontaner Blutungen wie Petechien oder Ekchymosen, Zahnfleischbluten oder Epistaxis oder gastrointestinale Blutungen gemessen wird.

Abbildung 3: Nach dem Stich der Überträgermücke Aedes aegypti werden unreife Langerhanszellen und Keratinozyten mit DENV infiziert. Die infizierten Zellen wandern dann in die Lymphe, wo Makrophagen rekrutiert werden. Von hier aus verbreitet sich die Infektion in verschiedene Organe, darunter Leber, Milz und Knochenmark. Die Nekrose des Knochenmarks durch DENV kann zu einer Unterdrückung der Blutbildung und einer verminderten Thrombogenese im Blut führen. Die Entzündungsreaktion, die durch die Freisetzung von Chemokinen und Zytokinen aus Mastzellen, Makrophagen und Lymphozyten hervorgerufen wird, führt zu einer erhöhten Gefäßpermeabilität, einer Funktionsstörung der Blutplättchen sowie zu Thrombozytopenie und Plasmaaustritt. Obwohl der Mechanismus nicht gut verstanden ist, scheint diese Kaskade auch spontane Blutungen zu verursachen, die zu den klinischen Manifestationen von Petechien, Zahnfleischbluten und gastrointestinalen Blutungen führen.
Diese schwere Form der Krankheit ist oft das Ergebnis einer Sekundärinfektion, bei der der Wirt mit einem zweiten Serotyp infiziert wird und eine komplexe Interaktion zwischen dem Virus und der Immunreaktion des Wirts eintritt. Obwohl der Mechanismus, der diese Reaktion hervorruft, noch nicht genau bekannt ist, gibt es Hinweise darauf, dass eine frühere Infektion zu kreuzreaktiven Antikörpern führen kann, die den neuen Serotyp binden, ihn aber nicht neutralisieren können. Dies wird als Theorie des antikörperabhängigen Enhancements (ADE) bezeichnet. Es wird angenommen, dass Antikörper, die bei früheren Infektionen gegen DENV-Strukturproteine wie das E-Protein oder prM gebildet wurden, den neuen Erreger nicht neutralisieren können und stattdessen zu einer verstärkten Bindung an Fcγ-Rezeptor-positive Zellen führen, was die verstärkte Replikation des Virus ermöglicht. Als Reaktion darauf setzt das Immunsystem eine übertriebene Zytokinreaktion frei, die zu erhöhter Gefäßpermeabilität und Koagulopathie führt .
Mastzellen wurden ebenfalls in die Pathogenese der DHF einbezogen. In einigen Fällen scheinen Mastzellen eine schützende Funktion zu haben, indem sie durch Degranulation antivirale Moleküle freisetzen und andere Immunzellen wie T-Lymphozyten und natürliche Killerzellen (NK) rekrutieren, die alle dazu beitragen, das Virus zu neutralisieren. In anderen Fällen können die lokalen Kontrollmechanismen das Virus jedoch nicht eindämmen, und es wandert durch die Blutbahn oder das Lymphsystem, um Mastzellen in anderen Organen wie Leber, Milz und Lymphknoten zu aktivieren. Wenn es in diesen Organen zu einer Degranulation kommt, werden Proteasen freigesetzt und Entzündungsmediatoren wie Leukotriene und der vaskuläre endotheliale Wachstumsfaktor (VEGF) synthetisiert, was die Durchlässigkeit der Kapillaren erhöht und zum Austritt von Plasma führt. Dies ist wichtig, da verschiedene Gruppen von Mastzellen während des Degranulationsprozesses unterschiedliche Mediatoren freisetzen. Der Virus-Antikörper-Komplex, möglicherweise durch das NS1-Antigen des Dengue-Virus, und die Zytokinproduktion führen ebenfalls zur Komplementaktivierung. Es ist bekannt, dass die Freisetzung von C3a- und C5a-Fragmenten die Gefäßpermeabilität erhöht und somit zum Austritt von Plasma beiträgt.
Die Art und Menge der freigesetzten Zytokine spielt eine wichtige Rolle bei der Bestimmung des Schweregrads der Erkrankung. Das Makrophagen-Entzündungsprotein 1β (MIP-1β) scheint ein Indikator für eine weniger schwere Erkrankung zu sein, da es von infizierten mononukleären Zellen und aktivierten NK-Zellen freigesetzt wird. Es wirkt als chemischer Lockstoff für weitere NK-Zellen und lockt sie an den Entzündungsherd, wodurch die virale Replikation und die nachgeschaltete Zytokinwirkung eingeschränkt werden. Interferon γ (IFN-γ) hingegen induziert nachweislich eine Plasmaleckage und erhöht die Aufnahme von Dengue-Partikeln durch die Erhöhung der Fc-Rezeptoren auf den Zielzellen und wird daher mit schwereren klinischen Manifestationen und einer schlechten Prognose in Verbindung gebracht. Zu den anderen Zytokinen, die bei DHF erhöht sind und mit der Induktion von Plasmaleckagen in Verbindung gebracht werden, gehören Interleukin 2 (IL-2), Tumornekrosefaktor α (TNF- α), Makrophagen-Migrations-Inhibitionsfaktor (MIF), Monozyten-Chemo-Tactic-Protein-1 (MCP-1), Interleukin-8 (IL-8) und High Mobility Group Box-1 (HMGB-1). Die Auswirkungen der Zytokinfreisetzung beschränken sich nicht auf die Gefäßpermeabilität und den Plasmaaustritt, sondern sind auch an den hämorrhagischen Manifestationen der DHF beteiligt. Der zugrundeliegende Mechanismus, der Blutungen bei DHF verursacht, ist jedoch nur unzureichend bekannt. Obwohl die meisten infizierten Zellen durch Apoptose absterben, kommt es zu einer gewissen Nekrose, die zur Freisetzung von Toxinen führt, welche die Gerinnungs- und Fibrinolysesysteme aktivieren. Wenn im Knochenmark aufgrund einer hohen Viruslast ein hohes Maß an Nekrose auftritt, wird die Hämatopoese unterdrückt, was zu einer Thrombolytikpenie führt. Der daraus resultierende Rückgang der Thrombogenese und die Dysfunktion der Blutplättchen können zu einer Kapillarfragilität und den daraus resultierenden klinischen Manifestationen der DHF führen. Einige Studien deuten darauf hin, dass die Beteiligung der Leber bei einer DENV-Infektion mit der spontanen Blutungsneigung zusammenhängt, wobei eine Korrelation zwischen erhöhten Leberenzymwerten und einer erhöhten Blutungsneigung besteht .
Klinische Anzeichen und Symptome
Die klinische Manifestation der Krankheit umfasst eine asymptomatische Infektion, ein leichtes Dengue-Fieber (DF), ein hämorrhagisches Dengue-Fieber (DHF) oder ein Dengue-Schock-Syndrom (DSS), das aufgrund einer abnormen Kapillarpermeabilität und eines Plasmaaustritts oft schwerwiegend ist. Schweres Dengue-Fieber tritt in der Regel bei Patienten auf, die zuvor mit einem Dengue-Virus infiziert waren (d. h. Sekundärinfektion). Hohe Raten schwerer Dengue-Infektionen wurden auch bei Säuglingen mit primärer Dengue-Virusinfektion berichtet, die von Müttern geboren wurden, die zuvor mit einem Dengue-Virus infiziert waren.
Die Anfangsphase der DHF zeigt sich als Dengue-Fieber. Die Symptomatik dieser Anfangsphase hängt vom Alter des Patienten ab und umfasst ein plötzlich auftretendes hohes Fieber (manchmal mit zwei Spitzen auf dem Rücken), starke Kopfschmerzen, verminderten Appetit, schwere Myalgien und Arthralgien, einen makulopapulösen Hautausschlag, der drei bis vier Tage nach dem anfänglichen Fieberbeginn auftritt, retro-orbitale Schmerzen, Photophobie, Lymphadenopathie, leichte Blutungen (Epistaxis, Zahnfleischbluten, gastrointestinale Blutungen, Hämaturie und Menorrhagie) und einen positiven Tourniquet-Test. DHF-Fälle sind durch vier klinische Hauptmerkmale gekennzeichnet: hohes Fieber, hämorrhagische Erscheinungen und häufig auch Hepatomegalie und Kreislaufversagen. Die akute fieberhafte Erkrankung, die für die Anfangsphase charakteristisch ist, besteht aus Temperaturen von mehr als 39°C und bleibt 2-7 Tage lang bestehen.
Die oben genannten Symptome der Anfangsphase verschlimmern sich allmählich mit anhaltendem Fieber und Kopfschmerzen, starken Bauchschmerzen oder Druckempfindlichkeit, anhaltendem Erbrechen, Hämatemesis, Meläna, Petechien, leichten Blutergüssen, Unruhe, Lethargie, Schläfrigkeit, Reizbarkeit, Blutungen oder Blutergüssen unter der Haut. Nach 2-7 Tagen Fieber wird ein rascher Temperaturabfall oft von Anzeichen von Kreislaufstörungen unterschiedlichen Schweregrades begleitet. Der Patient kann schwitzen, unruhig sein, kühle Extremitäten haben und Veränderungen der Pulsfrequenz und des Blutdrucks zeigen. 24-48 Stunden nach dem Auftreten der DHF-spezifischen Merkmale werden eine abnorme Hämostase und ein Plasmaaustritt als charakteristische Symptome beobachtet.
Ein guter Indikator für dieses Fortschreiten ist eine Vergrößerung der Leber um mehr als 2 cm, da eine Hepatomegalie in der Regel dem Plasmaaustritt vorausgeht. Viele Patienten erholen sich mit oder ohne Flüssigkeits- und Elektrolytbehandlung. In schweren Fällen kann der Plasmaverlust zu Schock und Tod führen, wenn er nicht behandelt wird. Forschungsergebnisse deuten darauf hin, dass sowohl eine Sekundärinfektion mit Dengue-Fieber als auch die überschießende Reaktion des Zytokin-Immunsystems die Wahrscheinlichkeit erhöhen, dass ein Patient eine DHF entwickelt.
Man geht davon aus, dass virale Produkte wie das NS1-Glykoprotein die Komplementaktivierung und die Gefäßpermeabilität beeinflussen, was zu Plasmaleckagen führt, die sich zu Aszites oder Pleuraergüssen entwickeln. Die Zytokinreaktion ist auch für die Erhöhung der Gefäßpermeabilität verantwortlich, wodurch der intravaskuläre onkotische Druck sinkt und der Verlust von Flüssigkeit in die extravaskulären Kompartimente erleichtert wird (Abbildung 4). Die abnorme Hämostase besteht aus einer Thrombozytopenie bei gleichzeitigem Anstieg des Hämatokrits, einer verlängerten partiellen Thromboplastinzeit bei verminderter Fibrinogenkonzentration sowie den bereits erwähnten Petechien, schweren gastrointestinalen Blutungen, Ekchymosen und Epistaxis.
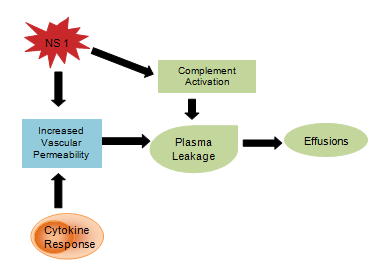
Abbildung 4: Zytokin-Immunsystemreaktion.
Während der febrilen viremischen Phase der DHF werden die Thrombozytopenie und die nachfolgenden Manifestationen vermutlich durch die Knochenmarksuppression verursacht. Wie bereits erwähnt, ist die Suppression des Knochenmarks darauf zurückzuführen, dass es ein Replikationsort für das Virus ist und speziell hämatopoetische Vorläuferzellen angreift. Eine immunvermittelte Zerstörung der Thrombozyten wurde jedoch auch durch die Entdeckung von Virus-Antikörper-Komplexen auf der Oberfläche von Thrombozyten von DHF-Patienten nahegelegt.
Ungewöhnliche klinische Manifestationen sind akute Hepatitis, Leberversagen, akutes Nierenversagen, Enzephalopathie oder Kardiomyopathie (akute Myokarditis) . Eine Studie über tödliche DHF bei Erwachsenen untersuchte andere Todesursachen als das Dengue-Schock-Syndrom (DSS) bei Patienten mit schwerem Dengue-Fieber und kam zu dem Schluss, dass Hypothermie, Leukozytose und Bandämie Anzeichen für schweres Dengue-Fieber sein könnten. Die Studie rät Klinikern außerdem, auf die mögliche Entwicklung massiver gastrointestinaler Blutungen zu achten, insbesondere bei Patienten mit frühen Bewusstseinsstörungen, ausgeprägter Thrombozytopenie, verlängertem PT und/oder Leukozytose.
Diagnose, Behandlung und Management
Eine frühzeitige und genaue Diagnose ist entscheidend für eine angemessene klinische Versorgung. Es gibt viele Methoden, mit denen die Diagnose von Dengue gestellt werden kann. Die Diagnose kann durch die Isolierung des Virus, der viralen Nukleinsäure, von Antikörpern und Antigenen oder durch eine Kombination all dieser Verfahren erfolgen. Der Nachweis des Dengue-Virus durch eine Kultur ist der endgültige Diagnosetest, doch ist seine Anwendung aus praktischen Gründen begrenzt. Der Nachweis viraler RNA ist schneller, doch kann eine Kontamination zu falsch positiven Ergebnissen führen. Auch der serologische Test kann aufgrund kreuzreaktiver Antikörper ein falsch positives Ergebnis liefern.
Akute Infektionen werden in Serum, Plasma und zirkulierenden Blutzellen während der frühen Rekonvaleszenzphase nachgewiesen, d. h. in den ersten 5-8 Tagen nach Auftreten der Symptome. Zu diesem Zeitpunkt kann die primäre Viruslast bis zu 103 RNA-Partikel/ml oder bei Sekundärinfektionen mehr als 106 RNA-Partikel/ml betragen. Gegenwärtig werden die Kombination von NS1-Antigen- und Antikörpertests sowie molekulare Methoden wie die reverse Transkriptions-Polymerase-Kettenreaktion (RT-PCR) in Echtzeit immer häufiger zur Diagnose eingesetzt, da sie schnellere Ergebnisse liefern und empfindlicher sind. Auch immunhistochemische Analysen und Immunfluoreszenz bestätigen das Vorhandensein des Virus durch virale Antigene. IgM-Antikörper sind die ersten, die innerhalb der ersten 3-5 Tage nach der Infektion auftreten.
Sie erreichen 2 Wochen nach Auftreten der Symptome ihren Höchststand und sinken dann im Allgemeinen auf nicht mehr nachweisbare Werte nach 30-60 Tagen. IgG-Antikörper, die stärker kreuzreaktiv sind, werden nach den ersten 7-9 Tagen nach Auftreten der Symptome in geringen Mengen nachgewiesen, steigen langsam auf das bis zu Vierfache an und sind noch nach mehreren Monaten und möglicherweise sogar lebenslang nachweisbar. Die menschliche Antigen- und Antikörperreaktion hängt vom Immunstatus des Wirtes ab und ist nur während der Primär- oder Sekundärinfektion vorhanden. Es gibt keine spezifischen Behandlungen oder antiviralen Medikamente für Dengue. Die Pathophysiologie des Denguefiebers erhöht die Gefäßpermeabilität, was zu einem erheblichen Verlust von Plasma aus dem intravaskulären Kompartiment in den extravaskulären Raum führt.
Dieser Flüssigkeitsverlust kann zu einem Schock führen und führt ohne entsprechende Korrektur zu Hypoxie, metabolischer Azidose und schließlich zum Tod. Daher erfordert das primäre Management eine stationäre unterstützende Behandlung mit Flüssigkeits- und Elektrolytausgleich. Das gepackte Zellvolumen sollte stündlich alle 4-6 Stunden überwacht werden. Ein signifikanter Plasmaverlust ist definiert als ein >20%iger Anstieg des gepackten Zellvolumens oder des Hämatokrits. Sobald ein Patient diese Werte erreicht, ist ein schneller und aggressiver Volumenersatz erforderlich.
Die Infusionsflüssigkeitsersatzrate ist abhängig vom gepackten Zellvolumen und der Urinausscheidung. Es gibt mehrere Flüssigkeiten, die für den Ersatz von Plasmaverlusten verwendet werden, darunter physiologische Kochsalzlösung, Ringer-Laktat oder Ringer-Acetat, verdünnte 5%ige Glukoselösung, Plasma oder Plasmaersatzstoffe wie Dextrin 40 und frisches Vollblut. Zusätzlich zur intravenösen Flüssigkeitszufuhr können Elektrolyte oral zugeführt werden, um den fieberbedingten Durst und die Dehydrierung zu lindern. Unterstützende Analgetika wie Paracetamol können zur Behandlung von Fieber und anderen Symptomen eingesetzt werden. NSAIDs und Aspirin sollten vermieden werden, da sie das Reye-Syndrom auslösen können.
Nach der Genesung der DHF müssen die Patienten vor der Entlassung aus dem Krankenhaus folgende Kriterien erfüllen: sichtbare klinische Besserung, fieberfrei ohne Verwendung von fiebersenkenden Mitteln für >24 Stunden, gesteigerter Appetit, stabiler Hämatokrit, angemessene Urinausscheidung, drei Tage nach der Genesung von der schweren metabolischen Azidose, Thrombozytenzahl >50.000/mm3 und keine Atemnot durch Pleuraerguss oder Aszites .
Prävention und Ausrottung von Aedes aegypti
Aedes aegypti, der am weitesten verbreitete Vektor des Dengue-Virus, ist das Hauptziel der Überwachungs- und Kontrollmaßnahmen. Andere Vektoren, wie z. B. Aedes albopictus, können Dengue-Fieber übertragen, aber Überwachungs- und Bekämpfungsmaßnahmen für andere Vektoren sollten nur dann in Betracht gezogen werden, wenn es verlässliche Beweise dafür gibt, dass diese Vektoren eine epidemiologisch bedeutende Rolle bei der Übertragung von Dengue-Infektionen spielen. Die erste Initiative zur Eliminierung von Aedes aegypti wurde 1901 in Kuba ergriffen. Die Ausräucherung und die Beseitigung der Mückenherde durch Zerstörung verlassener Behälter waren die ersten Schritte zur Ausrottung des Vektors. Nach Gelbfieberausbrüchen in Brasilien in den Jahren 1928 und 1932 wurde deutlich, dass der vollständige Schutz der städtischen Bevölkerung von der absoluten Ausrottung der Aedes aegyptimoskito abhängt; dies führte dazu, dass die Panamerikanische Gesundheitsorganisation (PAHO) 1947 den kontinentalen Aedes aegyptieradikationsplan zur Bekämpfung des städtischen Gelbfiebers verabschiedete. Seit 1947 förderte das Pan American Sanitary Bureau (PASB) intensiv Kampagnen in allen betroffenen Ländern, und der Erfolg zeigte sich 1962, als 18 Länder des Kontinents und eine Reihe karibischer Inseln die Ausrottung erreicht hatten. Als Ergebnis dieser Bemühungen ist der amerikanische DENV-2-Genotyp V das einzige Dengue-Virus, das heute noch existiert.
Trotz der Bemühungen, den Vektor auszurotten, konnte Aedes aegypti in Kuba, den Vereinigten Staaten, Venezuela und mehreren karibischen Ländern nicht ausgerottet werden. Die jahrzehntelangen, beispiellosen Bemühungen der Menschen, Aedes aegypti auszurotten, liefen sehr schnell ins Leere und führten zu einer raschen Ausbreitung. Mangelnde Überwachung und Verschlechterung der Struktur des Ausrottungsprogramms, unzureichende Umwelthygiene und unzureichende Beteiligung der Bevölkerung waren einige der Faktoren, die zum Rückgang der Bemühungen um die Ausrottung des Vektors führten. Bis heute gibt es keinen Impfstoff, der Dengue-Infektionen verhindern könnte. Takeda Vaccines Inc. entwickelt einen abgeschwächten Lebendimpfstoffkandidaten, den so genannten tetravalenten Dengue-Impfstoff (TDV), der aus einem abgeschwächten DENV-2-Stamm (TDV-2) und drei chimären Viren besteht, die die prM- und E-Protein-Gene von DENV-1, -3 und -4 enthalten, die im Kontext des abgeschwächten TDV-2-Genomgerüsts exprimiert wurden (TDV-1, TDV-3 bzw. TDV-4). Der Impfstoff hat sich in einer klinischen Phase-2-Studie in Dengue-endemischen Ländern bei Erwachsenen und Kindern als gut verträglich und immunogen erwiesen.
Der Impfstoff befindet sich in der Phase 3 der Entwicklung. Darüber hinaus hat Sanofi Pasteur einen rekombinanten, abgeschwächten, tetravalenten Dengue-Impfstoff (CYD-TDV) entwickelt, der bei ≥9-jährigen Personen in endemischen Ländern konsistente Sicherheit und Wirksamkeit zeigte; er befindet sich in der späten Entwicklungsphase . Dengvaxia (CYD-TDV) von Sanofi Pasteur wurde erstmals im Dezember 2015 in Mexiko zugelassen und wurde in klinischen Phase-III-Studien als 3-Dosis-Serie nach einem 0/6/12-Monats-Schema untersucht. Derzeit werden etwa fünf weitere Impfstoffkandidaten in klinischen Studien geprüft. Reisende in Dengue-endemische Gebiete sind dem Risiko ausgesetzt, sich mit Dengue anzustecken; daher sollten sie zur Vorbeugung ermutigt werden, Unterkünfte mit gut abgeschirmten Fenstern und Türen zu wählen, Insektenschutzmittel zu verwenden, angemessene Kleidung zu tragen und jegliches stehendes Wasser zu entleeren und abzudecken, das möglicherweise zu Moskito-Brutstätten werden kann .
Aktuelle globale Situation
Zurzeit wird erwartet, dass die Häufigkeit von Dengue-Fieber aufgrund vieler Faktoren wie sozioökonomischer Status, kontinuierlicher Klimawandel, Reisen und Globalisierung weiter zunehmen wird. Impfstoffe befinden sich noch in der Entwicklung, und es gibt derzeit keine spezifische antivirale Therapie, um der wachsenden Bedrohung durch Dengue-Fieber zu begegnen. Die Zahl der Dengue-Erkrankungen wird weltweit auf 50 bis 200 Millionen geschätzt. Der Einsatz kartografischer Methoden lässt jedoch darauf schließen, dass die Zahl der Dengue-Infektionen eher bei 400 Millionen liegt. Im Jahr 2012 stufte die WHO Dengue als eine der wichtigsten durch Mücken übertragenen Viruskrankheiten ein. Diese Einstufung ist durch die erhebliche geografische Ausbreitung des Virus zusammen mit seinem Vektor in Gebiete gerechtfertigt, die zuvor nicht betroffen waren (Abbildung 5).
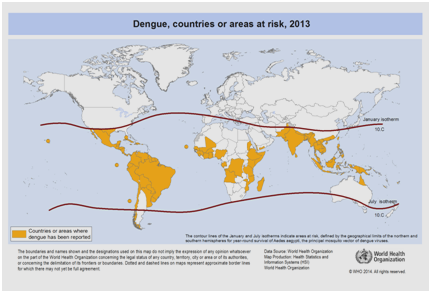
Abbildung 5: Länder oder Gebiete der Welt, in denen Dengue im Jahr 2013 gemeldet wurde, gemäß den von der Weltgesundheitsorganisation gesammelten Daten.
Es wird auch durch die Kosten unterstützt, die die Krankheit mit sich bringt. Vergleicht man die Belastung durch Dengue und andere übertragbare Krankheiten in der betroffenen Region, so verursacht Dengue weitaus mehr menschliches Leid und ist eine größere Belastung als die anderen vektorübertragenen Krankheiten. Nach Angaben der WHO ist Dengue die häufigste Ursache für Krankenhausaufenthalte und Todesfälle bei Kindern in Südostasien. Eine Studie von Hammond et al. berichtet, dass der Großteil der Morbidität und Mortalität im Zusammenhang mit dieser Krankheit eher bei Kindern als bei anderen Altersgruppen auftritt. Säuglinge im Alter von 4-9 Monaten und Kinder im Alter von 5-9 Jahren sind am stärksten von Dengue betroffen (Abbildung 6). Der Schweregrad der Erkrankung bei diesen Kindern ist häufig auf eine sekundäre DENV-Infektion zurückzuführen. Eine von Dıaz-Quijano und Waldman in Lateinamerika und der Karibik durchgeführte ökologische Studie ergab, dass zu den Determinanten der Dengue-Mortalitätsrate in diesen Populationen die Dauer der anerkannten Endemie, die Bevölkerungsdichte und die Niederschlagsmenge gehören.
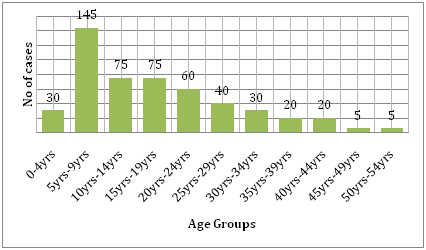
Abbildung 6: Altersverteilung der Studienkohorte in León nach Altersgruppen.
Zusätzlich zu den Auswirkungen von Morbidität und Mortalität bringt das Dengue-Virus eine hohe finanzielle Belastung für die betroffenen Regionen mit sich, von denen viele schlecht ausgestattet sind, um diese Kosten zu tragen. Im Jahr 2010 wurde die finanzielle Belastung durch das Dengue-Virus in Nord-, Mittel- und Südamerika auf durchschnittlich 2,1 Mrd. USD pro Jahr geschätzt (in US-Dollar 2010), wobei die Spanne bei Sensitivitätsanalysen zwischen 1 und 4 Mrd. USD lag und von Jahr zu Jahr erheblich variierte. Nach Angaben der WHO wird Dengue inzwischen als weltweites Problem angesehen, wobei der asiatisch-pazifische Raum die höchste (75 %) globale Bevölkerungszahl aufweist, die dem Dengue-Virus ausgesetzt ist. Auch im westlichen Pazifik ist die Zahl der gemeldeten Fälle von Dengue-Fieber in den letzten zehn Jahren kontinuierlich gestiegen.
Auch wenn es in der Mitte des 20. Jahrhunderts keine Übertragung des Denguefieber-Virus gab, ist jetzt ein Anstieg der einheimischen Denguefieber-Fälle auf dem amerikanischen Kontinent zu verzeichnen. Allein in Nord- und Südamerika wurden im Jahr 2010 mehr als 1,6 Millionen Dengue-Fälle gemeldet, davon 49.000 Fälle von schwerem Dengue. In Afrika nehmen Ausbrüche des Denguefiebers an Umfang und Häufigkeit zu, werden aber nicht konsequent an die WHO gemeldet. Zwischen 1960 und 2010 meldeten 22 afrikanische Länder sporadische Fälle, wie aus den verfügbaren Ausbruchsdaten hervorgeht. In Europa wurden seit einem Ausbruch in Griechenland im Jahr 1928 keine Epidemien von Pocken gemeldet. Nun droht ein Ausbruch in Europa, der auf Aedes albopictus zurückgeführt wird, da diese aus Ländern einreist, in denen die Krankheit endemisch ist. Man schätzt, dass die Inzidenz der Krankheit in den kommenden Jahren aufgrund multifaktorieller Risikofaktoren zunehmen wird.