Lernziele
- Die Eigenschaften eines Gases beschreiben.
Die drei üblichen Phasen (oder Zustände) der Materie sind Gase, Flüssigkeiten und Feststoffe. Gase haben die geringste Dichte der drei Phasen, sind stark komprimierbar und füllen jeden Behälter, in den sie gegeben werden, vollständig aus. Gase verhalten sich so, weil ihre zwischenmolekularen Kräfte relativ schwach sind, so dass sich ihre Moleküle ständig unabhängig von den anderen vorhandenen Molekülen bewegen. Feststoffe dagegen sind relativ dicht, starr und inkompressibel, weil ihre zwischenmolekularen Kräfte so stark sind, dass die Moleküle im Wesentlichen an ihrem Platz fixiert sind. Flüssigkeiten sind wie Feststoffe relativ dicht und inkompressibel, passen sich aber wie Gase leicht an die Form ihres Behälters an. Daraus kann man schließen, dass die Summe der zwischenmolekularen Kräfte in Flüssigkeiten zwischen denen von Gasen und Festkörpern liegt. Abbildung 10.1.1 vergleicht die drei Aggregatzustände und veranschaulicht die Unterschiede auf molekularer Ebene.
Abbildung 10.1.1 Eine zweiatomige Substanz (O2) in festem, flüssigem und gasförmigem Zustand
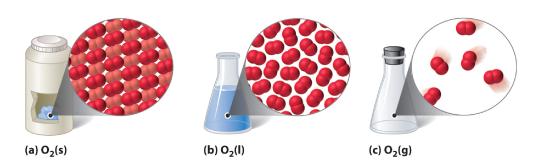
(a) Festes O2 hat ein festes Volumen und eine feste Form, und die Moleküle sind dicht aneinander gepackt. (b) Flüssiges O2 passt sich der Form seines Behälters an, hat aber ein festes Volumen; es enthält relativ dicht gepackte Moleküle. (c) Gasförmiges O2 füllt seinen Behälter vollständig aus – unabhängig von dessen Größe oder Form – und besteht aus weit auseinander liegenden Molekülen.
Der Zustand eines bestimmten Stoffes hängt stark von den Bedingungen ab. H2O kommt beispielsweise in allen drei Zuständen vor: festes Eis, flüssiges Wasser und Wasserdampf (seine gasförmige Form). Unter den meisten Bedingungen begegnet uns Wasser als die lebensnotwendige Flüssigkeit; wir trinken es, kochen damit und baden darin. Wenn die Temperatur kalt genug ist, um die Flüssigkeit in Eis zu verwandeln, können wir darauf Ski fahren oder Schlittschuh laufen, es in einen Schneeball oder eine Schneekugel packen und sogar Häuser damit bauen. WasserdampfDie Unterscheidung zwischen einem Gas und einem Dampf ist sehr fein: Der Begriff Dampf bezieht sich auf die gasförmige Form eines Stoffes, der unter normalen Bedingungen (25 °C, 1,0 atm) flüssig oder fest ist. Stickstoff (N2) und Sauerstoff (O2) werden daher als Gase bezeichnet, während gasförmiges Wasser in der Atmosphäre als Wasserdampf bezeichnet wird. ist ein Bestandteil der Luft, die wir einatmen, und entsteht immer dann, wenn wir Wasser zum Kochen von Speisen oder zur Zubereitung von Kaffee oder Tee erhitzen. Wasserdampf mit einer Temperatur von mehr als 100 °C wird als Dampf bezeichnet. Dampf wird zum Antrieb großer Maschinen verwendet, darunter auch Turbinen, die Strom erzeugen. Die Eigenschaften der drei Aggregatzustände von Wasser sind in Tabelle 10.1.1
zusammengefasst. Die geometrische Struktur und die physikalischen und chemischen Eigenschaften von Atomen, Ionen und Molekülen hängen in der Regel nicht von ihrem Aggregatzustand ab; die einzelnen Wassermoleküle in Eis, flüssigem Wasser und Dampf sind zum Beispiel alle identisch. Im Gegensatz dazu hängen die makroskopischen Eigenschaften eines Stoffes stark von seinem physikalischen Zustand ab, der durch zwischenmolekulare Kräfte und Bedingungen wie Temperatur und Druck bestimmt wird.
Abbildung 10.1.2 zeigt die Positionen der Elemente im Periodensystem, die üblicherweise im gasförmigen, flüssigen und festen Zustand vorkommen. Mit Ausnahme von Wasserstoff befinden sich die Elemente, die in der Natur als Gase vorkommen, auf der rechten Seite des Periodensystems. Von diesen sind alle Edelgase (Gruppe 18) einatomige Gase, während die anderen gasförmigen Elemente zweiatomige Moleküle sind (H2, N2, O2, F2 und Cl2). Sauerstoff kann auch ein zweites Allotrop bilden, das hochreaktive triatomische Molekül Ozon (O3), das ebenfalls ein Gas ist. Im Gegensatz dazu sind Brom (als Br2) und Quecksilber (Hg) unter normalen Bedingungen (25 °C und 1,0 atm, gemeinhin als „Raumtemperatur und -druck“ bezeichnet) flüssig. Gallium (Ga), das bei nur 29,76 °C schmilzt, kann in eine Flüssigkeit umgewandelt werden, indem man einen Behälter in die Hand nimmt oder ihn an einem heißen Sommertag in einem nicht klimatisierten Raum aufbewahrt. Die übrigen Elemente sind unter normalen Bedingungen alle fest.
Abbildung 10.1.2 Elemente, die in der Natur als Gase, Flüssigkeiten und Feststoffe bei 25°C und 1 atm vorkommen
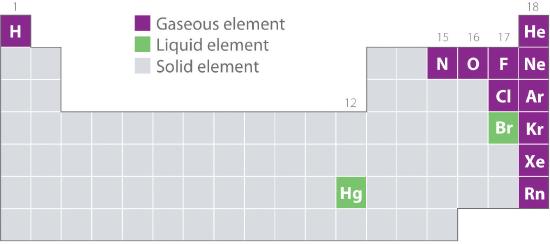
Die Edelgase und Quecksilber kommen als einatomige Spezies vor, während alle anderen Gase und Brom zweiatomige Moleküle sind.
Viele der Elemente und Verbindungen, denen wir bisher begegnet sind, kommen typischerweise als Gase vor; einige der häufigsten sind in Tabelle 10.1.2 aufgeführt. Zu den gasförmigen Stoffen gehören viele binäre Hydride, wie z. B. die Halogenwasserstoffe (HX), die Hydride der Chalkogene, die Hydride der Elemente der Gruppe 15 N, P und As, die Hydride der Elemente der Gruppe 14 C, Si und Ge sowie Diboran (B2H6). Darüber hinaus sind viele der einfachen kovalenten Oxide der Nichtmetalle Gase, wie CO, CO2, NO, NO2, SO2, SO3 und ClO2. Viele organische Verbindungen mit geringer Molekülmasse sind ebenfalls Gase, darunter alle Kohlenwasserstoffe mit vier oder weniger Kohlenstoffatomen und einfache Moleküle wie Dimethylether, Methylchlorid (CH3Cl), Formaldehyd (CH2O) und Acetaldehyd (CH3CHO). Kältemittel wie die Fluorchlorkohlenwasserstoffe (FCKW) und die teilhalogenierten Fluorchlorkohlenwasserstoffe (H-FCKW) schließlich sind Gase, die sich durch Kompression leicht verflüssigen lassen, wobei die Flüssigkeiten wiederum durch Druckabbau in Gase umgewandelt werden können. Der Phasenwechsel von Flüssigkeit zu Gas in den Rohren im Inneren des Kühlschranks kühlt, während die Kompression in den Spulen am Boden oder an der Rückseite des Kühlschranks den Raum erwärmt. Ammoniak und SO2 sind andere komprimierbare Gase, die als Kühlmittel verwendet wurden, aber wegen ihrer Giftigkeit nicht in Häusern eingesetzt werden dürfen. Ammoniak wird wegen seiner Effizienz und seiner geringen Kosten immer noch als Kältemittel in großen gewerblichen Einrichtungen verwendet.
Alle zuvor genannten gasförmigen Stoffe (mit Ausnahme der einatomigen Edelgase) enthalten kovalente oder polare kovalente Bindungen und sind unpolare oder polare Moleküle. Im Gegensatz dazu verhindern die starken elektrostatischen Anziehungen in ionischen Verbindungen wie NaBr (Siedepunkt = 1390°C) oder LiF (Siedepunkt = 1673°C), dass sie bei Raumtemperatur und -druck als Gase existieren. Darüber hinaus sind die leichtesten Mitglieder einer gegebenen Familie von Verbindungen höchstwahrscheinlich Gase, und die Siedepunkte polarer Verbindungen sind im Allgemeinen höher als die von unpolaren Verbindungen mit ähnlicher Molekülmasse. Daher sind in einer bestimmten Reihe von Verbindungen die leichtesten und am wenigsten polaren Mitglieder am ehesten Gase. Mit relativ wenigen Ausnahmen sind jedoch Verbindungen mit mehr als fünf Atomen aus Periode 2 oder darunter zu schwer, um unter normalen Bedingungen als Gase zu existieren.
Note the Pattern
Gasförmige Substanzen enthalten oft kovalente oder polare kovalente Bindungen, existieren als unpolare oder leicht polare Moleküle, haben relativ niedrige Molekularmassen und enthalten fünf oder weniger Atome aus Periode 1 oder 2.
Während Gase eine Vielzahl von Verwendungszwecken haben, wird angenommen, dass die Perser die römische Stadt Dura in Ostsyrien im dritten Jahrhundert n. Chr. auf besonders grausame Weise mit einem Gas angegriffen haben. Die Perser gruben einen Tunnel unter der Stadtmauer, um in die Stadt einzudringen und sie zu erobern. Archäologische Beweise deuten darauf hin, dass die Perser, als die Römer mit Gegentunneln antworteten, um die Belagerung zu stoppen, Bitumen und Schwefelkristalle entzündeten, um ein dichtes, giftiges Gas zu erzeugen. Es ist wahrscheinlich, dass Blasebälge oder Schornsteine die giftigen Dämpfe verteilten. Die Überreste von etwa 20 römischen Soldaten wurden am Fuß der Stadtmauer am Eingang eines weniger als 2 m hohen und 11 m langen Tunnels entdeckt. Da es höchst unwahrscheinlich ist, dass die Perser so viele Römer am Eingang zu einem so engen Raum abschlachten konnten, spekulieren Archäologen, dass die alten Perser chemische Kriegsführung einsetzten, um die Stadt erfolgreich zu erobern.
Beispiel 10.1.1
Welche Verbindungen würden Sie bei Raumtemperatur und Druck als Gase bezeichnen?
- Cyclohexen
- Lithiumcarbonat
- Cyclobutan
- Vanadium(III)oxid
- Benzoesäure (C6H5CO2H)
Gegeben: Verbindungen
Gefragt: Aggregatzustand
Strategie:
A Entscheide, ob jede Verbindung ionisch oder kovalent ist. Eine ionische Verbindung ist bei Raumtemperatur und Druck höchstwahrscheinlich ein Feststoff, während eine kovalente Verbindung ein Feststoff, eine Flüssigkeit oder ein Gas sein kann.
B Unter den kovalenten Verbindungen sind diejenigen, die relativ unpolar sind und niedrige Molekülmassen haben, bei Raumtemperatur und Druck höchstwahrscheinlich Gase.
Lösung:
A Lithiumcarbonat ist Li2CO3, das Li+ und CO32- Ionen enthält, und Vanadium(III)-oxid ist V2O3, das V3+ und O2- Ionen enthält. Beides sind primär ionische Verbindungen, die als Feststoffe zu erwarten sind. Die übrigen drei Verbindungen sind alle kovalent.
B Benzoesäure hat mehr als vier Kohlenstoffatome und ist polar, so dass es sich wahrscheinlich nicht um ein Gas handelt. Sowohl Cyclohexen als auch Cyclobutan sind im Wesentlichen unpolare Moleküle, aber Cyclobutan (C4H8) hat eine deutlich geringere Molmasse als Cyclohexen (C6H10), das wiederum mehr als vier Kohlenstoffatome hat. Wir gehen daher davon aus, dass Cyclobutan bei Raumtemperatur und -druck höchstwahrscheinlich ein Gas ist, während Cyclohexen eine Flüssigkeit ist. Tatsächlich ist Cyclobutan mit einem Siedepunkt von nur 12°C im Vergleich zu 83°C für Cyclohexen bei Raumtemperatur und Druck ein Gas.
Übung
Welche Verbindungen würden Sie bei Raumtemperatur und Druck als Gase vorhersagen?
- n-Butanol
- Ammoniumfluorid (NH4F)
- ClF
-
Ethylenoxid
- HClO4
Antwort: c; d
Zusammenfassung
Stoffe können in drei Zuständen existieren: gasförmig, flüssig und fest. Gase haben die geringste Dichte der drei Zustände, sind stark komprimierbar und füllen ihre Behälter vollständig aus. Elemente, die bei Raumtemperatur und -druck als Gase vorliegen, sind auf der rechten Seite des Periodensystems gruppiert; sie kommen entweder als einatomige Gase (die Edelgase) oder als zweiatomige Moleküle (einige Halogene, N2, O2) vor. Viele anorganische und organische Verbindungen mit vier oder weniger Nicht-Wasserstoffatomen sind bei Raumtemperatur und Druck ebenfalls Gase. Alle gasförmigen Stoffe zeichnen sich durch schwache Wechselwirkungen zwischen den einzelnen Molekülen oder Atomen aus.
Key Takeaway
- Die Moleküle in gasförmigen Stoffen enthalten oft kovalente oder polare kovalente Bindungen, sind unpolare oder leicht polare Moleküle und haben relativ geringe Molekülmassen.
Konzeptuelle Probleme
-
Erkläre die Unterschiede zwischen den mikroskopischen und den makroskopischen Eigenschaften der Materie. Ist der Siedepunkt einer Verbindung eine mikroskopische oder makroskopische Eigenschaft? molekulare Masse? Warum?
-
Bestimmen Sie, ob der Schmelzpunkt, das Dipolmoment und die elektrische Leitfähigkeit makroskopische oder mikroskopische Eigenschaften der Materie sind, und erläutern Sie Ihre Argumentation.
-
Wie beeinflussen die mikroskopischen Eigenschaften der Materie die makroskopischen Eigenschaften? Können Sie einen Zusammenhang zwischen Molekülmasse und Siedepunkt herstellen? Warum oder warum nicht? Kann die Polarität mit dem Siedepunkt in Verbindung gebracht werden?
-
Bei einem Stoff, der gasförmige, flüssige und feste Phasen hat, ordnen Sie diese Phasen in der Reihenfolge der zunehmenden
- Dichte an.
- Stärke der zwischenmolekularen Wechselwirkungen.
- Kompressibilität.
- Molekularbewegung.
- Ordnung in der Anordnung der Moleküle oder Atome.
-
Erkläre, was an dieser Aussage falsch ist: „Der Zustand der Materie bestimmt weitgehend die molekularen Eigenschaften eines Stoffes.“
-
Beschreiben Sie die wichtigsten Faktoren, die den Zustand einer bestimmten Verbindung bestimmen. Welche äußeren Bedingungen beeinflussen, ob ein Stoff in einem der drei Aggregatzustände vorliegt?
-
Welche Elemente des Periodensystems liegen bei Raumtemperatur und Druck als Gase vor? Welche dieser Elemente sind zweiatomige Moleküle und welche einatomige? Welche Elemente sind bei Raumtemperatur und -druck flüssig? Welcher Teil des Periodensystems enthält Elemente, deren binäre Hydride bei Raumtemperatur höchstwahrscheinlich Gase sind?
-
Ist die folgende Feststellung richtig? „Fast alle nichtmetallischen binären Hydride sind bei Raumtemperatur Gase, aber alle Metallhydride sind Feststoffe.“ Erläutern Sie Ihre Überlegungen.
-
Ist die folgende Beobachtung richtig? „Alle Hydride der Chalkogene sind bei Raumtemperatur und Druck gasförmig, mit Ausnahme des binären Sauerstoffhydrids, das flüssig ist.“ Erläutern Sie Ihre Überlegungen. Würden Sie erwarten, dass 1-Chlorpropan ein Gas ist? Jodpropan? Warum?
-
Erkläre, warum ionische Verbindungen unter normalen Bedingungen keine Gase sind.
Antworten
-
-
-
-
-
Die molekularen Eigenschaften eines Stoffes steuern seinen Aggregatzustand unter einer bestimmten Bedingung, und nicht andersherum. Das Vorhandensein starker zwischenmolekularer Kräfte begünstigt einen kondensierten Zustand der Materie (flüssig oder fest), während sehr schwache zwischenmolekulare Wechselwirkungen den gasförmigen Zustand begünstigen. Außerdem bestimmt die Form der Moleküle, ob es sich bei einer kondensierten Phase um eine Flüssigkeit oder einen Feststoff handelt.
-
-
Elemente, die als Gase vorliegen, finden sich hauptsächlich in der oberen rechten Ecke und auf der rechten Seite des Periodensystems. Die folgenden Elemente kommen als Gase vor: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe und Rn. Somit sind die Hälfte der Halogene, alle Edelgase und die leichtesten Chalkogene und Piknogene Gase. Alle Elemente außer den Edelgasen liegen als zweiatomige Moleküle vor. Nur zwei Elemente liegen bei einer normalen Raumtemperatur von 20 °C bis 25 °C in flüssiger Form vor: Quecksilber und Brom. Der obere rechte Teil des Periodensystems umfasst auch die meisten Elemente, deren binäre Hydride gasförmig sind. Darüber hinaus sind die binären Hydride der Elemente der Gruppen 14-16 Gase.
-
-
-