US Pharm. 2009;34(2):25-27.
Le malattie cardiovascolari (CVD), la principale causa di morte in tutto il mondo, coinvolgono meccanismi che devono ancora essere pienamente compresi. Mentre i lipidi plasmatici sono biologicamente necessari per la sintesi delle membrane cellulari e la produzione di ormoni e sono una fonte di acidi grassi liberi, la dislipidemia è stata a lungo collegata a una maggiore incidenza di CVD, ictus e malattia arteriosa periferica.1
Stratificazione tradizionale del rischio
L’attuale approccio al trattamento della dislipidemia è specificato nel National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 Nell’ATP III, i fattori di rischio e la successiva stratificazione del rischio sono derivati dal calcolo del cosiddetto punteggio di rischio Framingham (FRS), che è stato utilizzato per decenni per prevedere il rischio di CVD. ATP III fornisce raccomandazioni per la stratificazione del rischio in base a più fattori di rischio, diabete e sindrome metabolica. I fattori di rischio per la malattia coronarica (CHD) includono ipertensione (pressione sanguigna ≥140/90 o uso di antipertensivi); storia familiare (parente di primo grado con CHD); età (maschio, ≥45 anni; femmina, ≥55 anni); livello di lipoproteine ad alta densità (HDL) superiore a 40 mg/dL; e fumo. Un livello di HDL superiore a 50 mg/dL è identificato come cardioprotettivo ed è quindi considerato un fattore di rischio “negativo”. Oltre a elencare specifici fattori di rischio CHD, ATP III identifica gli equivalenti di rischio CHD (condizioni che conferiscono un rischio simile per un evento CHD). Gli equivalenti di rischio CHD includono la malattia dell’arteria carotidea, l’aneurisma dell’aorta addominale, la malattia arteriosa periferica, il diabete mellito, o un rischio decennale di infarto miocardico (MI) di almeno il 20% (cioè, FRS ≥20%).1,2
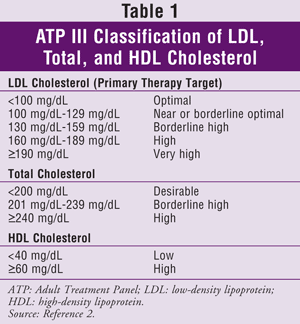
ATP III specifica le lipoproteine a bassa densità (LDL) come obiettivo primario per il trattamento del colesterolo. Raggiungere i livelli target di trigliceridi (TG) e HDL è generalmente considerato un obiettivo secondario. Gli obiettivi del colesterolo per la popolazione generale sono riportati nella TABELLA 1.2
Un aggiornamento di ATP III è stato pubblicato nel 2004.3 Questa versione include una raccomandazione per una riduzione dal 30% al 40% delle LDL al basale nei pazienti considerati a rischio moderato o alto di CHD e le linee guida in base alle quali un paziente è considerato a rischio molto alto. I pazienti ad altissimo rischio possono includere quelli con CVD stabilito più uno o più dei seguenti: più fattori di rischio principali (ad esempio, il diabete); fattori di rischio gravi e scarsamente controllati (ad esempio, fumo, ipertensione non controllata); componenti multiple della sindrome metabolica (TABELLA 2); o sindrome coronarica acuta.

L’aggiornamento ATP III suggerisce anche che i farmaci per la riduzione dei lipidi e un obiettivo di LDL inferiore a 100 mg/dL siano considerati per alcuni pazienti.3 Questi pazienti dovrebbero avere un rischio di CHD a 10 anni del 10% – 20% e un livello di LDL tra 100 mg/dL e 130 mg/dL. Essi dovrebbero anche essere di età avanzata e hanno gravi fattori di rischio; TG livello 200 mg/dL o superiore, non-HDL livello 160 mg/dL o superiore e HDL livello 40 mg/dL o meno; sindrome metabolica; o fattori di rischio emergenti come la proteina C-reattiva ad alta sensibilità (hs-CRP) (<3 mg/dL) o calcio coronarico maggiore del 75 ° percentile per età e sesso di una persona.
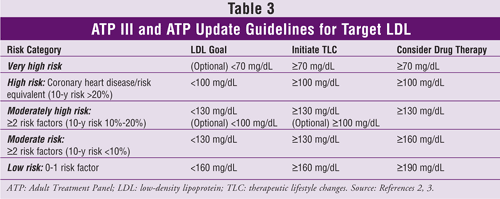
I livelli target di LDL, le raccomandazioni per i cambiamenti terapeutici dello stile di vita e le informazioni sull’inizio dei farmaci ipocolesterolemizzanti (basati sul numero di fattori di rischio CHD o equivalenti) da ATP III e il suo aggiornamento sono riportati nella TABELLA 3.2,3
Marcatori di rischio non tradizionali
La previsione tradizionale del rischio CVD si basa molto su FRS. Ci sono limitazioni a questo approccio, tuttavia, come FRS è stato notato per sovrastimare il rischio nelle popolazioni a basso rischio e sottovalutare il rischio in popolazioni ad alto rischio.4 Infatti, morte improvvisa e non fatale MI senza sintomi precedenti si verificano in fino al 25% dei pazienti con CHD.5 Come già detto, l’aggiornamento ATP III raccomanda considerazione di trattamento lipidico più aggressivo in pazienti con fattori di rischio emergenti.3 Per l’ultimo decennio, la ricerca si è concentrata sul ruolo non tradizionali fattori di rischio svolgono nella fisiopatologia di CVD. Fibrinogeno, hs-CRP, calcio coronarico e analisi della sottofrazione lipoproteica sono stati oggetto di molte ricerche.
Anche se diversi marcatori di infiammazione sono stati associati a CVD, solo quelli che possono essere misurati facilmente hanno un valore pratico.6 Uno di questi marcatori infiammatori è l’hs-CRP.7 Un hs-CRP elevato è stato associato a un aumento del rischio di CVD, ictus e malattia vascolare periferica in pazienti con e senza aterosclerosi nota. I livelli di hs-CRP sono stati suddivisi in terzili. Questi terzili (<1.0 mg/L, 1 mg/L-3 mg/L e >3 mg/L) corrispondono, rispettivamente, a FRS di basso, moderato e alto rischio.8
Il più recente studio clinico importante che esamina l’utilità di CRP nella previsione del rischio cardiovascolare è lo studio JUPITER.9 Questo studio ha incluso specificamente pazienti sani con colesterolo normale (LDL <130 mg/dL) e un livello elevato di CRP (>2 mg/dL). Questi pazienti sono stati trattati con rosuvastatina 20 mg o placebo per valutare l’endpoint composito di successivo MI o ictus non fatale e il rischio composito di MI, ictus e morte per cause cardiovascolari. Lo studio è stato interrotto dopo 1,9 anni di follow-up perché il trattamento con rosuvastatina è risultato ridurre l’endpoint composito del 44% rispetto al placebo. Questo è stato uno studio di riferimento perché dimostra che i pazienti senza fattori di rischio cardiovascolare diversi dalla CRP elevata hanno ottenuto un beneficio significativo dalla terapia con rosuvastatina; tuttavia, il rapporto costo-efficacia dello screening di individui sani per CRP elevata e l’espansione della prescrizione di statine in tali casi è sconosciuto.
Oltre alle statine, altri agenti di riduzione dei lipidi (come niacina, fibrati ed ezetimibe), così come i tiazolidinedioni e il raloxifene, hanno dimostrato di ridurre i livelli di CRP. Attualmente si raccomanda di considerare i livelli di hs-CRP nel processo decisionale del trattamento per i pazienti con un rischio di CVD previsto dall’FRS del 10% al 20% nei prossimi 10 anni, e di evitare la misurazione di routine di hs-CRP nella popolazione adulta generale.7,8,10
Il fibrinogeno è stato studiato anche come un predittore non tradizionale del rischio di CVD. Nello studio Coronary Artery Risk Development in Young Adults (CARDIA), un elevato livello di fibrinogeno in soggetti di età compresa tra i 25 e i 37 anni è stato associato a un aumento del rischio di CVD subclinico nella successiva decade di vita del paziente.10 Il fibrinogeno svolge un ruolo importante nell’aggregazione piastrinica e nella formazione di fibrina, entrambi componenti chiave dell’aterosclerosi e dello sviluppo di trombi.1,11 I pazienti dello studio CARDIA che avevano elevati livelli di fibrinogeno sono risultati avere un aumento dello spessore intimale della carotide e della calcificazione delle coronarie (CAC) nel decennio successivo. Al momento, tuttavia, la misurazione di routine dei livelli di fibrinogeno non è raccomandata.10
La CAC si sviluppa nelle arterie coronarie aterosclerotiche ed è virtualmente assente in una parete di vaso normale. Punteggi CAC più elevati sono associati a una maggiore specificità, ma una minore sensibilità, per la previsione del rischio cardiovascolare. È importante notare, tuttavia, che anche se elevati punteggi CAC correlano con un aumento del rischio di CVD, eventi cardiovascolari possono ancora verificarsi in un paziente con un punteggio CAC di zero. Il valore prognostico della misurazione della CAC è stato molto discusso negli ultimi dieci anni. Dal 2000, c’è stata una crescente evidenza che CAC può essere indipendentemente predittiva di esito cardiovascolare oltre i tradizionali fattori di rischio. Nel 2007, l’American College of Cardiology Foundation/American Heart Association Writing Committee ha pubblicato un documento di consenso sull’uso della CAC nella valutazione del rischio cardiovascolare globale.12 Il consenso del comitato è stato quello di scoraggiare lo screening della CAC non selezionato, poiché ha un valore clinico limitato per i pazienti a basso rischio di CHD (FRS <1%/anno). Come con hs-CR e fibrinogeno, la misurazione di routine di CAC non è raccomandata; tuttavia, i punteggi CAC possono essere uno strumento utile per modificare la previsione del rischio e potenzialmente alterare la terapia per adeguatamente selezionati asintomatici, pazienti a rischio intermedio.
Lipoproteina (a), o Lp(a), è identificato nelle linee guida ATP III come un fattore di rischio emergente CVD.2 I lipidi sono trasportati in tutto il corpo come complessi lipidi e proteine noti come lipoproteine. Le lipoproteine variano in dimensione e densità e sono designate di conseguenza come LDL, HDL e lipoproteine a bassissima densità (VLDL). I costituenti proteici di questi complessi sono chiamati apolipoproteine. La Lp(a), una forma modificata di LDL, consiste in una molecola di apoproteina(a), o apo(a), legata all’apolipoproteina B, o apo(b), della particella LDL tradizionale. È simile alle LDL sia nella composizione che nella densità. Si ritiene che, poiché la componente apo(a) della Lp(a) è strutturalmente simile al plasminogeno, possa competere con il plasminogeno nel corpo e quindi inibire la fibrinolisi. Inoltre, si ipotizza che la Lp(a) promuova l’accumulo di colesterolo, lo sviluppo delle cellule schiumose e la propagazione delle placche aterosclerotiche.1 Sia la niacina che gli estrogeni hanno dimostrato di ridurre efficacemente la Lp(a); tuttavia, nessuna statina lo fa efficacemente.13,14 Livelli elevati di Lp(a) sono stati associati a un aumento del rischio di CVD in alcune, ma non tutte, le popolazioni studiate.15 Attualmente, non ci sono prove che il monitoraggio o l’abbassamento dei livelli di Lp(a) sia clinicamente utile, e la misurazione di routine non è raccomandata.16
L’apolipoproteina(b) è la principale componente proteica non solo delle LDL, ma anche delle LDL a densità intermedia e delle VLDL. Per la previsione del rischio cardiovascolare, la misurazione dei livelli di apo(b) e di colesterolo non-HDL è stata recentemente proposta come superiore alla misurazione del colesterolo LDL.17 In un’analisi post-hoc degli studi Treating to New Targets e IDEAL, è stato rilevato che il colesterolo non-HDL (il prodotto della sottrazione del colesterolo HDL dalla misurazione del colesterolo totale) e l’apo(b) erano più strettamente associati agli esiti cardiovascolari rispetto al colesterolo LDL.18,19 Si ipotizza che le linee guida future possano favorire il colesterolo non-HDL o l’apo(b) piuttosto che il colesterolo LDL come obiettivo primario del trattamento; attualmente, tuttavia, l’LDL rimane l’obiettivo primario della gestione del colesterolo.
L’iperomocisteinemia è stata collegata indipendentemente a un aumento del rischio di CVD, sebbene non sia fortemente associata come l’FRS, e l’esatto meccanismo causale è sconosciuto.20 Difetti nelle vie del folato e della B12 possono portare ad elevati livelli di omocisteina, così come le diete carenti di folato o di vitamine B6 e B12 e i farmaci che interferiscono con il metabolismo o l’assorbimento di queste vitamine.1 Anche l’insufficienza renale ed epatica possono elevare l’omocisteina. Si ritiene che l’iperomocisteinemia sia abbastanza rara. La popolazione anziana può essere a maggior rischio per questa condizione, a causa della carenza di folati nella dieta. La misurazione dei livelli di omocisteina dovrebbe essere eseguita quando il paziente è a digiuno, con livelli elevati che richiedono una valutazione dell’eziologia.
Infine, l’analisi della sottofrazione delle lipoproteine è un altro strumento potenziale per un’ulteriore stratificazione del rischio cardiovascolare. È noto che le LDL comprendono uno spettro di particelle LDL che vanno da quelle piccole e dense a quelle più leggere e galleggianti. Le particelle LDL piccole e dense sono note per conferire un rischio cardiovascolare più elevato.21 Con l’aumento delle LDL, aumentano le sottofrazioni di LDL piccole e dense. Allo stesso modo, le misurazioni delle HDL totali consistono in uno spettro di particelle di dimensioni e densità diverse. Le molecole HDL più piccole e dense conferiscono un minore effetto cardioprotettivo. Quando i livelli di HDL diminuiscono, c’è un marcato aumento delle piccole particelle HDL. Sulla base di questi risultati, è stato suggerito che LDL elevate, elevate piccole sottofrazioni di LDL, HDL basse e basse, grandi sottofrazioni di HDL sono predittive di CVD. Le linee guida ATP III riconoscono che le piccole particelle LDL sono state identificate come una componente dell’aterogenesi e che le misurazioni delle sottofrazioni HDL possono contribuire alla valutazione del rischio CVD. Secondo le linee guida, tuttavia, la capacità delle sottofrazioni LDL di prevedere la CVD indipendentemente da altri fattori di rischio non è ben definita. Inoltre, l’ATP III sottolinea che l’utilità clinica della misurazione delle sottofrazioni HDL non è stata stabilita. A causa di questo e del fatto che non sono ancora stati stabiliti cutoff significativi e riproducibili per la dimensione, la densità e il numero delle particelle, la misurazione delle sottofrazioni lipoproteiche non viene utilizzata nella gestione di routine del trattamento dell’iperlipidemia o nella stratificazione del rischio. Può essere utile, tuttavia, come aggiunta alla stratificazione del rischio tradizionale per determinare l’aggressività del trattamento in un paziente a rischio intermedio.
Conclusione
Anche se le linee guida di trattamento basate su ATP III, che si basano pesantemente su FRS, rimangono il nucleo delle raccomandazioni di trattamento in CVD, indicatori non tradizionali di CVD stanno emergendo come complementi per fornire una stratificazione del rischio più raffinata e assistere nell’identificazione dei pazienti con malattia subclinica precoce che possono avere bisogno di un trattamento più precoce e più aggressivo.
Il ruolo preciso dei marcatori di rischio CVD non tradizionali nel determinare il futuro rischio cardiovascolare di una persona, linee guida per i livelli target e raccomandazioni specifiche su quali popolazioni dovrebbero avere questi marcatori misurati di routine devono ancora essere delineati. Nessuno dei marcatori CVD non tradizionali è attualmente raccomandato per lo screening di routine; tuttavia, nei pazienti per i quali la decisione di iniziare la terapia (in particolare i farmaci) non è chiara, la misurazione di questi fattori di rischio può essere utile. In tali situazioni, la misurazione dei fattori di rischio non tradizionali in aggiunta ai tradizionali strumenti di previsione del rischio CVD può conferire un vantaggio significativo.
1. Talbert RL. Iperlipidemia. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacoterapia: A Pathophysiologic Approach. 7° ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Terzo rapporto del gruppo di esperti su rilevamento, valutazione e trattamento del colesterolo alto nel sangue negli adulti (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Accessed November 1, 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implicazioni di recenti studi clinici per il National Cholesterol Education Program Adult Treatment Panel III guidelines. Circolazione. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. La precisione e l’impatto della valutazione del rischio nella prevenzione primaria delle malattie cardiovascolari: una revisione sistematica. Cuore. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Morte cardiaca improvvisa: epidemiologia, rischio transitorio e valutazione dell’intervento. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. Proteina C-reattiva: un marcatore sierico non tradizionale del rischio cardiovascolare. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. proteina C-reattiva, un marcatore sensibile di infiammazione, predice il rischio futuro di malattia coronarica in uomini di mezza età inizialmente sani: risultati dal MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 a 1992. Circolazione. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. marcatori di infiammazione e malattie cardiovascolari: applicazione alla pratica clinica e di salute pubblica: una dichiarazione per gli operatori sanitari dai centri per il controllo e la prevenzione delle malattie e l’American Heart Association. Circolazione. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin per prevenire eventi vascolari in uomini e donne con elevata proteina C-reattiva. N Engl J Med. 2008;359:2195-2207.
10. Comitato per le malattie cardiovascolari e metaboliche. Valutare il rischio di malattie cardiovascolari con fattori di rischio non tradizionali: le ultime prove. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Valore additivo dei livelli di fibrinogeno e proteina C-reattiva ad alta sensibilità misurati con immunodosaggio per la previsione di eventi cardiovascolari incidenti. Circolazione. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. Un rapporto dell’American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Terapia per abbassare i livelli di lipoproteina (a). Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatina e niacina, vitamine antiossidanti, o la combinazione per la prevenzione della malattia coronarica. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Nessuna associazione tra plasma lipoproteina (a) concentrazioni e la presenza o assenza di aterosclerosi coronarica in afro-americani. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Livelli di lipoproteina (a) e rischio di futura malattia coronarica: dati prospettici su larga scala. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipidi, apolipoproteine e loro rapporti in relazione agli eventi cardiovascolari con trattamento di statina. Circolazione. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Abbassamento intensivo dei lipidi con atorvastatina in pazienti con malattia coronarica stabile. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. Atorvastatina ad alte dosi vs simvastatina a dose normale per la prevenzione secondaria dopo infarto miocardico: lo studio IDEAL: uno studio randomizzato controllato. JAMA. 2005;294:2437-2445.
20. Wald DS, legge M, Morris JK. Omocisteina e malattie cardiovascolari: prove di causalità da una meta-analisi. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Dimensioni delle lipoproteine a bassa densità e valutazione del rischio cardiovascolare. QJM.2006;99:1-14.