US Pharm. 2009;34(2):25-27.
Bij hart- en vaatziekten (CVD), wereldwijd de belangrijkste doodsoorzaak, zijn mechanismen betrokken die nog niet volledig worden begrepen. Hoewel plasmalipiden biologisch noodzakelijk zijn voor de synthese van celmembranen en de productie van hormonen en een bron zijn van vrije vetzuren, wordt dyslipidemie reeds lang in verband gebracht met een verhoogde incidentie van CVD, beroerten en perifere vaatziekten.1
Traditionele risicostratificatie
De huidige behandelingsaanpak voor dyslipidemie wordt gespecificeerd in het National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 In ATP III worden risicofactoren en de daaropvolgende risicostratificatie afgeleid door de berekening van een zogenaamde Framingham-risicoscore (FRS), die al tientallen jaren wordt gebruikt om het risico op CVD te voorspellen. ATP III geeft aanbevelingen voor risicostratificatie op basis van meerdere risicofactoren, diabetes en het metabool syndroom. Risicofactoren voor coronaire hartziekten (CHD) zijn hypertensie (bloeddruk ≥140/90 of gebruik van antihypertensiva); familieanamnese (eerstegraads familielid met CHD ); leeftijd (man, ≥45 jaar; vrouw, ≥55 jaar); HDL-niveau (high-density lipoprotein) hoger dan 40 mg/dL; en roken. Een HDL-gehalte van meer dan 50 mg/dL wordt aangemerkt als cardioprotectief en wordt daarom als een “negatieve” risicofactor beschouwd. ATP III vermeldt niet alleen specifieke CHD-risicofactoren, maar ook CHD-risicoequivalenten (aandoeningen die een vergelijkbaar risico op een CHD-gebeurtenis inhouden). CHD-risico-equivalenten zijn onder meer carotisarterie, abdominaal aorta-aneurysma, perifeer vaatlijden, diabetes mellitus, of een tienjaarsrisico van myocardinfarct (MI) van ten minste 20% (d.w.z. FRS ≥20%).1,2
ATP III specificeert lipoproteïne met lage dichtheid (LDL) als de primaire doelstelling voor cholesterolbehandeling. Het bereiken van de streefwaarden voor triglyceriden (TG) en HDL wordt over het algemeen als een secundair doel beschouwd. Cholesteroldoelen voor de algemene bevolking worden gegeven in TABEL 1.2
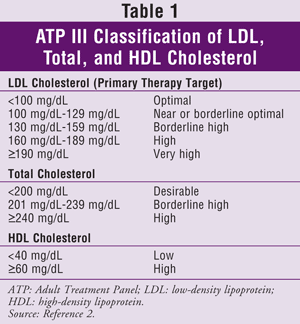
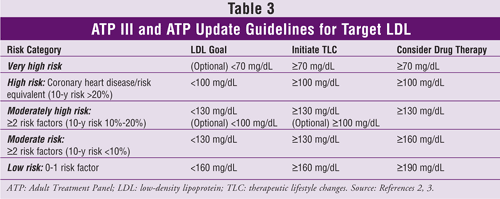
Een update van ATP III werd gepubliceerd in 2004.3 Deze versie bevat een aanbeveling voor een LDL-verlaging van 30% tot 40% ten opzichte van de uitgangswaarde bij patiënten die worden geacht een matig of hoog risico op CHD te lopen, en richtlijnen volgens welke een patiënt wordt geacht een zeer hoog risico te lopen. Patiënten met een zeer hoog risico kunnen diegenen zijn met een bewezen CVD plus een of meer van de volgende: meerdere belangrijke risicofactoren (bijv. diabetes); ernstige en slecht gecontroleerde risicofactoren (bijv, roken, ongecontroleerde hypertensie); meerdere componenten van het metabool syndroom (TABEL 2); of acuut coronair syndroom.

De ATP III-update stelt ook voor om voor bepaalde patiënten lipidenverlagende medicatie en een LDL-doel van minder dan 100 mg/dL te overwegen.3 Deze patiënten moeten een 10-jaars CHD-risico van 10% tot 20% hebben en een LDL-gehalte tussen 100 mg/dL en 130 mg/dL. Ze moeten ook van gevorderde leeftijd zijn en ernstige risicofactoren hebben; TG-niveau 200 mg/dL of hoger, non-HDL-niveau 160 mg/dL of hoger, en HDL-niveau 40 mg/dL of lager; metabool syndroom; of opkomende risicofactoren zoals hooggevoelig C-reactief proteïne (hs-CRP) (<3 mg/dL) of coronaire calcium groter dan het 75e percentiel voor de leeftijd en het geslacht van een persoon.
Doelwaarden voor LDL, aanbevelingen voor therapeutische veranderingen in levensstijl en informatie over het starten van cholesterolverlagende medicatie (gebaseerd op het aantal risicofactoren voor CHD of equivalenten daarvan) uit ATP III en de update daarvan staan in TABEL 3.2,3
Niet-traditionele risicomarkers
De traditionele voorspelling van het risico van CVD berust in hoge mate op FRS. Er zijn echter beperkingen aan deze benadering, aangezien is vastgesteld dat de FRS het risico in laagrisicopopulaties overschatten en het risico in hoogrisicopopulaties onderschatten.4 In feite komen plotseling overlijden en niet-fatale MI zonder voorafgaande symptomen voor bij tot 25% van de patiënten met CHD.5 Zoals eerder vermeld, wordt in de ATP III-update aanbevolen een agressievere lipidenbehandeling te overwegen bij patiënten met nieuwe risicofactoren.3 De afgelopen tien jaar heeft het onderzoek zich geconcentreerd op de rol die niet-traditionele risicofactoren spelen in de pathofysiologie van CVD. Fibrinogeen, hs-CRP, coronair calcium en lipoproteïne-subfractie-analyse zijn het onderwerp geweest van veel onderzoek.
Hoewel verschillende ontstekingsmarkers in verband zijn gebracht met CVD, zijn alleen die markers van praktische waarde die gemakkelijk kunnen worden gemeten.6 Eén zo’n ontstekingsmarker is hs-CRP.7 Verhoogde hs-CRP is in verband gebracht met een verhoogd risico op CVD, beroerte en perifere vaatziekten bij patiënten met en zonder bekende atherosclerose. De hs-CRP-niveaus zijn onderverdeeld in tertielen. Deze tertielen (<1,0 mg/L, 1 mg/L-3 mg/L, en >3 mg/L) komen respectievelijk overeen met FRS van laag, matig, en hoog risico.8
De meest recente grote klinische studie die de bruikbaarheid van CRP bij het voorspellen van cardiovasculaire risico’s onderzoekt, is de JUPITER studie.9 Deze studie omvatte specifiek gezonde patiënten met normaal cholesterol (LDL <130 mg/dL) en een verhoogd CRP-niveau (>2 mg/dL). Deze patiënten werden behandeld met rosuvastatine 20 mg of placebo om het samengestelde eindpunt van een volgend MI of niet-fatale beroerte en het samengestelde risico van MI, beroerte, en overlijden door cardiovasculaire oorzaken te evalueren. De studie werd gestopt na 1,9 jaar follow-up omdat behandeling met rosuvastatine het samengestelde eindpunt met 44% bleek te verminderen in vergelijking met placebo. Dit was een mijlpaalstudie omdat het aantoont dat patiënten zonder cardiovasculaire risicofactoren anders dan verhoogde CRP een significant voordeel verkregen van rosuvastatinetherapie; de kosteneffectiviteit van het screenen van gezonde personen op verhoogde CRP en het uitbreiden van het voorschrijven van statines in dergelijke gevallen is echter onbekend.
Naast statines is aangetoond dat andere lipidenverlagende middelen (zoals niacine, fibraten en ezetimibe), evenals thiazolidinedionen en raloxifeen, de CRP-spiegels verlagen. Momenteel wordt aanbevolen hs-CRP-niveaus in overweging te nemen bij de besluitvorming over de behandeling van patiënten met een door de FRS voorspeld CVD-risico van 10% tot 20% in de komende 10 jaar, en routinematige meting van hs-CRP in de algemene volwassen bevolking te vermijden.7,8,10
Fibrinogeen is ook bestudeerd als een niet-traditionele voorspeller van CVD-risico. In de studie Coronary Artery Risk Development in Young Adults (CARDIA) werd een verhoogde fibrinogeenspiegel bij personen tussen 25 en 37 jaar geassocieerd met een verhoogd risico op subklinische CVD in het daaropvolgende decennium van het leven van de patiënt.10 Fibrinogeen speelt een belangrijke rol bij de aggregatie van bloedplaatjes en de vorming van fibrine, die beide belangrijke componenten zijn van atherosclerose en de ontwikkeling van trombose.1,11 Patiënten in de CARDIA-studie met verhoogde fibrinogeenspiegels bleken in het daaropvolgende decennium een verhoogde carotis intimale dikte en coronaire aderverkalking (CAC) te hebben. Op dit moment wordt routinematige meting van fibrinogeenspiegels echter niet aanbevolen.10
CAC ontwikkelt zich in atherosclerotische kransslagaders en is vrijwel afwezig in een normale vaatwand. Hogere CAC-scores worden geassocieerd met een hogere specificiteit, maar een lagere sensitiviteit, voor de voorspelling van cardiovasculaire risico’s. Het is echter belangrijk op te merken dat, hoewel verhoogde CAC-scores correleren met een verhoogd risico op CVD, er nog steeds cardiovasculaire gebeurtenissen kunnen optreden bij een patiënt met een CAC-score van nul. Over de prognostische waarde van het meten van CAC is de afgelopen tien jaar veel gediscussieerd. Sinds 2000 zijn er steeds meer aanwijzingen dat CAC onafhankelijk van de traditionele risicofactoren voorspellend kan zijn voor cardiovasculaire gevolgen. In 2007 publiceerde het American College of Cardiology Foundation/American Heart Association Writing Committee een consensusdocument over het gebruik van CAC in de globale cardiovasculaire risicobeoordeling.12 De consensus van het comité was om ongeselecteerde CAC-screening te ontraden, omdat het van beperkte klinische waarde is voor patiënten met een laag risico op CHD (FRS <1%/jaar). Net als bij hs-CR en fibrinogeen wordt routinemeting van CAC niet aanbevolen; CAC-scores kunnen echter een nuttig instrument zijn voor het wijzigen van de risicovoorspelling en mogelijk het wijzigen van de therapie voor adequaat geselecteerde asymptomatische patiënten met een intermediair risico.
Lipoproteïne(a), of Lp(a), wordt in de ATP III-richtlijnen aangemerkt als een opkomende risicofactor voor CVD.2 Lipiden worden door het lichaam getransporteerd als lipiden-eiwitcomplexen, lipoproteïnen genaamd. Lipoproteïnen variëren in grootte en dichtheid en worden dienovereenkomstig aangeduid als LDL, HDL en zeer-lage-dichtheid-lipoproteïne (VLDL). De eiwitbestanddelen in deze complexen worden apolipoproteïnen genoemd. Lp(a), een gemodificeerde vorm van LDL, bestaat uit een apoproteïne(a)-molecule of apo(a), gekoppeld aan het apolipoproteïne B-gedeelte of apo(b)-gedeelte van het traditionele LDL-deeltje. Het is vergelijkbaar met LDL in zowel samenstelling als dichtheid. Aangenomen wordt dat aangezien de apo(a)-component van Lp(a) structureel gelijk is aan plasminogeen, het kan concurreren met plasminogeen in het lichaam en aldus de fibrinolyse kan remmen. Bovendien wordt gespeculeerd dat Lp(a) de accumulatie van cholesterol, de ontwikkeling van schuimcellen en de verspreiding van atherosclerotische plaques bevordert.1 Van zowel niacine als oestrogeen is aangetoond dat ze Lp(a) effectief verlagen; geen enkele statine doet dit echter.13,14 Verhoogde niveaus van Lp(a) zijn in verband gebracht met een verhoogd risico op CVD in sommige, maar niet alle, onderzochte populaties.15 Momenteel is er geen bewijs dat het monitoren of verlagen van Lp(a)-spiegels klinisch nuttig is, en routinematige meting wordt niet aanbevolen.16
Apolipoproteïne(b) is de belangrijkste eiwitcomponent van niet alleen LDL, maar ook LDL met gemiddelde dichtheid en VLDL. Voor de voorspelling van cardiovasculaire risico’s is onlangs voorgesteld dat het meten van apo(b) en niet-HDL-cholesterol superieur is aan het meten van LDL-cholesterol.17 In een post-hoc analyse van de Treating to New Targets en IDEAL-studies werd gevonden dat niet-HDL-cholesterol (het product van het aftrekken van HDL-cholesterol van de totale cholesterolmeting) en apo(b) nauwer geassocieerd waren met cardiovasculaire uitkomsten dan LDL-cholesterol.18,19 Er wordt gespeculeerd dat toekomstige richtlijnen de voorkeur zullen geven aan niet-HDL-cholesterol of apo(b) in plaats van LDL-cholesterol als het primaire behandelingsdoel; momenteel blijft LDL echter het primaire doel van cholesterolbehandeling.
Hyperhomocysteïnemie is onafhankelijk in verband gebracht met een verhoogd risico op CVD, hoewel het niet zo sterk in verband wordt gebracht als de FRS, en het exacte oorzakelijke mechanisme onbekend is.20 Defecten in de foliumzuur- en B12-route kunnen leiden tot verhoogde homocysteïnespiegels, net als diëten met een tekort aan foliumzuur of vitamine B6 en B12 en medicijnen die het metabolisme of de absorptie van deze vitamines verstoren.1 Nier- en leverfalen kan ook leiden tot verhoogde homocysteïnespiegels. Aangenomen wordt dat hyperhomocysteïnemie vrij zeldzaam is. Ouderen lopen mogelijk een verhoogd risico op deze aandoening vanwege een tekort aan foliumzuur in de voeding. De homocysteïnespiegel moet worden gemeten wanneer de patiënt nuchter is, en bij verhoogde waarden moet de etiologie worden geëvalueerd.
Ten slotte is lipoproteïne-subfractie-analyse een ander mogelijk instrument voor verdere cardiovasculaire risicostratificatie. Het is bekend dat de meting van LDL een spectrum van LDL-deeltjes omvat, variërend van kleine en dichte deeltjes tot deeltjes die lichter en drijvender zijn. Kleine, dichte LDL-deeltjes blijken een hoger cardiovasculair risico in te houden.21 Naarmate het LDL toeneemt, nemen ook de kleine, dichte LDL-subfracties toe. Evenzo bestaan totale HDL-metingen uit een spectrum van deeltjes die variëren in grootte en dichtheid. Kleinere, dichtere HDL-moleculen hebben een minder cardioprotectief effect. Wanneer het HDL-niveau daalt, is er een duidelijke toename van kleine HDL-deeltjes. Op basis van deze bevindingen is gesuggereerd dat verhoogd LDL, verhoogde kleine LDL-subfracties, laag HDL, en lage, grote HDL-subfracties voorspellend zijn voor CVD. De ATP III-richtsnoeren erkennen dat kleine LDL-deeltjes zijn geïdentificeerd als een component van atherogenese en dat metingen van HDL-subfracties kunnen bijdragen tot de risicobeoordeling van CVD. Volgens de richtsnoeren is het vermogen van LDL-subfracties om CVD onafhankelijk van andere risicofactoren te voorspellen echter niet goed gedefinieerd. Voorts wijst ATP III erop dat het klinisch nut van HDL-subfractiemetingen niet is vastgesteld. Daarom en omdat er nog geen zinvolle en reproduceerbare cutoffs voor deeltjesgrootte, -dichtheid en -aantal zijn vastgesteld, wordt de meting van lipoproteïnesubfracties niet gebruikt bij de routinematige behandeling van hyperlipidemie of bij risicostratificatie. Het kan echter nuttig zijn als aanvulling op de traditionele risicostratificatie om de agressiviteit van de behandeling te bepalen bij een patiënt met een intermediair risico.
Conclusie
Hoewel de op ATP III gebaseerde behandelingsrichtlijnen, die sterk steunen op FRS, de kern blijven van behandelingsaanbevelingen voor CVD, zijn niet-traditionele indicatoren van CVD in opkomst als aanvullingen om meer verfijnde risicostratificatie te bieden en te helpen bij de identificatie van patiënten met vroege subklinische ziekte die mogelijk eerder en agressiever behandeld moeten worden.
De precieze rol van niet-traditionele CVD-risicomarkers bij het bepalen van iemands toekomstige cardiovasculaire risico, richtlijnen voor streefwaarden en specifieke aanbevelingen bij welke bevolkingsgroepen deze markers routinematig moeten worden gemeten, moeten nog worden afgebakend. Geen van de niet-traditionele CVD-markers wordt momenteel aanbevolen voor routinescreening; bij patiënten bij wie de beslissing om een therapie (met name medicatie) in te stellen onduidelijk is, kan meting van deze risicofactoren echter nuttig zijn. In dergelijke situaties kan het meten van niet-traditionele risicofactoren in aanvulling op traditionele instrumenten voor risicovoorspelling van CVD een aanzienlijk voordeel opleveren.
1. Talbert RL. Hyperlipidemie. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacotherapie: A Pathophysiologic Approach. 7e ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Third report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Accessed November 1, 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death: epidemiology, transient risk, and intervention assessment. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reactive protein: een niet-traditionele serum marker van cardiovasculair risico. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. C-reactief proteïne, een gevoelige marker van ontsteking, voorspelt toekomstig risico van coronaire hartziekten bij aanvankelijk gezonde mannen van middelbare leeftijd: resultaten van de MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 tot 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359:2195-2207.
10. Commissie Cardiovasculaire en Metabole Ziekten. Assessing cardiovascular disease risk with nontraditional risk factors: the latest evidence. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Additive value of immunoassay-measured fibrinogen and high-sensitivity C-reactive protein levels for predicting incident cardiovascular events. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. Een rapport van de American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Therapy for lowering lipoprotein (a) levels. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. No association between plasma lipoprotein(a) concentrations and the presence or absence of coronary atherosclerosis in African-Americans. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a) levels and risk of future coronary heart disease: large-scale prospective data. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipids, apolipoproteins, and their ratios in relation to cardiovascular events with statin treatment. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Intensieve lipidenverlaging met atorvastatine bij patiënten met een stabiele coronaire ziekte. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Low-density lipoprotein size and cardiovascular risk assessment. QJM.2006;99:1-14.