キーワード
Irritable bowel syndrome; Sertraline; Psychosomatic
はじめに
最もよく見られる機能性胃腸障害の1つが過敏性腸症候群(IBS)で、その世界有病率はRome III基準により約5~20%となっています . 若い人、特に女性に多く見られる。 IBSの患者は、腸の症状がない人に比べて、病気に関連した欠勤をする可能性が高い。 最近の米国におけるIBSの負担を推定したところ、その直接費用はほぼ10億ドル、間接費用はさらに5000万ドルであることが判明した。 さらに、IBS患者の医療資源消費は、約4023>50%である。 そのため、IBSを効果的に治療することは、個人にとっても、医療制度や社会全体にとっても重要である。
IBSの正確な原因は依然として不明であり、治療の対象となる腸の症状について統一された説明は存在しない。 IBS患者は、腸の症状がない健康な対照群と比較して、痛みの中枢処理の異常、内臓知覚過敏、および高いレベルの心理的合併症を示す。 その結果、抗うつ剤は痛みを和らげる作用があるため、IBSの治療薬として導入されました。 セロトニン(5-HT)は、5-HT3および5-HT4受容体を介して、消化管の運動、分泌および感覚の制御に重要な役割を担っている。 さらに、最近の観察から、IBS患者において血漿5-HT濃度が低下していることが判明した。 しかし、IBSに対する抗うつ薬の有効性を評価した研究は多く、その臨床的根拠はまだ議論のあるところである。 最も一般的に使用されている抗うつ薬は、フルオキセチンやシタロプラムなどの選択的セロトニン再取り込み阻害薬(SSRI)、イミプラミンやアミトリプチリンなどの三環系抗うつ薬(TCA)である
セルトラリンは選択的セロトニン再取り込み阻害薬として、CNSシナプス間隙でのセロトニン再取り込み阻害作用により脳内のセロトニン濃度を高め、その精神作用と関連させる。 セルトラリンは、1991年に米国で使用が承認され、現在も広く使用されており、年間約4,000万件の処方がなされています。 本剤は、うつ病および不安障害の治療によく知られています。 また、選択的セロトニン再取り込み阻害薬の1つで、疼痛調節機構を有することから、心身症にもよく使用されています。
本研究では、過敏性腸症候群の腸の症状およびそれに伴う不安や抑うつ症状に対する効果について、セルトラリンとプラセボ効果(鎮痙薬、下痢止めなどの従来の治療)を比較検討しました。
方法
本研究は、1ヶ月間の前向きセルトラリン・プラセボ無作為化臨床試験で、治療と結果の測定は盲検化されていた。 対象はRome III基準で過敏性腸症候群(IBS)と診断され、アシュート大学病院の外来診療所から4週間以内に募集された55名の患者である。
サンプルサイズ
IBSに関するケースコントロール研究において、プラセボに対する50%の反応は頻繁に観察される。 さらに、抗うつ薬の奏効率はオープンラベルの研究で最大89%まで観察されています。 これらの数字を用い、検出力80%で、各群のサンプルサイズが得られた。
被験者と試験デザイン
対象は18~40歳の年齢層であった。 対象は最近IBSと診断され、罹病期間が5年以下の患者である。 さらに、すべての患者は他の選択的セロトニン再取り込み阻害剤による前治療を受けていないことが確認された。 全患者に対して、全血球計算、腎機能、肝機能、電解質測定を含むすべてのルーチン検査が行われた。 治療開始前のベースライン時に、不安に対するハミルトン評価尺度(HAM-A)とうつ病に対するハミルトン評価尺度(HAM-D)を全患者に実施した。 患者を2群に分け、第1群にはセルトラリン50mgを、第2群にはプラセボを25名投与した。 無作為化臨床試験中、盲検化は隠蔽された。 患者は治療後1ヶ月間フォローアップされた。 患者の再評価は、腸の症状に関して行われた。 腸の症状の改善は、4週間の投薬で患者から報告された症状の十分な緩和があった場合とされた。 また、治療1ヵ月後に不安に対するハミルトン評価尺度(HAM-A)とうつ病に対するハミルトン評価尺度(HAM-D)をすべての患者に対して行った。 腸の症状はあるが過敏性腸症候群の診断基準であるRome IIIを満たさない患者
2. 過敏性腸症候群を5年以上継続している患者
3. HAM-AとHAM-Dそれぞれで重度の不安や抑うつがある患者
4. 年齢層を満たしていない患者
5. 他の薬物投与を受けていた患者。
6. 慢性的な病状があった患者。
データ分析
SPSS バージョン 16 パッケージがこの研究に使用された。 記述統計は、腸の症状に対するサートラリンとプラセボの効果を比較するために使用された。 Paired samples T-testは、Hamilton rating scale for anxiety (HAM-A) とHamilton rating scale for depression (HAM-D) に対するsertralineとプラセボの効果をそれぞれ比較するために使われた。
Results
この研究は、Rome III criteriaに従って診断された55名の苛性腸症候群患者からなる。 患者の人口統計学的データについては、患者の平均年齢は26±2.1歳であり、女性患者32名に対して男性患者18名であったため、女性と男性の比率は1.7/1であった。
最も多かった消化管症状は腹部不快感で、すべての患者(100%)に見られ、次に腹部膨満と膨張が36患者(65.45%)に見られた。 3番目に多い症状は排便に伴う症状の改善で32名(58.18%),最後に最も少なかった症状は交互性腸炎で29名(52.7%)であった。 IBS-Cでは腹部膨満感や排便時の症状改善が多くみられ、IBS-Dでは交互性便習慣が多くみられた(図1)。 30名の患者にはsertraline 50 mgを、25名の患者にはプラセボを投与した。 セルトラリン50mgを投与した20名(下痢が主体の過敏性腸症候群7名、便秘が主体の過敏性腸症候群13名)には腸の症状の改善が見られたが、10名(下痢が主体の過敏性腸症候群4名、便秘が主体の過敏性腸症候群6名)では腸の症状の改善は満足に見られませんでした。
一方、プラセボ投与群では、8名(下痢が主体の過敏性腸症候群5名、便秘が主体の過敏性腸症候群3名)に腸管症状の改善が見られ、17名(下痢が主体の過敏性腸症候群12名、便秘が主体の過敏性腸症候群5名)に腸管症状の改善が見られなかった(表1及び図2)。
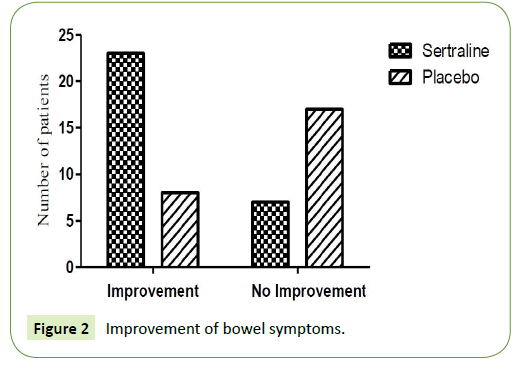
図2:腸管症状の改善状況。
注:IBS-D:下痢が主体の過敏性腸症候群、IBS-C:便秘が主体の過敏性腸症候群
表1:投薬1ヶ月後に腸の症状の改善を認めた患者数。
2つの研究グループは、不安とうつ病のハミルトン評価尺度についてそれぞれ比較されました。 ハミルトン不安度評価尺度(HAM-A)とハミルトンうつ病評価尺度(HAM-D)は、sertraline 50mg投与群で1ヶ月後に有意な減少がみられた。 治療前の平均HAM-Aは18.8±3.9であったが、1ヶ月間の投与で11.67±1.9となり、有意に減少した。 また、HAM-Dの平均値は投与前15.67±3.9であったが、投与1ヵ月後には11.6±4.2となった(P=0.001)。 一方、プラセボ投与群では、1ヵ月後のHamilton rating scale for anxiety(HAM-A)およびHamilton rating scale for depression(HAM-D)に有意な低下は認められませんでした。 HAM-Aの平均値は治療前に18.5±2.6であり、プラセボ投与1ヵ月後には18.2±2.4となった(P=0.12)(表2)。 また、HAM-Dの平均値は投与前13.4±2.1であり、プラセボ投与1ヵ月後には13±1.7となった(P=0.15)(図3、4)。
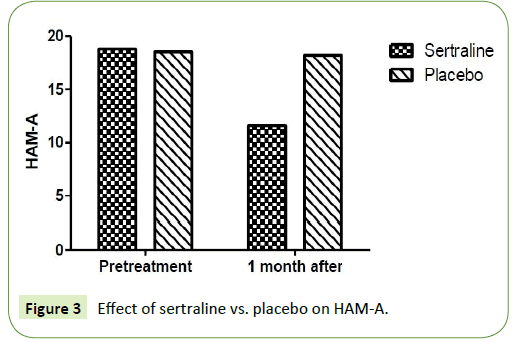
図3:HAM-Aに対するセルトラリンとプラセボの効果
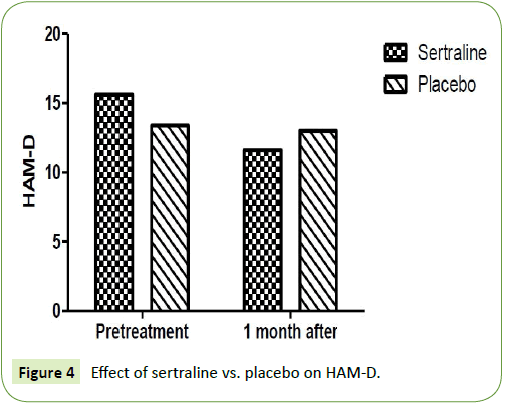
図4:Sertraline vs. Plazaobの効果
:セラートリンとプラセボの効果を比較すると、HAM-Aに対するセラトニンの効果は、プラセボと比較して有意に低かった。 表2:HAM-AとHAM-Dに対するsertraline vs. placeboの効果
考察
文献上では、IBS治療における選択的セロトニン再取り込み阻害薬(SSRI)の効果について6つの研究があり、矛盾した結果になっている。 パロキセチン、フルオキセチン、シタロプラムの4つの研究では緩やかな効果が報告され、フルオキセチンとシタロプラムの2つの研究では効果がなかった。
これらの研究のメタ分析では、過敏性腸症候群(IBS)の症状が改善しない相対リスクはSSRI vs プラセボで 0.62(95% CI, 0.45 to 0.87 )であるが、研究間で大きな異質性があることがわかった。 メタアナリシスでは、SSRIで治療した113人と対照群117人のデータを分析した。
これら6つの試験間の結果の違いは、研究デザインや患者集団の違いに起因していると考えられる。 Kuikenらは、三次施設からすべてのサブタイプのIBS患者40人を集め、fluoxetineまたはプラセボの6週間投与試験を行ったが、この試験ではうつ病患者は除外された。 Tabasらは、すべてのサブタイプのIBS患者81人を無作為化し、高繊維食とパロキセチンまたはプラセボの12週間試験に参加させたが、この試験ではうつ病患者は除外されなかった . Vahediらは、便秘が優勢なIBS患者44人を12週間の試験でfluoxetineまたはプラセボに無作為化したが、重度のうつ病患者のみが除外された . Tackらはcitalopramとプラセボを比較するクロスオーバー試験において、三次医療施設のIBS患者23名を登録したが、この試験ではうつ病の患者は除外された .
Ladabaum らはCitalopram 20mg/日を4週間投与した後にCitalopram 40mg/日をさらに4週間投与したIBS患者27名をランダムにしたが、これらの患者で精神症状は評価されなかった .
Talley らは、IBS患者が精神症状で悩むことがないよう、精神科医に相談した。 あらゆるタイプのIBS患者51名を12週間、citalopram(17名)、imipramine、またはプラセボ(16名)に無作為化したが、この試験でもうつ病患者は除外された .
何らかの有益性が検出された試験の特徴として、うつ病を除外していないこと、便秘優位のIBS患者のみを組み入れたこと、3次医療からの患者を対象としたクロスオーバーデザインであることが挙げられる。
それぞれの試験で使用した特定の薬剤、用量、期間が重要な要因となり得るが、明確なパターンは現れてはいない。 Tackらの研究は、citalopramの有益性を示した唯一の研究であり、Talleyらの研究は、citalopramとプラセボの反応率が同じであると報告し、Ladabaumらは、IBSの腸症状の治療におけるcitalopramの実質的有益性に対する証拠を見いだした . 臨床効果の定義が異なるため、結論の相違の多くを説明していると思われる。
TalleyらのようにIBS症状の十分な緩和を主要評価項目とした試験もあったが、他の試験では、全体的症状反応、全体的幸福感、特定の症状に対する効果について評価していた。 その結果、プラセボと比較して、セルトラリンは過敏性腸症候群(IBS)の腸の症状に対して有意な効果があることがわかりました。 プラセボの改善率が32%であったのに対し、セルトラリンは約66.67%であった。 これは、セロトニンが腸管通過性を高めることにより、IBSの下痢症状を改善するためと考えられます。 さらに、本研究では、ハミルトン不安評価尺度(HAM-A)およびハミルトンうつ病評価尺度(HAM-D)により推定される不安およびうつ病症状の有意な減少をプラセボ群に比べ、セルトラリン群に認めた。 ストレスは,IBS患者の症状の発現や重症化と関連することが多く,消化管はストレスの影響を受けやすいためである。 さらに、治療成績、通院、病気体験は、ストレス、不安、うつ病性障害、不適応対処メカニズムによって悪影響を受ける。
感覚障害、特にIBSの臨床マーカーである内臓知覚過敏(VHS)もIBSの病態生理と考えられてきた。 VHSは直腸バルーンを膨らませて骨盤内結腸を膨張させたときの痛覚の亢進で表される。 Hazlett-Stevensらは、内臓感覚に特異的な不安がIBSの強い予測因子であることを明らかにした。 不安のある人は、心配事の結果を大げさに考える傾向があり、一方で、不安のある人の心気症的な傾向もあった。 IBSのこれらの身体的症状は、これらの不快な症状に耐え、対処するために彼らの不安と無力を強化し、それによってこれらの身体的および心理的症状の間の悪循環を形成する可能性がある。
つまり、セルトラリンの効果は、抗うつ作用と抗不安作用に起因していると考えられるのです。 さらに、セルトラリンは侵害刺激の脊髄調節を変化させ、扁桃体活動や抑制性下行性疼痛調節系による脳腸軸プロセスに影響を与えることも明らかにした。 最近診断された患者や便秘が主なIBSの患者への使用が推奨される。 うつ病や不安症を除外したIBSにおけるsertralineの役割を議論するために、さらなる試験が必要である。 また、症状の完全緩和や症状の再発を検出するために、さらなる試験でより長い期間とより大きなサンプルサイズを考慮する必要がある。 Clin Gastroenterol Hepatol 10: 712-721.
.