Keywords
Irritable bowel syndrome; Sertraline; Psychosomatic
Introduction
Jednym z najczęstszych zaburzeń czynnościowych przewodu pokarmowego jest zespół jelita drażliwego (irritable bowel syndrome, IBS), którego częstość występowania na świecie wynosi około 5-20%, w zależności od kryteriów Rome III. Występuje on częściej u osób młodszych, zwłaszcza u kobiet. Pacjenci, którzy mają IBS są bardziej narażeni na nieobecności związane z chorobą niż ci, którzy nie mają objawów jelitowych. Niedawno obciążenie IBS w Stanach Zjednoczonych oszacowano i stwierdzono, że jego bezpośredni koszt wynosi prawie 1 miliard dolarów, a koszt pośredni to kolejne 50 milionów dolarów. Ponadto, zużycie zasobów opieki zdrowotnej u pacjentów z IBS jest o >50%. Dlatego też skuteczne leczenie IBS ma kluczowe znaczenie zarówno dla poszczególnych osób, jak i dla systemów opieki zdrowotnej oraz całego społeczeństwa.
Dokładna przyczyna IBS pozostaje nieznana, co oznacza, że nie ma jednego, jednoczącego wyjaśnienia objawów jelitowych, na które można ukierunkować terapię. Pacjenci z IBS wykazują nieprawidłowe centralne przetwarzanie bólu, nadwrażliwość trzewną i wyższy poziom psychologicznych współzależności w porównaniu ze zdrowymi osobami bez objawów jelitowych. W rezultacie, leki przeciwdepresyjne zostały wprowadzone jako leczenie IBS, ponieważ mają one właściwości modyfikujące ból. Serotonina (5-HT), poprzez receptory 5-HT3 i 5-HT4, odgrywa istotną rolę w kontroli motoryki przewodu pokarmowego, wydzielania i odczuwania. Ponadto, ostatnie obserwacje wykazały, że stężenie 5-HT w osoczu jest zmniejszone u pacjentów z IBS.
W wielu badaniach wykazano, że pacjenci z IBS mają nieprawidłową osobowość, jak również wyższe wyniki lęku i depresji. Jednak w wielu badaniach oceniano skuteczność leków przeciwdepresyjnych w IBS; ich dowody kliniczne są nadal kontrowersyjne. Najczęściej stosowanymi lekami przeciwdepresyjnymi są selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI), takie jak fluoksetyna i citalopram oraz trójpierścieniowe leki przeciwdepresyjne (TCA), takie jak imipramina i amitryptylina.
Jako selektywny inhibitor wychwytu zwrotnego serotoniny, sertralina działa poprzez blokowanie wychwytu zwrotnego serotoniny w szczelinach synaptycznych OUN, zwiększając w ten sposób stężenie serotoniny w mózgu, co wiąże się z jej działaniem psychiatrycznym. Sertralina została zatwierdzona do użytku w Stanach Zjednoczonych w 1991 roku, i pozostaje w szerokim użyciu, z prawie 40 milionów recept są wypełniane rocznie. Jest ona dobrze znana w leczeniu depresji i zaburzeń lękowych. Również uważany za jeden z selektywnych inhibitorów wychwytu zwrotnego serotoniny, który ma mechanizm regulacji bólu, więc jest powszechnie stosowany w zaburzeniach psychosomatycznych, jak również .
To badanie porównywało skuteczność sertraliny do efektu placebo (konwencjonalna terapia jako leki przeciwskurczowe i przeciwbiegunkowe) w odniesieniu do ich wpływu na objawy jelitowe zespołu jelita drażliwego, jak również lęk i objawy depresyjne związane z.
Metody
Prezentowane badanie było prospektywnym, randomizowanym badaniem klinicznym z zastosowaniem sertraliny i placebo, trwającym 1 miesiąc, z pojedynczo zaślepioną próbą leczenia i zaślepionymi miarami wyników. Składało się z 55 pacjentów, u których niedawno rozpoznano zespół jelita drażliwego (IBS) zgodnie z kryteriami Rzym III, którzy zostali zrekrutowani w ciągu 4 tygodni z przychodni przy Szpitalu Uniwersyteckim w Assiut.
Rozmiar próby
W badaniach kontrolowanych przypadków IBS, często obserwuje się 50% odpowiedź na placebo. Co więcej, w badaniach otwartych obserwowano wskaźniki odpowiedzi na leki przeciwdepresyjne do 89%. Używając tych liczb i przy mocy 80%, uzyskano wielkość próby dla każdej grupy.
Przedmioty i projekt badania
Byli to pacjenci w wieku od 18 do 40 lat. Do badania włączono wyłącznie pacjentów, u których niedawno rozpoznano IBS, a czas trwania choroby nie przekraczał 5 lat. Ponadto, wszyscy pacjenci nie byli wcześniej leczeni innymi selektywnymi inhibitorami wychwytu zwrotnego serotoniny. U wszystkich pacjentów wykonano wszystkie rutynowe badania, w tym pełną morfologię krwi, ocenę czynności nerek i wątroby oraz pomiar elektrolitów. Skala oceny lęku Hamiltona (HAM-A) i skala oceny depresji Hamiltona (HAM-D) zostały wykonane u wszystkich pacjentów na poziomie podstawowym przed rozpoczęciem leczenia. Pacjenci zostali podzieleni na dwie grupy, pierwsza grupa to 30 pacjentów, którzy otrzymywali sertralinę w dawce 50 mg, a druga grupa to 25 pacjentów, którzy otrzymywali placebo. Zaślepienie było ukryte podczas całego randomizowanego badania klinicznego. Pacjenci byli obserwowani przez jeden miesiąc po leczeniu. Ponowna ocena pacjentów została przeprowadzona w odniesieniu do ich objawów jelitowych. Poprawa objawów jelitowych została uznana, gdy nastąpiło odpowiednie złagodzenie objawów zgłaszanych przez pacjentów po 4 tygodniach stosowania leku. Ponadto, skala oceny lęku Hamiltona (HAM-A) i skala oceny depresji Hamiltona (HAM-D) zostały wykonane dla wszystkich pacjentów jeden miesiąc po leczeniu.
Kryteria wykluczenia
1. Pacjenci, u których występowały objawy jelitowe, ale którzy nie spełniali kryteriów rzymskich III dla rozpoznania zespołu jelita drażliwego.
2. Pacjenci, u których zespół jelita drażliwego trwał dłużej niż 5 lat.
3. Pacjenci, u których występował ciężki lęk i/lub depresja według HAM-A i HAM-D odpowiednio.
4. Pacjenci, którzy nie spełniali kryteriów wiekowych.
5. Pacjenci, którzy otrzymywali jakiekolwiek inne leki.
6. Pacjenci, którzy mieli jakiekolwiek przewlekłe schorzenia.
Analiza danych
W badaniu wykorzystano pakiet SPSS w wersji 16. Do porównania wpływu sertraliny i placebo na objawy jelitowe użyto statystyk opisowych. Do porównania wpływu sertraliny i placebo na skalę Hamiltona dla lęku (HAM-A) i skalę Hamiltona dla depresji (HAM-D) użyto testu T dla prób sparowanych.
Wyniki
Badanie obejmowało 55 pacjentów z zespołem jelita drażliwego, którzy zostali zdiagnozowani zgodnie z kryteriami Rzym III. Jeśli chodzi o dane demograficzne, średni wiek pacjentów wynosił 26 ± 2,1 roku, a stosunek kobiet do mężczyzn wynosił 1,7/1, ponieważ było 32 kobiety w porównaniu z 18 mężczyznami.
Najczęstszym objawem ze strony przewodu pokarmowego był dyskomfort w jamie brzusznej, który stwierdzono u wszystkich pacjentów (100%), a następnie wzdęcie brzucha i jego rozdęcie, które stwierdzono u 36 pacjentów (65,45%). Trzecim częstym objawem była poprawa objawów przy defekacji, którą stwierdzono u 32 pacjentów (58,18%), a ostatnim najrzadziej występującym objawem była zmienność rytmu wypróżnień, którą stwierdzono u 29 pacjentów (52,7%). Pacjenci z IBS-C częściej doświadczali wzdęcia brzucha i poprawy objawów przy defekacji, podczas gdy pacjenci z IBS-D częściej doświadczali naprzemiennych nawyków jelitowych (Rycina 1).
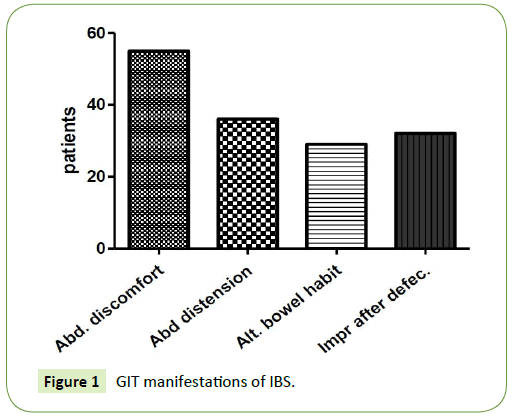
Rycina 1: GIT manifestacje IBS.
Pacjentów podzielono na dwie grupy. 30 pacjentów otrzymało sertralinę w dawce 50 mg, a 25 pacjentów otrzymało placebo. U 20 pacjentów otrzymujących sertralinę w dawce 50 mg stwierdzono poprawę objawów jelitowych (7 pacjentów z zespołem jelita drażliwego z przewagą biegunki i 13 pacjentów z zespołem jelita drażliwego z przewagą zaparć), natomiast u 10 pacjentów (4 pacjentów z zespołem jelita drażliwego z przewagą biegunki i 6 pacjentów z zespołem jelita drażliwego z przewagą zaparć) nie stwierdzono zadowalającej poprawy objawów jelitowych.
Z drugiej strony, 8 pacjentów, którzy otrzymali placebo wykazało poprawę objawów jelitowych (5 pacjentów miało zespół jelita drażliwego z przewagą biegunki i 3 pacjentów miało zespół jelita drażliwego z przewagą zaparcia), podczas gdy 17 pacjentów (12 pacjentów miało zespół jelita drażliwego z przewagą biegunki i 5 pacjentów miało zespół jelita drażliwego z przewagą zaparcia) nie wykazało poprawy objawów jelitowych (Tabela 1 i Rycina 2).
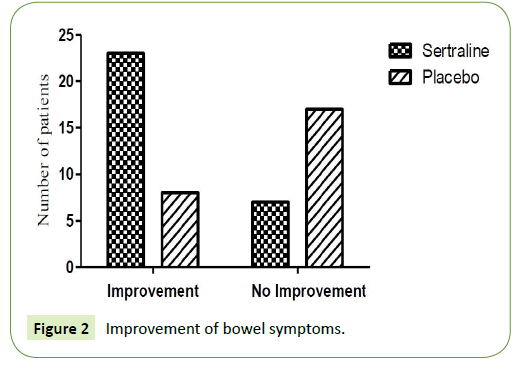
Ryc. 2: Poprawa objawów jelitowych.
Uwaga: IBS-D: zespół jelita drażliwego z dominującą biegunką, IBS-C: zespół jelita drażliwego z dominującym zaparciem
Tabela 1:Liczba pacjentów, u których stwierdzono poprawę objawów jelitowych po miesiącu stosowania leku.
Dwie badane grupy porównano pod względem skali oceny Hamiltona odpowiednio dla lęku i depresji. Stwierdzono znaczące zmniejszenie skali Hamiltona dla lęku (HAM-A) i skali Hamiltona dla depresji (HAM-D) po miesiącu w grupie pacjentów, którzy byli leczeni sertraliną w dawce 50 mg. Średnia HAM-A wynosiła 18,8 ± 3,9 przed leczeniem i osiągnęła 11,67 ± 1,9 po miesięcznym leczeniu sertraliną. Ponadto, średnia HAM-D wynosiła 15,67 ± 3,9 przed leczeniem i osiągnęła 11,6 ± 4,2 po jednomiesięcznym leczeniu sertraliną (P=0,001). W grupie pacjentów, którzy otrzymywali placebo, nie zaobserwowano istotnego zmniejszenia wartości skali Hamiltona dla lęku (HAM-A) i skali Hamiltona dla depresji (HAM-D) po miesiącu. Średnia HAM-A wynosiła 18,5 ± 2,6 przed leczeniem i osiągnęła 18,2 ± 2,4 po miesięcznym leczeniu placebo (P=0,12) (tab. 2). Ponadto, średnia HAM-D wynosiła 13,4 ± 2,1 przed leczeniem i osiągnęła 13 ± 1,7 po jednomiesięcznym leczeniu placebo (P=0,15) (ryc. 3 i 4).
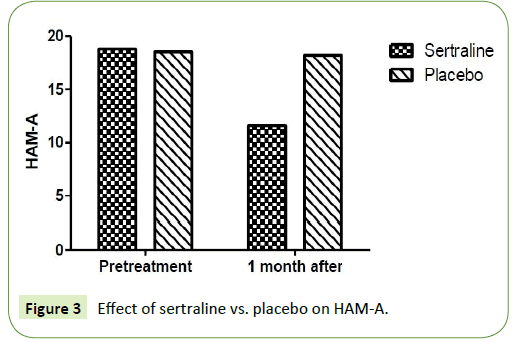
Rycina 3: Wpływ sertraliny vs. placebo na HAM-A.
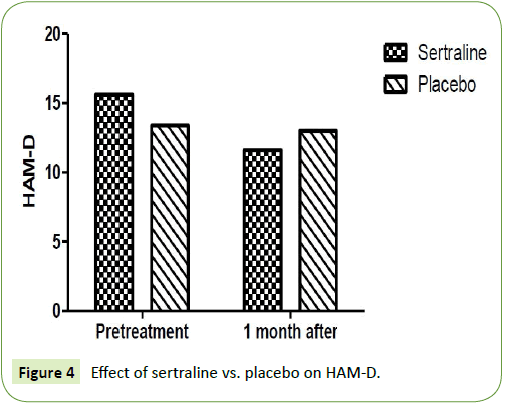
Rycina 4: Wpływ sertraliny vs. placebo na HAM-D.
Tabela 2: The effect of sertraline Vs placebo on HAM-A and HAM-D.
Dyskusja
W piśmiennictwie w sześciu badaniach omówiono wpływ selektywnych inhibitorów wychwytu zwrotnego serotoniny (SSRI) w leczeniu IBS, uzyskując sprzeczne wyniki. W czterech badaniach dotyczących paroksetyny, fluoksetyny i citalopramu odnotowano umiarkowaną korzyść, natomiast w dwóch badaniach dotyczących fluoksetyny i citalopramu nie odnotowano takiej korzyści.
Metaanaliza tych badań wykazała, że względne ryzyko braku poprawy objawów zespołu jelita drażliwego (IBS) wynosi 0,62 (95% CI, 0,45 do 0,87) dla SSRI w porównaniu z placebo, przy czym pomiędzy tymi badaniami występowała znaczna heterogeniczność. W metaanalizie przeanalizowano dane 113 osób leczonych SSRI i 117 osób z grupy kontrolnej.
Różnice wyników między tymi sześcioma badaniami mogą wynikać z różnic w projekcie badania, jak również w populacji pacjentów. Kuiken i wsp. zrekrutowali 40 pacjentów z IBS wszystkich podtypów z ośrodka trzeciorzędowego do 6-tygodniowego badania z fluoksetyną lub placebo, pacjenci z depresją zostali wykluczeni z tego badania. Tabas i wsp. randomizowali 81 pacjentów z IBS wszystkich podtypów do 12-tygodniowego badania z zastosowaniem diety wysokobłonnikowej z paroksetyną lub placebo, pacjenci z depresją nie zostali wykluczeni z tego badania. Vahedi i wsp. randomizowali 44 pacjentów z IBS z dominującym zaparciem do fluoksetyny lub placebo w 12-tygodniowym badaniu, ale tylko pacjenci z ciężką depresją zostali wykluczeni. Tack i wsp. włączyli 23 pacjentów z IBS z ośrodka opieki trzeciorzędowej do badania krzyżowego porównującego citalopram vs. placebo, pacjenci z depresją zostali wykluczeni z tego badania .
Ladabaum i wsp. randomizowali 27 pacjentów z IBS, którym podawano citalopram 20 mg/dobę przez 4 tygodnie, a następnie citalopram 40 mg/dobę przez kolejne 4 tygodnie, ale objawy psychiatryczne nie były oceniane u tych pacjentów .
Talley i wsp. randomizowali 51 pacjentów z IBS wszystkich typów do citalopramu (17 badanych), imipraminy lub placebo (16 badanych) przez 12 tygodni, wykluczyli z tego badania również pacjentów z depresją.
Cechy prób, w których wykryto pewne korzyści, obejmują brak wykluczenia dla depresji, włączenie tylko pacjentów z IBS z przewagą zaparć oraz projekt krzyżowy z pacjentami z opieki trzeciorzędowej
Szczególny lek, dawka i czas trwania stosowane w każdej próbie mogą być ważnymi czynnikami, ale nie wyłania się żaden wyraźny wzór. Badanie Tack i wsp. jest jedynym, które wykazało korzyści dla citalopramu, podczas gdy badanie Talley i wsp. wykazało identyczne wskaźniki odpowiedzi dla citalopramu i placebo, a Ladabaum i wsp. znaleźli dowody przeciwko istotnym korzyściom z citalopramu w leczeniu objawów jelitowych IBS. W badaniach stosowano różne definicje odpowiedzi klinicznej, co może wyjaśniać znaczną część konfliktu we wnioskach.
Niektóre z nich stosowały odpowiednie złagodzenie objawów IBS jako główny wynik, jak Talley i wsp. W przeciwieństwie do tego, inne badania oceniały globalną odpowiedź na objawy, ogólne samopoczucie lub wpływ na określone objawy.
Nasze badanie jest pierwszym badaniem, w którym omówiono wpływ sertraliny w leczeniu IBS. Stwierdziliśmy, że sertralina ma znaczący wpływ na objawy jelitowe zespołu jelita drażliwego (IBS) w porównaniu z placebo. Poprawa po zastosowaniu sertraliny wynosiła około 66,67% w porównaniu z placebo, które wynosiło 32%. Nasze badanie wykazało, że wpływ sertraliny na IBS z przewagą zaparć jest lepszy niż jej wpływ IBS z przewagą biegunki, można to wyjaśnić zwiększeniem tranzytu jelitowego z serotoniną, która może zwiększyć objawy biegunkowe IBS. Ponadto, badanie to wykazało znaczące zmniejszenie objawów lękowych i depresyjnych w grupie sertraliny w porównaniu z grupą placebo, które oceniano za pomocą skali Hamiltona dla lęku (HAM-A) i skali Hamiltona dla depresji (HAM-D) odpowiednio.
Sertralina może być skuteczna w leczeniu IBS ze względu na wysoką częstość współwystępowania IBS i zaburzeń psychicznych, ponieważ jego pochodzenie może obejmować zarówno procesy fizjologiczne, jak i psychologiczne. Stres jest zwykle związany z początkiem i nasileniem objawów u pacjentów z IBS, ponieważ przewód pokarmowy jest wrażliwym celem dla stresu. Ponadto, wyniki leczenia, wizyty w szpitalu, jak również doświadczenie chorobowe są niekorzystnie wpływa stres, lęk i zaburzenia depresyjne, jak również maladaptacyjne mechanizmy radzenia sobie .
Zaburzenia sensoryczne, zwłaszcza nadwrażliwość trzewna (VHS) -który jest klinicznym markerem IBS- również został uznany za patofizjologii IBS . VHS jest reprezentowana przez zwiększone uczucie bólu, gdy okrężnica miednicy jest distended z nadmuchanym balonem odbytnicy . Hazlett-Stevens i wsp. którzy stwierdzili, że lęk specyficzny dla wrażeń trzewnych był silnym predyktorem IBS . Osoby z lękiem miały tendencję do katastrofizowania swoich zmartwień konsekwencje i z drugiej strony, hipochondryczne tendencje osób z lękiem . Te fizyczne objawy IBS może wzmocnić ich niepokój i niezdolność do tolerowania i radzenia sobie z tych dyskomfortów, tworząc w ten sposób błędne koło między tych fizycznych i psychologicznych objawów.
Więc, efekt sertraliny może być przypisany do jej działania przeciwdepresyjnego i anksjolitycznego. Ponadto sertralina zmienia rdzeniową modulację bodźców nocyceptywnych, jak również wpływa na aktywność jądra migdałowatego i proces osi mózg-jelito poprzez hamujące zstępujące systemy modulacji bólu.
Wnioski
Sertralina jest skuteczna w leczeniu zespołu jelita drażliwego, zwłaszcza u osób, u których współwystępuje depresja i/lub lęk. Zaleca się jej stosowanie u pacjentów z niedawno rozpoznanym zespołem jelita drażliwego oraz u pacjentów z przewagą zaparć w przebiegu IBS. Konieczne są dalsze badania w celu przedyskutowania roli sertraliny w IBS z wykluczeniem depresji i lęku. Ponadto w dalszych badaniach należy rozważyć dłuższy czas trwania i większą liczebność próby w celu wykrycia całkowitego złagodzenia objawów i nawrotu objawów, jeśli do niego doszło.
Konflikt interesów
Nie zgłoszono konfliktu interesów.
- Lovell RM, Ford AC (2012) Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 10: 712-721.
- Lovell RM, Ford AC (2012) Prevalence of gastro-esophageal reflux-type symptoms in individuals with irritable bowel syndrome in the community: A meta-analysis. Am J Gastroenterol 107: 1793.
- Drossman DA (1993) US householder survey of functional gastrointestinal disorders. Dig Dis Sci 38: 1569-1580.
- Everhart JE, Ruhl CE (2009) Burden of digestive diseases in the United States part I: overall and upper gastrointestinal diseases. Gastroenterology 136: 376-386.
- Inadomi J, Fennerty MB, Bjorkman D (2003) The economic impact of irritable bowel syndrome. Aliment Pharmacol Ther 18: 671-682.
- Tillisch K, Mayer EA, Labus JS (2011) Quantitative meta-analysis identifies brain regions activated during rectal distension in irritable bowel syndrome. Gastroenterology 140: 91-100.
- Moriarty KJ, Dawson AM (1982) Functional abdominal pain: further evidence that whole gut is affected. Br Med J (Clin Res Ed) 284: 1670-1672.
- Trimble K (1995) Heightened visceral sensation in functional gastrointestinal disease is not site-specific. Dig Dis Sci 40: 1607-1613.
- Osterberg E (2000) A population study on irritable bowel syndrome and mental health. Scand J Gastroenterol 35: 264-268.
- Whitehead WE, Palsson O, Jones KR (2002) Systematic review of the comorbidity of irritable bowel syndrome with other disorders: what are the causes and implications? Gastroenterology 122: 140-1156.
- McQuay H (1996) A systematic review of antidepressants in neuropathic pain. Pain 68: 217-227.
- Saarto T, Wiffen PJ (2007) Antidepressants for neuropathic pain. Cochrane Database Syst Rev CD005454.
- Mayer EA, Bradesi S (2003) Alosetron and irritable bowel syndrome. Expert Opin Pharmacother 4: 2089-2098.
- Deechakawan W (2014) Anxiety, depression, and catecholamine levels after self-management intervention in irritable bowel syndrome. Gastroenterol Nurs 37: 24-32.
- Pinto C (2000) Stressful life-events, anxiety, depression and coping in patients of irritable bowel syndrome. J Assoc Physicians India 48: 589-93.
- Iii GRL (2004) Psychosocial factors are linked to functional gastrointestinal disorders: A population based nested case-control study. Am J Gastroenterol 99: 350.
- McLeod AL (2015) Effects of anti-anxiety drugs and other anthropogenic contaminants on fathead minnow behavior and brain chemistry. Thesis submitted to the Graduate School of Clemson University, USA.
- Tabas G (2004) Paroxetine to treat irritable bowel syndrome not responding to high-fiber diet: a double-blind, placebo-controlled trial. Am J Gastroenterol 99: 914.
- Vahedi H (2005) The effect of fluoxetine in patients with pain and constipationâĂâ¬ĂĂÂÂpredominant irritable bowel syndrome: Podwójnie zaślepione, randomizowane i kontrolowane badanie. Aliment Pharmacol Ther 22: 381-385.
- Tack J (2006) A controlled crossover study of the selective serotonin reuptake inhibitor citalopram in irritable bowel syndrome. Gut 55: 095-1103.
- Ladabaum U (2010) Citalopram is not-effective therapy for non-depressed patients with irritable bowel syndrome. Clin Gastroenterol Hepatol 81: 42.
- Kuiken SD, Tytgat GN, Boeckxstaens GE (2003) The selective serotonin reuptake inhibitor fluoxetine does not change rectal sensitivity and symptoms in patients with irritable bowel syndrome: a double blind, randomized, placebo-controlled study. Clin Gastroenterol Hepatol 1: 219-228.
- Talley NJ (2008) Antidepressant therapy (imipramine and citalopram) for irritable bowel syndrome: a double-blind, randomized, placebo-controlled trial. Dig Dis Sci 53: 108-115.
- Ford AC (2009) Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: systematic review and meta-analysis. Gut 58: 367-378.
- Longstreth GF (2006) Functional bowel disorders. Gastroenterology 130: 1480-1491.
- Drossman DA (2000) What determines severity among patients with painful functional bowel disorders & quest. The Am J Gastroenterol 95: 974-980.
- Wilder-Smith C (2004) Brain functional magnetic resonance imaging of rectal pain and activation of endogenous inhibitory mechanisms in irritable bowel syndrome patient subgroups and healthy controls. Gut 53: 1595-1601.
- Hazlett-Stevens H (2003) Prevalence of irritable bowel syndrome among university students: the roles of worry, neuroticism, anxiety sensitivity and visceral anxiety. J Psychosom Res 55: 501-505.
- Keefer L (2005) Towards a better understanding of anxiety in irritable bowel syndrome: a preliminary look at worry and intolerance of uncertainty. J Cogn Psychother 19: 163-172.
.